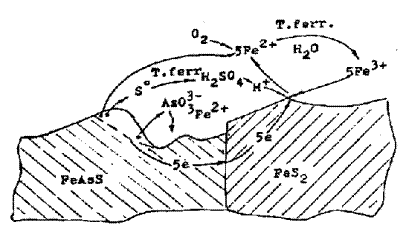
 |
Рисунок 6.
Одним из основных параметров при бактериальном выщелачивании является температура среды, т.к. от нее зависит протекание биологических процессов, в которых температура влияет на скорость ферментативных процессов, стабильность фермента, скорость распада фермент-субстратного комплекса, на сродство фермента к субстрату, на сродство фермента к активаторам и ингибиторам, на изменение концентрации растворенного кислорода и углекислого газа. При изменении температуры изменяется растворимость ферментов, происходит модификация клеточных структур, инактивация ферментов, изменяется состав липидов и т.п.
Известно, что оптимальной для жизнедеятельности мезофильных бактерий А. ferrooxidans является температура 28-350С. При 400С прекращается их рост, а при 500 в результате денатурации белка происходит дезактивация ферментов и мезофильные бактерии погибают. При низких температурах скорость роста бактерий замедляется ввиду того, что клетка становится неспособной синтезировать более высоконасыщенные жирные кислоты, входящие в состав липидов. При этом естественно снижается их окислительная активность.
Наибольшая скорость выщелачивания мышьяка из арсенопирита наблюдается при температуре 350С, когда его извлечение в 1,3 и 4,3 раза больше, чем при температуре 30 и 200С. Наблюдаемая во всех случаях колоколообразная форма кривой зависимости активности микроорганизма от температуры, характерна для ферментативного механизма окисления, т.к. одной из специфичных особенностей действия ферментов катализаторов является их строгая термолабильность. Температурный коэффициент Q10 при окислении железа составляет 2,0, а при выщелачивании сульфидных минералов 2-3.
Практика бактериального выщелачивания золотомышьяковых концентратов показала, что наиболее интенсивно процесс идет при температуре 400С , когда помимо мезофильных бактерий А.ferrooxidans, А.thiooxidans и Leptospirillum ferrooxidans присутствуют умеренные термофилы, которые принимают участие в окислении сульфидов при температуре 40-450С.
При аэробном метаболизме тионовых микроорганизмов А.ferrooxidans кислород выполняет роль акцептора электронов при участии ферментов - оксидаз. Помимо кислорода эти бактерии, являющиеся строгими автотрофами, ассимилируют углерод из СО2, который они потребляют из окружающей их среды. Поэтому при бактериальном выщелачивании с участием А.ferrooxidans газовый состав среды, т.е. количество находящегося в ней кислорода и углекислого газа, является одним из основных параметров, определяющих рост, активность бактерий и скорость биологического окисления. Количество О2 и СО2, находящихся в среде при обычных условиях (8,1 мг/л и 0,03%) явно недостаточно для поддержания активной жизнедеятельности микроорганизмов. Даже при окислении закисного железа объем потребляемого кислорода и углекислого газа превышает примерно в 180 и 80 раз максимальные количества их, растворенных в среде. Поэтому большое внимание при организации процесса бактериального выщелачивания должно уделяться аэрации пульпы, которая при чановом методе может осуществляться при механическом перемешивании, засасыванием воздуха из атмосферы и принудительной подачей его под давлением. Например, аэрация в чанах позволяет увеличить скорость окисления железа в 7 раз. Для окисления одного килограмма закисного железа бактериями необходимо 0,14 кг кислорода. Один килограмм элементной серы бактерии окисляют до сульфат- ионов, потребляя 2 кг кислорода. Такое количество кислорода в пульпе может обеспечить только принудительная аэрация.
Однако до сих пор опытным путем не установлена необходимая степень аэрации при чановом методе. Имеющиеся в литературе данные по этому важному вопросу крайне противоречивы. В одном случае показано, что при бактериальном окислении закисного железа необходимо продувание одного объема воздуха на один объем среды в час, в другом - три объема на объем в час. И в то же время из микробиологии известно, что при слишком интенсивной аэрации рост аэробных микроорганизмов может подавляться, особенно если они находятся в солевой питательной среде при концентрации клеток более 107 кл/мл. Поэтому микробиологи рекомендуют начинать аэрацию таких бактериальных сред не ранее, чем через 1-1,5 часа, когда бактерии входят в экспоненциальную фазу.
Проведенные исследования по влиянию воздуха на бактериальное окисление железа показали, что активность бактерий не подавляется даже при такой степени аэрации как 300 объемов воздуха на один объем среды в час при его высокой степени диспергации. В промышленных условиях считалось, что расход воздуха должен быть не менее одного объема на один объем пульпы в минуту. Такой расход воздуха значительно повышает затраты на процесс выщелачивания. Поэтому считается, что остаточная концентрация кислорода в пульпе не должна быть менее 2 мг/л.
В условиях бактериального выщелачивания сульфидсодержащих продуктов, когда растворимость кислорода в пульпе по сравнению со средой 9К уменьшается из-за высокой концентрации различных соединений, как органических, так и неорганических, и большого количества в пульпе твердых частиц- сульфидов, диффузия кислорода в жидкую фазу становится фактором, лимитирующим процесс выщелачивания. При выщелачивании одного из золотомышьяковых концентратов на каждый объем пульпы поглощается кислорода в 3-4 раза больше, чем его содержание в том же объеме бактериального раствора. А при выщелачивании в пачуках с количеством биомассы в жидкой фазе пульпы 108-109кл/мл расход воздуха составляет не менее 1-2 объемов на один объем пульпы в минуту. При таком расходе концентрация кислорода не снижается ниже 4 г/л. При бактериальном выщелачивании золотомышьякового концентрата Олимпиадинского месторождения расход воздуха составил 0,6 м3 на 1 м3 пульпы в минуту, а на некоторых зарубежных установках он равен 0,25-0,30 м3 на 1 м3 пульпы. При выщелачивании медно-цинковых продуктов остаточная концентрация кислорода определена не менее 1,6 мг/л.
Для повышения активности микроорганизмов и интенсификации окислительных процессов необходимо в воздушной смеси, подаваемой на аэрацию поддерживать концентрацию СО2 в пределах 0,1-0,15%. При этом активность микроорганизмов возрастает на 35%.
С целью активации аэрирующего воздуха при подаче его в выщелачиваемую пульпу и повышении количества кислорода в ней возможна дополнительная подача активного окислителя - озона, при распаде которого образуются атомарный и молекулярный кислород. При подаче озоно-воздушной смеси, содержащей всего 0,01-0,02% озона, скорость бактериального окисления железа увеличивается в 20-60 раз. Значительно увеличивается скорость выщелачивания сульфидов.
Биологические параметры.
Для нормального роста и развития бактерий требуется наличие в среде минеральных солей (биогенов), и в первую очередь соединений азота и фосфора, которые используются бактериями в энергетическом метаболизме. При бактериальном выщелачивании с использованием культуры А.ferrooxidans обычно используется среда Сильвермана и Лундгрена, называемая среда 9К, в состав которой входят, г/л:
(NH4)2SO4 - 3,0 г;
KCl - 0,1 г ;
K2PO4 - 0,5 г;
MgSO4. 7H2O - 0,5 г
Ca(NO3)2 - 0,01 г
FeSO4 . 7H2O - 44,2 г.
Иногда вместо FeSO4· 7H2O используют соль Мора FeSO4·(NH4)2SO4·6H2O (63г/л) в этом случае (NH4)2SO4 в среду не добавляется. При таком составе содержание Fe2+ в среде составляет около 9 г/л. Иногда используют среду 9К/2, в которой содержание Fe2+ уменьшается в 2 раза, или 9К/4, в которой количество Fe2+ уменьшается в 4 раза. При бактериальном выщелачивании сульфидсодержащих концентратов железо не подается, а вместо солей азота и фосфора применяются удобрения типа аммофос (0,5 г/л). Если же в концентратах содержится фосфор, например в виде апатита, то соли фосфора можно в среду не подавать.
Одним из самых важных условий протекания бактериальных окислительных процессов является использование активной культуры клеток. Активность различных штаммов бактерий, выделенных из рудничных вод, имеющихся в лабораториях и музеях, неодинакова при окислении неорганических субстратов- серы, железа, сульфидных минералов. Так, культура бактерий, выделенная непосредственно из рудничных вод месторождения и выросшая в них при определенных условиях среды обитания (рН, тип сульфидов, солевой состав вод, температурный режим, наличие ингибирующих соединений), как правило, более активна при выщелачивании металлов из руды этого месторождения.
В технологии чанового бактериального выщелачивания в плотных пульпах применение высокоактивных штаммов, устойчивых к экстремальным условиям, является одним из параметров, определяющих скорость процесса и, естественно, его экономичность. Имеются штаммы культур, устойчивые к следующим концентрациям металлов в растворах, г/л: мышьяка 6-10, железа 15-20, урана 12, меди 50, цинка 40-50, алюминия 20, никеля 72, хлор-иона 10, молибдена 0,2, серебра 0,01 и кадмия 0,82.
Известно, что некоторые металлы при низких концентрациях стимулируют рост многих микроорганизмов, но при повышении концентрации их сначала наступает ингибирование, а затем полное подавление активности и роста клеток. Объясняется это тем, что металлы могут связывать свободные SH-группы, подавляя ферменты, содержащие эти группы. Кроме того, некоторые металлы могут входить в активную часть ферментов (как медь и железо в цитохромы), другие являются активаторами ферментов. Однако при больших концентрациях металлы могут связываться с молекулами самого фермента и инактивировать его.
Все это свидетельствует о возможности получения культуры, обладающей свойствами, необходимыми для ее промышленного использования путем адаптации к повышенным концентрациям выщелачиваемых элементов. Такой штамм “производственной” культуры должен иметь высокую активность, хорошую кинетическую характеристику и устойчивость к высоким концентрациям элементов, переходящих в жидкую фазу при выщелачивании.
Наиболее токсичным для бактерий А.ferrooxidans является трехвалентный мышьяк- сильный ингибитор железоокисляющей способности бактерий. Продолжительность лаг-фазы развития бактерий увеличивается при концентрации мышьяка 2 г/л до 48 часов и при концентрации 4 г/л до 120 часов. Адаптация лабораторных штаммов к мышьяку обычно производится путем последовательного пересева на среду с увеличением концентрации мышьяка. Адаптация и получение производственной культуры проводится в периодическом режиме на среде 9К при Т : Ж = 1:4, в присутствии Fe2+ (10 г/л) или без него. Количество посевного материала обычно составляет 10-15%.
Адаптация микроорганизмов является чрезвычайно чувствительной и специфичной. Например, бактерии, адаптированные к арсенопириту, не окисляют остальные сульфидные минералы. Скорость окисления этими бактериями халькопирита ниже в 13 раз, а пирита в 38 раз.
Очень важное технологическое значение имеет тот факт, что приобретенные адаптивные свойства бактерий, т.е. их повышенная устойчивость к ингибирующим ионам происходит только за счет мутагенных изменений при реализации возможностей их организмов при изменении среды обитания, но без изменения их генотипа. Поэтому адаптивные свойства утрачиваются бактериями при изменении условий среды и для поддержания культуры в активном состоянии необходимо применение режима хемостатного культивирования в условиях выщелачивания продукта, т.е. культура должна находиться постоянно в тех условиях, к которым она была адаптирована.
Процесс адаптации довольно длительный. В промышленных условиях он обычно совмещается с заполнением емкостей выщелачиваемой пульпы при Т:Ж = 1-4 ¸ 1:5 в присутствии Fe2+, питательных солей, температуре 32-350С, при высокой степени аэрации. Активность культуры по мере ее адаптации контролируется степенью окисления Fe2+ , повышением концентрации общего железа, изменением величины рН и ОВП, и обязательно скоростью подачи пульпы. Последнее тесным образом связано со скоростью роста бактерий и концентрацией биомассы.
Использование метода хемостатного культивирования, когда в среду с постоянной скоростью подается свежая среда с субстратом ( Fe2+, сульфиды, концентрат), объем которой поддерживается на постоянном уровне путем равномерного удаления части среды с культурой (рисунок 7).
Cхема хемостатной культуры
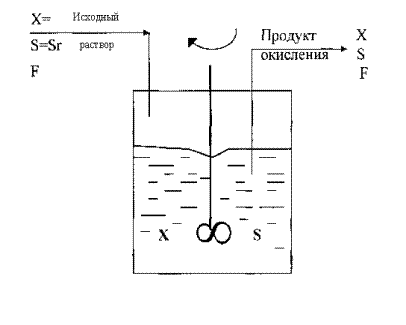
Х – концентрация биомассы,
S – концентрация субстрата,
F – скорость подачи раствора
Рисунок 7.
Хемостат является саморегулирующейся системой с идеальным перемешиванием, обладает высокой технологичностью, на его принципе осуществляется аппаратурное оформление биотехнологических процессов.
В хемостате в установившемся режиме удельная скорость роста бактерий не должна быть меньше скорости разбавления, которая определяется как
D = F/ V, где (9)
D-скорость разбавления, ч -1;
F-величина потока среды или пульпы, л/ч;
V-объем выщелачивающего аппарата, л.
Так, концентрация клеток при окислении закисного железа увеличивается с 103-104 до 108 кл/мл при увеличении D с 0 до 0,04 ч -1 и остается постоянной до D равной 0,08 ч -1. При дальнейшем увеличении скорости разбавления ( выше 0,08- 0,09 ч -1) концентрация клеток уменьшается за счет их вымывания. При этом достигается скорость окисления железа 0,6 г/л×ч. Максимальная удельная скорость роста биомассы mm в этих условиях достигает 0, 15 ч -1. Получение более высоких скоростей окисления железа, значительно превышающих 0,6 г/л×ч, в условиях одностадиального хемостатного культивирования практически невозможно.
При бактериальном выщелачивании золотомышьяковых концентратов Dкрит составило 0,053-0,063. При превышении этих значений происходило вымывание клеток, снижение их количества в жидкой фазе, повышение значения рН, снижение ОВП среды, накопление закисного железа и повышение содержания мышьяка в кеках выщелачивания.
Многочисленные исследования кинетики бактериальных процессов окисления и выщелачивания позволили сделать вывод о том, что скорость окислительных процессов, катализируемых ферментами, прямо пропорциональна концентрации биомассы в определенных пределах. Для окисления закисного железа этот предел составляет 0,05-2,5 г/л биомассы по сырому весу. Поэтому одним из путей интенсификации процессов бактериального окисления и выщелачивания является применение концентрированной биомассы. Это, во-первых, значительно ускоряет процесс, уменьшая общую продолжительность его, снижает эффект ингибирующего действия ионов, перешедших в раствор при выщелачивании, что особенно важно при выщелачивании сложных по составу продуктов. Для получения плотной популяции культуры используются методы центрифугирования, сепарирования, электрохимического, хемостатного культивирования, иммобилизации и применения оборотных растворов.
Известно, что во всех применяемых способах бактериального выщелачивания биомасса, активная и адаптированная, безвозвратно теряется либо с продуктивными растворами при подземном и кучном выщелачивании, либо с пульпой при чановом.
Использование возвращаемой биомассы дает возможность значительно повысить концентрацию активных клеток в пульпе, окислительную активность бактериальных растворов и производительность установок.
Метод электрохимического культивирования является наиболее производительным из всех известных методов, однако выращивание адаптированной культуры в электрохимическом культиваторе в течение 72-96 часов не изменяет адаптивные свойства культуры. Поэтому такая культура может применяться в технологии чанового бактериального выщелачивания вместо адаптированной на начальном этапе процесса, значительно сокращая время ввода его в оптимальный режим. В дальнейшем концентрирование биомассы лучше осуществлять при использовании оборотных растворов или биомассы, выделенной из этих растворов сепарированием или центрифугированием. При выщелачивании золотомышьяковых концентратов скорость выщелачивания арсенопирита напрямую зависит от концентрации биомассы. Если при плотности биомассы 0,025 г/л по сухому весу выщелачивается 0,5 г/л мышьяка за 30 часов, то при плотности 2,5 г/л в раствор перешло мышьяка в 9 раз больше . Оптимальное соотношение концентрации биомассы, концентрации закисного железа и количества твердого в исходной пульпе при выщелачивании золотомышьяковых концентратов как 1:4:100. При таком соотношении за 65 часов выщелачивания содержание сульфидного мышьяка снижается в 3,5 раза, что достигается в присутствии неконцентрированной культуры за 120 часов, т.е. почти в 2 раза медленнее.
Для определения биомассы в технологических процессах выщелачивания применяется экспрессный метод, основанный на центрифугировании, по которому количество клеток пересчитывается по формуле:
x= m × 3,8 × 109 (10)
где х - количество клеток в мл;
m - масса бактерий, г/л по сырому весу.
Применяемые методы концентрирования клеток позволяют повысить их концентрацию до 3-5 г/л и более или 1010- 1011кл/мл.
При бактериальном окислении закисного железа использование иммобилизованной биомассы на твердом носителе позволяет в 2-3 раза уменьшить время окисления.
Технологические параметры
Среди параметров, определяющих эффективность бактериального выщелачивания чановым методом, особое значение приобретают такие специфичные для этого процесса параметры, как плотность выщелачиваемой пульпы, крупность и способ подготовки продукта к выщелачиванию, способ перемешивания и аэрации, схема выщелачивания, методы переработки оборотных растворов, требования к продуктам выщелачивания и т.п. Эти параметры определяют прежде всего технологическую схему, режим процесса и его аппаратурное оформление.
При выщелачивании концентратов и продуктов, имеющих не только сложный вещественный состав, но и различный характер и крупность вкрапленности выщелачиваемых минералов, гранулометрический состав этих продуктов является одним из основных параметров, определяющих кинетику и полноту выщелачивания.
Чановому выщелачиванию, как правило, подвергаются продукты гравитационного и флотационного обогащения, имеющие различную крупность. Гравитационные золотосодержащие концентраты крупностью 1-2 мм перед бактериальным выщелачиванием доизмельчаются до крупности 80-90% класса -0,074 м, т.е. до крупности флотационных концентратов. При этом необходимо определить для каждого конкретного продукта полноту раскрытия минералов и доступность их для действия бактериальных выщелачивающих растворов.
С уменьшением крупности исходного продукта увеличивается скорость выщелачивания и активность микроорганизмов. Увеличение активности бактерий с уменьшением крупности выщелачиваемого продукта безусловно связано с тем, что при тонком измельчении значительно увеличивается поверхность минерального субстрата - сульфидных минералов, являющихся энергетическим источником для микроорганизмов.
Для золотомышьяковых концентратов различного минерального состава крупность перед выщелачиванием должна быть не менее 90-95% класса -0,074 мм (около 80-85%- 0,044 мм), в некоторых случаях , например, при очень тонкой вкрапленности арсенопирита, она должна быть доведена до крупности 90-98% - 0,044 мм.
Так, наиболее высокие показатели извлечения золота достигнуты при крупности выщелачиваемого концентрата 88% класса - 0,044 мм. Для концентратов Майского месторождения крупность составляла в среднем 90-95% - 0,075 мм (86% - 0,044 мм). При такой крупности концентратов значительно повышается скорость выщелачивания арсенопирита, увеличивается извлечение в раствор мышьяка и повышается извлечение золота цианированием.
Характерным является изменение гранулометрического состава выщелачиваемых концентратов. Так, если в исходном концентрате материала крупностью -0,044 мм содержится 57%, то уже после первой стадии выщелачивания выход материала этой крупности достигает 84%, а количество материала крупностью менее 20 мкм увеличивается в два раза.
Изменение гранулометрического состава продуктов выщелачивания со временем может в значительной степени определить время, необходимое для оптимального вскрытия тонковкрапленного золота, а также всю технологическую схему выщелачивания. Как правило, основное количество сульфидов окисляется в первые 24-48 часов, степень окисления их при этом составляет 60-70%. Поэтому целесообразно выделение из выщелачиваемой пульпы уже разрушенных сульфидных минералов, имеющих крупность -0,044 мм, которые направляются на цианирование. Выход материала такой крупности составляет обычно 40-60% от исходного, а извлечение из него золота достигает 90 и более процентов. Так при бактериальном выщелачивании концентратов Майского месторождения при степени окисления сульфидов 67% извлечение золота достигает 96%.
При бактериальном выщелачивании концентрата Кок- Патасского месторождения из материала крупностью -0,044 мм после первой стадии выщелачивания золото цианируется на 90-92%, в то время как из песковой части его извлечение не превышает 81%. Вывод из пульпы уже выщелоченного материала позволил снизить общее время выщелачивания в 2 раза, т.е. на 42 часа.
Плотность выщелачиваемой пульпы также имеет особое значение в технологии чанового выщелачивания, т.к. она определяет производительность процесса по твердому и в конечном итоге основные технико-экономические показатели процесса.
В статических условиях высокие показатели по извлечению металлов достигаются только в сильно разбавленных пульпах ( Т:Ж = 1:50 ). Так при выщелачивании золотомышьякового концентрата Кок-Патасского месторождения, содержащего 10% мышьяка оптимальное соотношением Т:Ж в периодическом режиме составило от 1:30 до 1:50, при котором извлечение мышьяка в растворе достигало 88% за 100 часов. При увеличении плотности пульпы до Т:Ж =1:10 извлечение мышьяка составляло всего 30%, а количество клеток снижается с 106 до 102 в мл. Значительно снижается и их активность. Одной из причин подавления бактериальной активности клеток является накопление в выщелачивающих растворах продуктов окисления арсенопирита и прежде всего мышьяка. Если при Т:Ж = 1:50 содержание его в растворе составляет 1,15 г/л, то при Т:Ж = 1:10 его концентрация повышается до 2,5 г/л.
Создание оптимальных условий для жизнедеятельности микроорганизмов в плотной пульпе возможно только при постоянной смене раствора, т.е. при проточной технологии в непрерывном режиме выщелачивания. Промышленная практика эксплуатации установок чанового выщелачивания показала, что высокая активность бактерий и высокая скорость выщелачивания наблюдается при оптимальном соотношении Т:Ж = 1:4¸1:5. При такой плотности пульпы концентрация мышьяка в жидкой фазе составляет от 3 до 8 г/л в зависимости от его содержания в исходном продукте и оборотных растворах. При концентрации мышьяка более 8 г/л активность бактерий снижается с 2-2,5 г/л×ч до 0,6 г/л×ч при высокой плотности биомассы (2×1010 кл/мл). При этом, однако, в жидкой фазе наблюдается повышение до 40 г/л содержания Fe (III), которое также подавляет активность бактерий.
Отсюда следует очень важный технологический вывод: при выщелачивании золотомышьяковых концентратов с высоким содержанием мышьяка ( более 8-10 %) для поддержания высокой активности биомассы необходимо выделение из жидкой фазы растворенных форм мышьяка и железа (III) - ингибиторов жизнедеятельности клеток. Для концентратов, содержащих 2-3% мышьяка плотность выщелачиваемой пульпы может быть повышена до Т:Ж = 1:3.
При выщелачивании в плотных пульпах большое значение приобретает режим перемешивания и аэрации, создающий благоприятные условия для насыщения пульпы кислородом и углекислым газом. А режим перемешивания и аэрации в свою очередь зависит от типа аппарата, применяемого при выщелачивании. Помимо необходимости оптимального перемешивания и аэрации, выщелачивающие аппараты должны обеспечивать пропускную способность цикла выщелачивания с заданным временем выщелачивания, потребность в кислороде и углекислом газе, создание температурного режима.
Первые укрупненные исследования процесса бактериального выщелачивания в непрерывных условиях проводились в пневматических аппаратах типа “пачук”. При этих исследованиях была показана недостаточная эффективность перемешивания плотной пульпы и недостаточная степень аэрации, когда остаточная концентрация кислорода не превышала 1 мг/л. Поэтому в настоящее время основным типом выщелачивающих аппаратов на всех промышленных установках приняты реакторы (чаны) с механическим перемешиванием и принудительной подачей воздуха. Наилучшими конструкционными материалами для этих чанов являются нержавеющая сталь или углеродистая сталь с резиновой футеровкой, не влияющей на активность клеток. Объем чанов определяется требуемой производительностью и временем выщелачивания.
На первой промышленной установке Файрвью (ЮАР) при производительности 55 т/сутки необходимое время выщелачивания (100 часов) обеспечивается в 10 реакторах с общим объемом 764 м3. На фабрике Сан-Бенто (Бразилия) для бактериального выщелачивания установлен один реактор объемом 580 м3, а на фабрике Ашанти (Гана) 25 реакторов объемом 896 м3 каждый. Общее количество реакторов, снабженных системами аэрации и теплообмена, на большинстве фабрик составляет не менее 5-6. Охлаждение пульпы в чанах обычно осуществляется змеевиками из нержавеющей стали.
Перемешивание пульпы в чанах осуществляется 6- лопастными турбинами, но в последнее время они заменяются импеллерами с осевым потоком. Турбины с радиальным потоком эффективно аэрируют пульпу, но имеют низкую перемешивающую способность и большое потребление энергии, в то время как импеллеры с осевым потоком обеспечивают хорошее перемешивание и потребляют меньше энергии, кроме того, при высоких скоростях вращения они не оказывают вредного влияния на биомассу. Производительность установки с импеллерами с осевым потоком почти в 2 раза выше, чем с турбинами.
В реакторах с импеллерами, снабженных противозавихрительными перегородками утилизация кислорода составляет в среднем 15% ( максимум 25%) при концентрации растворенного кислорода 2,5 мг/л. Эффективность кислородного обмена составила 0,55/КВт×ч.
На фабрике “Конгресс” (Канада) при производительности 113 т/сутки и количестве чанов 10 (225 м3 каждый) удельный расход электроэнергии на перемешивание и подачу воздуха составил 104 квт×ч на 1 тонну концентрата. Снижение энергозатрат на процесс бактериального выщелачивания может осуществляться за счет уменьшения расхода воздуха, степени аэрации и перемешивания, увеличение плотности выщелачиваемой пульпы.
Для переработки упорных золотомышьяковых концентратов разрабатываются новые конструкции биореакторов.
В институте “Иргиредмет” и на Балейской опытной фабрике для процесса бактериального выщелачивания исследовано применение пульсационных колонн с насадками жалюзийного типа с углом наклона лопаток 200. При расходе воздуха 1 м3/мин на 1м3 рабочей емкости колонны происходит снижение энергозатрат в 1,5-2 раза. Весь цикл бактериального выщелачивания вместо 6 пачуков может осуществляться в одной колонне, имеющей удельную производительность в 2-3 раза больше по сравнению с пачуками.
Проведение процесса бактериального выщелачивания во вращающихся барабанах позволит значительно повысить эффективность выщелачивания, увеличить плотность пульпы и скорость бактериального
Дата: 2019-07-30, просмотров: 414.