Бактериально-химическое окисление и выщелачивание сульфидных минералов представляет собой гетерогенный процесс взаимодействия растворенных реагентов ( экзометаболитов бактерий) и самих бактерий с твердым веществом – сульфидным минералом. Оно включает стадии транспорта реагирующих веществ к поверхности минералов и продуктов реакции от т них , а также стадию биохимических реакций, протекающих при участии многочисленных не поверхности клеток и внутри их ферментов. Если кинетика первой стадии подчиняется законам диффузии, то вторая- законам ферментативной кинетики. Имеющиеся в настоящее время данные позволяют предположить, что процесс бактериального окисления сульфидных минералов, проводимый в аппаратах интенсивного перемешивания, протекает в кинетической области. Во-первых, процесс характеризуется отсутствием признаков, обязательных для внешней и внутренней диффузии, и скорость бактериального окисления не зависит от условий перемешивания пульпы в диапазоне режима работы аппаратов для выщелачивания. Во-вторых, скорость окисления железа, серы и сульфидных минералов сильно зависит, как было показано ранее, от температуры. Значение температурного коэффициента Q10 при бактериальном окислении сульфидов в в реакторах с механическим перемешиванием, равно 2-3, что по правилу Вант-Гоффа характерно для реакций, протекающих в кинетической области.
Определенную трудность при исследовании ферментативной кинетики окисления сульфидных минералов представляет выбор субстрата – минерала, по которому будут рассчитываться основные кинетические константы. В каждом отдельном случае на основе предварительных опытов и термодинамических расчетов определяется наименее устойчивый минерал в ряду селективности при бактериальном окислении этих минералов. При окислении мышьяковистых концентратов основной и наиболее легко окисляемый субстрат представлен арсенопиритом FeAsS. Для упрощения расчетов за концентрацию субстрата S принимается масса сульфидного мышьяка в твердой фазе в пересчете на объем раствора. При выщелачивании, например, медно-цинковых концентратов расчет осуществлялся по меди и цинку.
В таблице 3 представлены результаты расчета порядка реакции по субстрату при окислении мышьяксодержащих концентратов бактериями А.ferrooxidans при концентрации биомассы в пульпе 2,5 г/л по сухой массе клеток. Порядок реакции по субстрату определяется по начальным скоростям реакции при различных концентрациях выщелачиваемого субстрата. Для реакции n-го порядка в начальный момент времени скорость окисления равна:
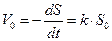
 ( 21 )
( 21 )
где k  – константа скорости реакции, S0 – начальная концентрация выщелачиваемого субстрата.
– константа скорости реакции, S0 – начальная концентрация выщелачиваемого субстрата.
Порядок реакции определяется по уравнению, полученному после логарифмирования уравнения ( 22 ):
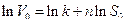 ( 22 )
( 22 )
Таблица 3 - Определение порядка реакции по субстрату при бактериальном выщелачивании мышьяка
| Начальное содержание сульфидного мышьяка, S0, г/л | Начальная скорость выщелачивания мышьяка, V0, г/л ч | ln V0 | Ln S0 | Порядок реакции n |
| 8,7 17,4 18,6 34,8 | 1,34 1,51 1,59 1,72 | 0,12 0 0,08 | 0,693 0,0625 0,0625 | 0,17 0 0,13 |
Как видно из представленной таблицы, порядок реакции бактериального окисления арсенопирита в мышьяксодержащем концентрате меньше 1. Причем при увеличении концентрации сульфидного мышьяка порядок реакции уменьшается с 0,17 до 0,13. При выщелачивании цинка и меди порядок реакции колеблется в интервале от 0 до 1. При бактериальном окислении халькопирита порядок реакции составлял 0,5-0,66.
Значения порядка реакции по субстрату при бактериальном выщелачивании сульфидных минералов характерны для ферментативных реакций. Для описания кинетики этих ферментативных реакций обычно используется уравнение ферментативного катализа Михаэлиса- Ментен:
V = Vmax· S / (S + km),  ( 23 )
( 23 )
Где V – скорость ферментативной реакции, S – концентрация субстрата
Уравнением Михаэлиса-Ментен удобно пользоваться при изучении сравнительно простых ферментативных реакций методом начальных скоростей, например, при бактериальном окислении закисного железа. Однако полные кинетические кривые, когда учитывается накопление продуктов окисления и уменьшение концентрации субстрата, содержат гораздо больше информации, чем в значении скорости, экстраполированной к начальному моменту времени. В этом случае для получения точных значений кинетических параметров должно соблюдаться основное условие – общая концентрация субстрата не должно меняться в течение опыта, т.е. не должно происходить заметного изменения плотности популяции клеток, что достигается при большой концентрации их.
Вторым условием при определении кинетических констант является учет концентрации продуктов реакции окисления субстрата, например, Fe3+, экзометаболиты, SO42-. В связи с этим участок основного протекания ферментативного процесса описывается уравнением:
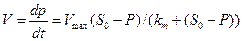 ( 24 )
( 24 )
Уравнение ( 24 ) отличается от уравнения ( 21 ) тем, что в него введена концентрация продукта реакции Р , зависящая от времени окисления. Интегрируя (24) и считая, что в начальный момент времени Р = 0, получается уравнение Михаэлиса-Ментен в интегральной форме:
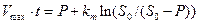 ( 25 )
( 25 )
Линейная анаморфоза уравнения ( 26 ) выражается следующим образом:
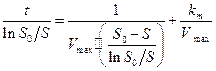 ( 26 )
( 26 )
Она позволяет при нанесении экспериментальных данных в координатах
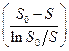 и
и 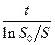
во-первых, определить соответствует ли полученная кинетическая кривая кинетике ферментативной реакции, во-вторых, из одной кинетической кривой определить кинетические константы Vmax и km. Однако по одной кинетической кривой невозможно определить причину замедления реакции.
Основным допущением при изучении кинетики действия ферментов является строгая пропорциональность между концентрацией фермента и начальной скоростью реакции. При окислении сульфидов мышьяка концентрация сухой биомассы изменялась от 0 ( при химическом окислении) до 5 г/л ( при бактериальном окислении). До концентрации биомассы 2,5 г/л начальная скорость реакции Vo строго пропорциональна концентрации бактериальных клеток ( рисунок 8). При большей концентрации происходит насыщение минеральной поверхности и пульпы бактериями и увеличение скорости окисления становится мало зависимым от концентрации биомассы. Отрезок, отсекаемый кривой на оси ординат ( 0,1 г/л ч) численно равен константе скорости реакции химического окисления сульфидов оксидным железом при отсутствии бактерий и при начальной концентрации железа 10 г/л.
Дата: 2019-07-30, просмотров: 345.