Выщелачивания мышьяка
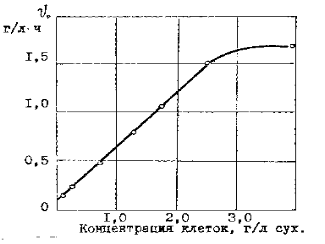
Рисунок 8
Таким образом, использование уравнений (21 ) и ( 24 ) для описания кинетических кривых возможно только до концентрации биомассы 2,5 г/л по сухому весу, поскольку в них входит величина
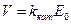 ( 27 )
( 27 )
где, 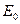 – концентрация «фермента» ( пропорциональна концентрации биомассы),
– концентрация «фермента» ( пропорциональна концентрации биомассы),
kкат – каталитическая константа
Применяя интегральный метод анализа с использованием уравнения ( 27) кинетики бактериального окисления сульфидных минералов в медно-цинковых и мышьяковистых концентратах было показано, что кинетика бактериальных окислительных процессов подчиняется уравнениям ферментативного катализа ( рисунок 9 и 10 ). Определенные кажущие величины констант Км = - 22 г/л и Vmax = -0,15 г/л ч имеют отрицательное значение,
Кинетика выщелачивания цинка из медно-цинкового концентрата
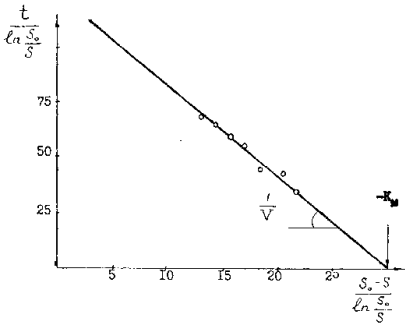
Рисунок 9
что свидетельствует о наличии сильного конкурентного ингибирования ферментативной реакции продуктами выщелачивания (ионами железа, меди, цинка или мышьяка). В этом случае из одной кинетической кривой определить константы невозможно. Поэтому пользуются полными кинетическими кривыми для различных концентраций субстрата.
Кинетика выщелачивания сульфидного мышьяка из золотомышьякового концентрата с использованием биомассы обычной плотности
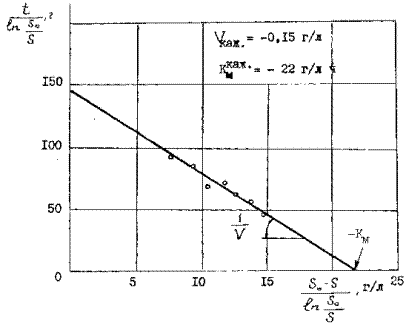
Рисунок 10
Явление конкурентного ингибирования в ферментативном катализе имеет место в случает закрепления ингибитора на активный цент фермента ( конкуренция за активный центр). При этом константа Михаэлиса увеличивается, а максимальная скорость реакции не изменяется. Конкурентное ингибирование продуктом реакции вызвано связыванием фермента продуктом или продуктами реакции Р в непродуктивный комплекс ЕР и может быть представлено в виде трехстадийной схемы
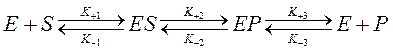 (28)
(28)
Дифференциальное уравнение скорости реакции по схеме ( 28 )можно представить в виде:
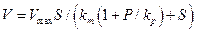 ( 29 )
( 29 )
Для необратимых реакций при бактериальном окислении сульфидов когда k-2→ 0, константа Михаэлиса km = k-1 k+3 + k+2 k+3 / ( k+1 k+2 + k+3 ), а константа ингибирования
kр + k+3/ k-3. Величина константы ингибирования характеризует сродство продукта к ферменту. Форма уравнения ( 29 ) аналогична ( 21 ) , поэтому по одной кинетической кривой нельзя определить замедление реакции по времени в результате накопления продукта окисления или истощением исходного субстрата.
Интегрируя (29 ), а затем линеаризуя, получим уравнение:
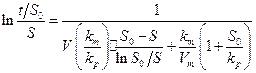 ( 30 )
( 30 )


которое выражается прямой линией в координатах 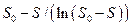 ,
, 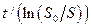
Действительно, при бактериальном окислении сульфидного мышьяка в мышьяксодержащем концентрате неадаптированной к мышьяку культурой А.ferrooxidans этот процесс хорошо описывается интегральным уравнением ферментативной кинетики с конкурентным ингибированием продуктом реакции ( 29 ). При этом на оси абсцисс отсекается отрезок, равный 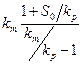 , а наклон прямых к оси абсцисс
, а наклон прямых к оси абсцисс
равен tgφ 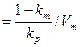
Отрицательное значение тангенса угла наклона характерно для случая km
Дата: 2019-07-30, просмотров: 406.