Оглавление
Оглавление.. 3
ВВЕДЕНИЕ.. 5
1.Основные области использования процессов биотехнологии металлов.. 6
2. Систематика и классификация микроорганизмов.. 9
3. Основные параметры чанового процесса бактериального выщелачивания золотомышьяковых концентратов.. 18
3.1 Физико-химические параметры. 20
3.2 Биологические параметры. 28
3.3.Технологические параметры... 33
4. Теоретические основы бактериального окисления и выщелачивания сульфидных минералов.. 38
4.1. Кинетика бактериального окисления и выщелачивания сульфидных минералов.. 46
4.2. Механизм биохимического окисления железа и сульфидной серы. 59
4.3. Механизм бактериального окисления и выщелачивания сульфидных минералов.. 62
5. Методы интенсификации процессов бактериального окисления и выщелачивания 68
6. Технология чанового бактериально-химического выщелачивания сульфидных концентратов и продуктов.. 74
6.1. Технология бактериального выщелачивания упорных золотомышьяковых концентратов.. 74
6.2. Комбинированная технология переработки мышьяксодержащих продуктов и концентратов с использованием процесса бактериального выщелачивания.. 105
6.3. Технология бактериального выщелачивания коллективных концентратов цветных металлов. 111
7. Технология кучного бактериального выщелачивания медных, и золотосодержащих руд.. 123
8. Промышленная практика технологии чанового бактериального выщелачивания 134
9. Экономика технологии переработки руд цветных металлов с прнменением процесса бактериального выщелачивания.. 145
9.1. Технико-экономический расчет эффективности применения бактериального выщелачивания и бактериальных растворов цинкового купороса при флотационном обогащении упорных медно-цинковых руд.. 149
СПИСОК ЛИТЕРАТУРЫ... 156
ВВЕДЕНИЕ
Бактериальные методы выщелачивания относятся к одному из современных направлений научно-технического прогресса в области переработки минерального сырья - биотехнологии металлов, которая позволяет значительно повысить комплексность использования этого сырья и обеспечить эффективную защиту окружающей среды.
Роль бактерий в круговороте веществ известна давно, однако, как считалось ранее, деятельность всех видов микроорганизмов сводится только к разрушению и преобразованию различных органических соединений. Известно более 2500 видов микроорганизмов и среди них немало тех, которые принимают участие в деструкции и синтезе неорганических веществ, в геохимических процессах на Земле. Открытие С.Н. Виноградским явления хемосинтеза - автотрофного усвоения углекислоты микроорганизмами, окисляющими неорганические вещества, - положило начало исследованиям геохимической деятельности микроорганизмов.
Бактерии «... производят в биосфере огромную геохимическую работу, как разлагая соединения, так и создавая, как следствие этого разложения, новые синтезы. Их роль значительна в истории углерода, серы, азота, железа, марганца и вероятно многих других элементов нашей планеты» - писал основоположник биогеохимии - науки о роли микроорганизмов в геохимических процессах, В.И. Вернадский - «... они обеспечивали и обеспечивают непрерывный поток элементов в биогенном облике веществ на нашей планете». Огромную роль микроорганизмов в природе отмечал и Б.Л.Исаченко_ выдающийся русский микробиолог: « Микробы нарушители равновесия в природе. Бесчисленное множество их своим неустанным участием приводит в беспокойство чуть ли ни все элементы менделеевской системы». Действительно, установлено участие микроорганизмов в концентрировании и рассеивании более 60 элементов, в формировании ореолов из рассеивания, химического состава подземных вод, в генезисе месторождений серы, железа, цветных и редких металлов.
В 1921-22 г. были проведены первые исследования , которые показали, что некоторые неидентифицированные серуокисляющие микроорганизмы способны окислять пирит и сфалерит. В это же время Ваксманом и Джоффи были выделены автотрофные ацидофильные микроорганизмы, окисляющие серу и ее восстановленные соединения до сульфата.
В 1947 году Хинкелем и Колмером из дренажных кислых вод угольной шахты штата Зап. Вирджиния (США) были выделены микроорганизмы, способные принимать участие в окислении двухвалентного железа до трехвалетного. Однако первые установки по выщелачиванию металлов из руд и горных пород появились еще в ХVΙ веке (Венгрия, Германия, Испания) и только в 1958 году был получен патент на процесс кучного бактериального выщелачивания меди в Бингамском Каньоне (США).
Научными трудами крупнейших отечественных и зарубежных микробиологов показана огромная роль бактерий в геохимических процессах образования и разрушения месторождений серы, сульфидных, железных, марганцевых и других руд.
Геологическая микробиология, как наука о роли микроорганизмов в круговороте химических элементов в биосфере из чисто теоретической превратилась в технологическую с большим теоретическим фундаментом. Это произошло благодаря тому, что микробиологические процессы, которые происходят в месторождениях полезных ископаемых, идут настолько интенсивно, что могут направленно использоваться в практических целях.
Биотехнология занимается не только бактериальным выщелачиванием металлов из твердых минеральных субстратов, но и выделением их из промышленных растворов и сточных вод. Особая ценность большинства процессов биотехнологии металлов заключается в минимальном воздействии на окружающую среду или полностью исключающей ее загрязнение.
Особенно большой прогресс в последние годы достигнут в развитии процессов чанового бактериального выщелачивания, основы которого были разработаны в Московском институте стали и сплавов на кафедре обогащения руд цветных и редких металлов, совместно с Институтом микробиологии РАН.
В настоящее время созданы не только научные основы процесса, но и разработаны, испытаны и действуют промышленные установки чанового процесса бактериального выщелачивания .
Рисунок 1
Независимо от вида применяемого технологического процесса современное микробиологическое выщелачивание представляет собой специфичный гидрометаллургический процесс, при котором окисление и выщелачивание сульфидных минералов осуществляется в сернокислой среде в присутствии хемолитоавтотрофных тионовых бактерий.
Чановый метод бактериального выщелачивания (БВ) является сравнительно новым. Развитие его связано с необходимостью переработки труднообогатимых руд, промпродуктов и некондиционных упорных концентратов, получаемых при обогащении сложного полиметаллического сырья, для которых обычные механические и физико-химические методы переработки малоэффективны. Практическая ценность этого метода заключается в том, что он может применяться для очистки концентратов от таких вредных примесей, как мышьяк, для разрушения кристаллической решетки сульфидных минералов с целью вскрытия тонковкрапленного в них золота, для селективного извлечения металлов из коллективных концентратов или промпродуктов, для повышения качества некондиционных концентратов и т.п.
Важной особенностью чанового выщелачивания металлов является то, что при сочетании его с другими методами переработки обеспечиваются гораздо большие скорости, нежели при подземном и кучном. Скорость процесса в основном и определяет технологию выщелачивания и ее экономичность.
В настоящее время исследованиями процесса бактериального окисления и выщзелачивания занимается около 100 научных организаций и фирм в 25 странах. Построены и действуют около 15 промышленных установок бактериального выщелачивания в 8 странах (ЮАР, Австралия, Бразилия, США, Канада, Замбия, Гана, Россия ), большое количество опытно-промышленных установок в целом ряде стран.
Рисунок 2
Рисунок 3
Рисунок 4
Снаружи клетка окружена слизистой капсулой, состоящей из полисахаридов, прочной клеточной стенкой, в которой содержится от 5 до 50% сухих веществ. Стенка, состоящая из гликопептидов (5 - 10%) является механическим барьером между внешней средой и протопластом (цитоплазматической мембраной и цитоплазмой). Она защищает клетку от окружающей среды и дает возможность существовать в гипотонических растворах. Внутри клетки имеется цитоплазма, которая окружена внутренней цитоплазматической мембраной, представляющей собой белково-липидный комплекс и выполняющей важнейшую роль в жизни бактерий. Во-первых, эта мембрана регулирует проницаемость клетки, т.е. пропускает воду, необходимые ионы и субстраты, во-вторых, непосредственно участвует в энергетическом обмене - в ней находятся система переноса электронов, в-третьих, через мембрану наружу выделяются продукты жизнедеятельности бактерий.
В процессах клеточного метаболизма принимают участие и лизосомы-внутрицитоплазматические клеточные образования. В цитоплазме содержатся также рибосомы и карбоксисомы, являющиеся центрами синтеза белков, различные белки и нуклеоид-носитель генетической информации клетки. В клетках содержатся плазмиды-кольцевые внехромосомные молекулы ДНК без белковой оболочки. Плазмиды выполняют ряд жизненноважных функций, в том числе они ответственны за устойчивость клеток к тяжелым металлам, т.е., вероятно, с ними связаны адаптационные свойства бактерий.
Постоянным спутником бактерий А.ferrooxidans микроорганизмы Aciditiobacillus thiooxidans, открытые в 1922 году Ваксманом и Иоффе. Эти бактерии являются наиболее ацидофильны, они могут развиваться даже при рН 0,3. Источником энергии для них являются соединения серы S2032-, S4062-, S0. Встречаются бактерии повсеместно в сульфидных и серных месторождениях. Условия их жизнедеятельности аналогичны бактериям А.ferrooxidans. Поэтому они постоянно присутствуют вместе.
Для бактерий А. acidophilus ( organoparus) источником энергии является элементная сера, которую они окисляют при рН 3.0 и температуре 25-300С. Азот они потребляют из NH4+ и мочевины. В конструктивном метаболизме источником углерода для них помимо углекислоты являются глюкоза, галактоза, фруктоза, ксилоза, ритоза.
ТН. А cidithiobacillus подобные принимают участие в окислении Fe2+, S0, MeS начиная с температуры более 400С. Оптимальной температурой для них является 500С. Выделяются они в местах разогрева сульфидных руд, в горячих источниках при температуре до 430С и рН 2,7, в термах при температуре до 640С и рН 4,3. Для этих бактерий источником углерода могут быть дрожжевой экстракт, глутатион, цистеин, цистин.
Бактерии рода Leptospirillum широко распространены в месторождениях сульфидных руд вместе с A.ferrooxidans. Эти вибрионы, спирали и шаровидные бактерии окисляют только Fe2+ и пирит при температуре 300С.
Микроорганизмы рода Sulfobacillus, Sulfolobus ( Аcidocadarius , Acidianus, S.thermosulfidooxidans,S.acidophilus, Acidomicrobium ferrooxidans относятся к термофильным микроорганизмам, которые окисляют элементную серу, железо и сульфидные минералы при температуре от 55 до 900С.
Сульфатредуцирующие бактерии восстанавливают сульфаты до сероводорода в анаэробных условиях. Они широко распространены в почвах, водах, геотермальных областях, нефтяных месторождениях. Их рост сопровождается образованием сероводорода, который осаждает металлы и подавляет окислительные процессы в отвалах и рудных телах. Очень важная роль этих бактерий в осаждении металлов в отстойниках и прудах, что позволяет использовать их для очистки сточных вод от металлов.
Сульфатредуцирующие бактерии могут использовать в качестве доноров электронов органические вещества и молекулярный водород. Акцепторами являются сульфат и некоторые окисленные соединения серы ( SO32-, S2O32-, S0), которые восстанавливаются до сульфида.
Основные представители сульфатредуцирующих бактерий относятся к родам Desulfvibrio, Desulfomonas, Desulfobulbus, Desulfobacter, Desulfococcus, Desulfobacterium и др.
При неполном окислении органических веществ ( лактат, малат, фумарат, этанол, бутанол, изобутанол, пропан) и H2 c участием сульфатредуцирующих бактерий образуется ацетат
2CH3CHOHCOO- + SO42-→ 2CH3COO- + 2HCO3- + H2S (1)
При полном окислении органических соединений образуется углекислота и HS-
СНСOO- + S042- → 2HCO3- + HS- (2)
Эта способность бактерий может использоваться при замене сернистого натрия для сульфидизации и флотации окисленных минералов.
 Микробиологическое выщелачивание марганца связано с восстановлением его до двухвалентного состояния, которое может происходить при участии бактерий различных таксономических групп, выделенных из пресных вод и осадков и из океанских и морских осадков. К бактериям, участвующих в выщелачивании марганца относятся прежде всего Bacillus subtilis, Bacillus macerans, Pseudomonas fluorescens, Bacillus spp. и др. Восстановление марганца может происходить как ферментативным путем так и при помощи различных метаболитов (органических кислот, перекисей) с использованием глюкозы в качестве донора электронов. При неферментативном восстановлении активными восстановителями марганца являются муравьиная и щавелевая, лимонная кислоты, выделяемые бактериями и грибами.
Микробиологическое выщелачивание марганца связано с восстановлением его до двухвалентного состояния, которое может происходить при участии бактерий различных таксономических групп, выделенных из пресных вод и осадков и из океанских и морских осадков. К бактериям, участвующих в выщелачивании марганца относятся прежде всего Bacillus subtilis, Bacillus macerans, Pseudomonas fluorescens, Bacillus spp. и др. Восстановление марганца может происходить как ферментативным путем так и при помощи различных метаболитов (органических кислот, перекисей) с использованием глюкозы в качестве донора электронов. При неферментативном восстановлении активными восстановителями марганца являются муравьиная и щавелевая, лимонная кислоты, выделяемые бактериями и грибами.
Например,
MnO2 + HCOOH + 2H+ → Mn2+ + 2H20 + CO2 (3)
Бактериальное окисление марганца может происходить также по прямому и ферментативному механизму. Так бактерии Metallogenium участвуют в ферментативном окислении марганца, которое катализируется оксидазами с передачей электронов на кислород посредством цитохромов
Mn2+ + 0,5 O2 + H2O ↔ MnO2 + 2H+ (4)
Окисление марганца может катализироваться каталазой в реакции с перекисью
Mn2+ + H2O2ְ↔ MnO2 + 2H+ (5)
Или с помощью марганцевой оксидазы, которая тоже передает электроны на кислород посредством цитохромов
Mn∙ MnO3 + 0,5 O2 + 2 H20 ↔ 2H2 ∙ Mn03 (6)
Этот механизм обнаружен у Leptotrix diskophora.
При неферментативном окислении образованные некоторыми микроорганизмами метаболиты, окисляю марганец, который затем осаждается на поверхности таких клеток как Megaterium, Siderocopsa и др.
В группу железобактерий, способных окислять железо входят многочисленные гетеротрофы, фототрофы, микроводоросли и др, которые способны образовывать осадки железа. Это прежде всего одноклеточные – Siderocopsa, Metallogenium, Galionella, нитчатые формы железобактерий – Spirothrix, Leptothrix
Бактерии покрываются чехлами из гидроксидов железа при рН 5-7,5 и температуре от 4 до 180С. При диаметре наружного чехла 2-3 мкм и внутреннего 1 мкм бактерии как бы линяют и покрываются новым чехлом.
Среди бактерий, способных окислять As3+, выделяется автотрофная культура Pseudomonas arsenitoxidans, выделенная из золотомышьяковых месторождений. Окисление мышьяка осуществляется при рН 6 по схеме
NaAsO2 + H2O ↔ NaAsO3 + 2H+ + 2e (7) 
При очистке промышленных сточных вод от мышьяка могут применяться аэробные гетеротрофные бактерии Pseudomonas putida и Alcaligenes eutrophus.
Микробиологический способ очистки промышленных сточных вод от хрома основан на том, что бактерии Pseudomonas dechromaticans используют хроматы и бихроматы в качестве акцепторов электронов при росте на органических средах в анаэробных условиях. При рН 7,7-8,3 и температуре 20-250С катион Cr6+ восстанавливается до Cr3+, который осаждается в виде Cr(OH)3.
Из сточных вод хромитовых месторождений и заводских сточных вод выделены также гетеротрофные микроорганизмы Pseudomonas chromatophila и Aeromonas dechromatica, способные принимать участие в восстановлении хрома.
Способность растворять золото обнаружено у различных микроорганизмов и их метаболитов. Наиболее ярко это проявляется у представителей родов Bacillus, Pseudomonas , выделяющих аминокислоты. Эти аминокислоты и белки при рН 9-10 образуют через аминогруппу связь Au – N , что приводит к образованию комплексов в основном анионных. Растворение золота аминокислотами происходит в присутствии таких окислителей, как перекись
Auo 

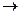
 Au – N (8)
Au – N (8)
В кислой среде аминокислоты восстанавливают золото до металла, в результате чего образуется «новое» золото.
Аккумуляция и осаждение золота осуществляется при участии многих бактерий, мицелиальных грибов и микроформы бактерий. Так, при осаждении золота грибковой массой Aspergillus niger, высушенной при температуре 2000С, при ее концентрации 40 г/л золото осаждается на 100% за 4 суток. По сорбционной способности , например, плесневые грибы не уступают активированным углям, а по способности поглощать коллоидное золото превосходят угли в 10-12 раз и не уступают ионообменным смолам.
В разложении некоторых силикатных и алюмосиликатных минералов принимает участие большое количество различных групп микроорганизмов, среди которых автотрофные ( Thiobacillus sp., A. thioparus и др), гетеротрофные ( Aspergillus niger, Bacillus megaterium, Bacillus musilaginosus), популяции почвенных микроорганизмов, симбиотические культуры – лишайники и др.
Bacillus musilaginosus, выделенные из почв Александровым являются аэробами, хорошо развиваются на синтетических средах с углеводами и соединениями азота, а также на картофельном агаре. В качестве единственного источника углерода и энергии используют крахмал, глюкозу, сахарозу, фруктозу, лактозу и др. При рН 7,5-9 и оптимальной температуре 37-400С они принимают участие в разложении силикатов с выделением кремния. Показано, что эти бактерии могут применяться при обескремнивании высококремнистых бокситов.
Способностью аккумулировать металлы из растворов обладают многие виды микроорганизмов, что используется в процессе биосорбции металлов. Биомасса этих микроорганизмов обладает высокой сорбционной емкостью.
Автотрофные микроорганизмы, водоросли и гетеротрофы способны сорбировать кадмий, кобальт, медь, никель, серебро, золото, молибден, диоксид урана.
Актиномицеты активно сорбируют торий и диоксид урана, а дрожжи – кадмий, кобальт, медь, никель и цинк. Мицелиальные грибы могут применяться при сорбции кобальта, радия, тория, марганца, ртути, свинца, цинка, диоксида урана и др соединений из промышленных сточных вод, при осаждении металлов из растворов и сточных вод и т.п.
Рисунок 6.
Одним из основных параметров при бактериальном выщелачивании является температура среды, т.к. от нее зависит протекание биологических процессов, в которых температура влияет на скорость ферментативных процессов, стабильность фермента, скорость распада фермент-субстратного комплекса, на сродство фермента к субстрату, на сродство фермента к активаторам и ингибиторам, на изменение концентрации растворенного кислорода и углекислого газа. При изменении температуры изменяется растворимость ферментов, происходит модификация клеточных структур, инактивация ферментов, изменяется состав липидов и т.п.
Известно, что оптимальной для жизнедеятельности мезофильных бактерий А. ferrooxidans является температура 28-350С. При 400С прекращается их рост, а при 500 в результате денатурации белка происходит дезактивация ферментов и мезофильные бактерии погибают. При низких температурах скорость роста бактерий замедляется ввиду того, что клетка становится неспособной синтезировать более высоконасыщенные жирные кислоты, входящие в состав липидов. При этом естественно снижается их окислительная активность.
Наибольшая скорость выщелачивания мышьяка из арсенопирита наблюдается при температуре 350С, когда его извлечение в 1,3 и 4,3 раза больше, чем при температуре 30 и 200С. Наблюдаемая во всех случаях колоколообразная форма кривой зависимости активности микроорганизма от температуры, характерна для ферментативного механизма окисления, т.к. одной из специфичных особенностей действия ферментов катализаторов является их строгая термолабильность. Температурный коэффициент Q10 при окислении железа составляет 2,0, а при выщелачивании сульфидных минералов 2-3.
Практика бактериального выщелачивания золотомышьяковых концентратов показала, что наиболее интенсивно процесс идет при температуре 400С , когда помимо мезофильных бактерий А.ferrooxidans, А.thiooxidans и Leptospirillum ferrooxidans присутствуют умеренные термофилы, которые принимают участие в окислении сульфидов при температуре 40-450С.
При аэробном метаболизме тионовых микроорганизмов А.ferrooxidans кислород выполняет роль акцептора электронов при участии ферментов - оксидаз. Помимо кислорода эти бактерии, являющиеся строгими автотрофами, ассимилируют углерод из СО2, который они потребляют из окружающей их среды. Поэтому при бактериальном выщелачивании с участием А.ferrooxidans газовый состав среды, т.е. количество находящегося в ней кислорода и углекислого газа, является одним из основных параметров, определяющих рост, активность бактерий и скорость биологического окисления. Количество О2 и СО2, находящихся в среде при обычных условиях (8,1 мг/л и 0,03%) явно недостаточно для поддержания активной жизнедеятельности микроорганизмов. Даже при окислении закисного железа объем потребляемого кислорода и углекислого газа превышает примерно в 180 и 80 раз максимальные количества их, растворенных в среде. Поэтому большое внимание при организации процесса бактериального выщелачивания должно уделяться аэрации пульпы, которая при чановом методе может осуществляться при механическом перемешивании, засасыванием воздуха из атмосферы и принудительной подачей его под давлением. Например, аэрация в чанах позволяет увеличить скорость окисления железа в 7 раз. Для окисления одного килограмма закисного железа бактериями необходимо 0,14 кг кислорода. Один килограмм элементной серы бактерии окисляют до сульфат- ионов, потребляя 2 кг кислорода. Такое количество кислорода в пульпе может обеспечить только принудительная аэрация.
Однако до сих пор опытным путем не установлена необходимая степень аэрации при чановом методе. Имеющиеся в литературе данные по этому важному вопросу крайне противоречивы. В одном случае показано, что при бактериальном окислении закисного железа необходимо продувание одного объема воздуха на один объем среды в час, в другом - три объема на объем в час. И в то же время из микробиологии известно, что при слишком интенсивной аэрации рост аэробных микроорганизмов может подавляться, особенно если они находятся в солевой питательной среде при концентрации клеток более 107 кл/мл. Поэтому микробиологи рекомендуют начинать аэрацию таких бактериальных сред не ранее, чем через 1-1,5 часа, когда бактерии входят в экспоненциальную фазу.
Проведенные исследования по влиянию воздуха на бактериальное окисление железа показали, что активность бактерий не подавляется даже при такой степени аэрации как 300 объемов воздуха на один объем среды в час при его высокой степени диспергации. В промышленных условиях считалось, что расход воздуха должен быть не менее одного объема на один объем пульпы в минуту. Такой расход воздуха значительно повышает затраты на процесс выщелачивания. Поэтому считается, что остаточная концентрация кислорода в пульпе не должна быть менее 2 мг/л.
В условиях бактериального выщелачивания сульфидсодержащих продуктов, когда растворимость кислорода в пульпе по сравнению со средой 9К уменьшается из-за высокой концентрации различных соединений, как органических, так и неорганических, и большого количества в пульпе твердых частиц- сульфидов, диффузия кислорода в жидкую фазу становится фактором, лимитирующим процесс выщелачивания. При выщелачивании одного из золотомышьяковых концентратов на каждый объем пульпы поглощается кислорода в 3-4 раза больше, чем его содержание в том же объеме бактериального раствора. А при выщелачивании в пачуках с количеством биомассы в жидкой фазе пульпы 108-109кл/мл расход воздуха составляет не менее 1-2 объемов на один объем пульпы в минуту. При таком расходе концентрация кислорода не снижается ниже 4 г/л. При бактериальном выщелачивании золотомышьякового концентрата Олимпиадинского месторождения расход воздуха составил 0,6 м3 на 1 м3 пульпы в минуту, а на некоторых зарубежных установках он равен 0,25-0,30 м3 на 1 м3 пульпы. При выщелачивании медно-цинковых продуктов остаточная концентрация кислорода определена не менее 1,6 мг/л.
Для повышения активности микроорганизмов и интенсификации окислительных процессов необходимо в воздушной смеси, подаваемой на аэрацию поддерживать концентрацию СО2 в пределах 0,1-0,15%. При этом активность микроорганизмов возрастает на 35%.
С целью активации аэрирующего воздуха при подаче его в выщелачиваемую пульпу и повышении количества кислорода в ней возможна дополнительная подача активного окислителя - озона, при распаде которого образуются атомарный и молекулярный кислород. При подаче озоно-воздушной смеси, содержащей всего 0,01-0,02% озона, скорость бактериального окисления железа увеличивается в 20-60 раз. Значительно увеличивается скорость выщелачивания сульфидов.
Биологические параметры.
Для нормального роста и развития бактерий требуется наличие в среде минеральных солей (биогенов), и в первую очередь соединений азота и фосфора, которые используются бактериями в энергетическом метаболизме. При бактериальном выщелачивании с использованием культуры А.ferrooxidans обычно используется среда Сильвермана и Лундгрена, называемая среда 9К, в состав которой входят, г/л:
(NH4)2SO4 - 3,0 г;
KCl - 0,1 г ;
K2PO4 - 0,5 г;
MgSO4. 7H2O - 0,5 г
Ca(NO3)2 - 0,01 г
FeSO4 . 7H2O - 44,2 г.
Иногда вместо FeSO4· 7H2O используют соль Мора FeSO4·(NH4)2SO4·6H2O (63г/л) в этом случае (NH4)2SO4 в среду не добавляется. При таком составе содержание Fe2+ в среде составляет около 9 г/л. Иногда используют среду 9К/2, в которой содержание Fe2+ уменьшается в 2 раза, или 9К/4, в которой количество Fe2+ уменьшается в 4 раза. При бактериальном выщелачивании сульфидсодержащих концентратов железо не подается, а вместо солей азота и фосфора применяются удобрения типа аммофос (0,5 г/л). Если же в концентратах содержится фосфор, например в виде апатита, то соли фосфора можно в среду не подавать.
Одним из самых важных условий протекания бактериальных окислительных процессов является использование активной культуры клеток. Активность различных штаммов бактерий, выделенных из рудничных вод, имеющихся в лабораториях и музеях, неодинакова при окислении неорганических субстратов- серы, железа, сульфидных минералов. Так, культура бактерий, выделенная непосредственно из рудничных вод месторождения и выросшая в них при определенных условиях среды обитания (рН, тип сульфидов, солевой состав вод, температурный режим, наличие ингибирующих соединений), как правило, более активна при выщелачивании металлов из руды этого месторождения.
В технологии чанового бактериального выщелачивания в плотных пульпах применение высокоактивных штаммов, устойчивых к экстремальным условиям, является одним из параметров, определяющих скорость процесса и, естественно, его экономичность. Имеются штаммы культур, устойчивые к следующим концентрациям металлов в растворах, г/л: мышьяка 6-10, железа 15-20, урана 12, меди 50, цинка 40-50, алюминия 20, никеля 72, хлор-иона 10, молибдена 0,2, серебра 0,01 и кадмия 0,82.
Известно, что некоторые металлы при низких концентрациях стимулируют рост многих микроорганизмов, но при повышении концентрации их сначала наступает ингибирование, а затем полное подавление активности и роста клеток. Объясняется это тем, что металлы могут связывать свободные SH-группы, подавляя ферменты, содержащие эти группы. Кроме того, некоторые металлы могут входить в активную часть ферментов (как медь и железо в цитохромы), другие являются активаторами ферментов. Однако при больших концентрациях металлы могут связываться с молекулами самого фермента и инактивировать его.
Все это свидетельствует о возможности получения культуры, обладающей свойствами, необходимыми для ее промышленного использования путем адаптации к повышенным концентрациям выщелачиваемых элементов. Такой штамм “производственной” культуры должен иметь высокую активность, хорошую кинетическую характеристику и устойчивость к высоким концентрациям элементов, переходящих в жидкую фазу при выщелачивании.
Наиболее токсичным для бактерий А.ferrooxidans является трехвалентный мышьяк- сильный ингибитор железоокисляющей способности бактерий. Продолжительность лаг-фазы развития бактерий увеличивается при концентрации мышьяка 2 г/л до 48 часов и при концентрации 4 г/л до 120 часов. Адаптация лабораторных штаммов к мышьяку обычно производится путем последовательного пересева на среду с увеличением концентрации мышьяка. Адаптация и получение производственной культуры проводится в периодическом режиме на среде 9К при Т : Ж = 1:4, в присутствии Fe2+ (10 г/л) или без него. Количество посевного материала обычно составляет 10-15%.
Адаптация микроорганизмов является чрезвычайно чувствительной и специфичной. Например, бактерии, адаптированные к арсенопириту, не окисляют остальные сульфидные минералы. Скорость окисления этими бактериями халькопирита ниже в 13 раз, а пирита в 38 раз.
Очень важное технологическое значение имеет тот факт, что приобретенные адаптивные свойства бактерий, т.е. их повышенная устойчивость к ингибирующим ионам происходит только за счет мутагенных изменений при реализации возможностей их организмов при изменении среды обитания, но без изменения их генотипа. Поэтому адаптивные свойства утрачиваются бактериями при изменении условий среды и для поддержания культуры в активном состоянии необходимо применение режима хемостатного культивирования в условиях выщелачивания продукта, т.е. культура должна находиться постоянно в тех условиях, к которым она была адаптирована.
Процесс адаптации довольно длительный. В промышленных условиях он обычно совмещается с заполнением емкостей выщелачиваемой пульпы при Т:Ж = 1-4 ¸ 1:5 в присутствии Fe2+, питательных солей, температуре 32-350С, при высокой степени аэрации. Активность культуры по мере ее адаптации контролируется степенью окисления Fe2+ , повышением концентрации общего железа, изменением величины рН и ОВП, и обязательно скоростью подачи пульпы. Последнее тесным образом связано со скоростью роста бактерий и концентрацией биомассы.
Использование метода хемостатного культивирования, когда в среду с постоянной скоростью подается свежая среда с субстратом ( Fe2+, сульфиды, концентрат), объем которой поддерживается на постоянном уровне путем равномерного удаления части среды с культурой (рисунок 7).
Cхема хемостатной культуры
Х – концентрация биомассы,
S – концентрация субстрата,
F – скорость подачи раствора
Рисунок 7.
Хемостат является саморегулирующейся системой с идеальным перемешиванием, обладает высокой технологичностью, на его принципе осуществляется аппаратурное оформление биотехнологических процессов.
В хемостате в установившемся режиме удельная скорость роста бактерий не должна быть меньше скорости разбавления, которая определяется как
D = F/ V, где (9)
D-скорость разбавления, ч -1;
F-величина потока среды или пульпы, л/ч;
V-объем выщелачивающего аппарата, л.
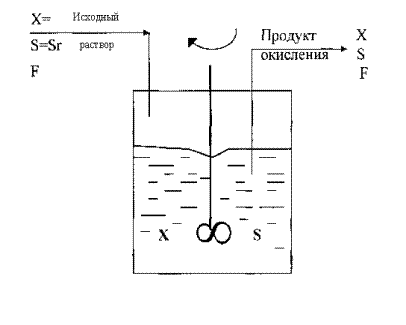
Так, концентрация клеток при окислении закисного железа увеличивается с 103-104 до 108 кл/мл при увеличении D с 0 до 0,04 ч -1 и остается постоянной до D равной 0,08 ч -1. При дальнейшем увеличении скорости разбавления ( выше 0,08- 0,09 ч -1) концентрация клеток уменьшается за счет их вымывания. При этом достигается скорость окисления железа 0,6 г/л×ч. Максимальная удельная скорость роста биомассы mm в этих условиях достигает 0, 15 ч -1. Получение более высоких скоростей окисления железа, значительно превышающих 0,6 г/л×ч, в условиях одностадиального хемостатного культивирования практически невозможно.
При бактериальном выщелачивании золотомышьяковых концентратов Dкрит составило 0,053-0,063. При превышении этих значений происходило вымывание клеток, снижение их количества в жидкой фазе, повышение значения рН, снижение ОВП среды, накопление закисного железа и повышение содержания мышьяка в кеках выщелачивания.
Многочисленные исследования кинетики бактериальных процессов окисления и выщелачивания позволили сделать вывод о том, что скорость окислительных процессов, катализируемых ферментами, прямо пропорциональна концентрации биомассы в определенных пределах. Для окисления закисного железа этот предел составляет 0,05-2,5 г/л биомассы по сырому весу. Поэтому одним из путей интенсификации процессов бактериального окисления и выщелачивания является применение концентрированной биомассы. Это, во-первых, значительно ускоряет процесс, уменьшая общую продолжительность его, снижает эффект ингибирующего действия ионов, перешедших в раствор при выщелачивании, что особенно важно при выщелачивании сложных по составу продуктов. Для получения плотной популяции культуры используются методы центрифугирования, сепарирования, электрохимического, хемостатного культивирования, иммобилизации и применения оборотных растворов.
Известно, что во всех применяемых способах бактериального выщелачивания биомасса, активная и адаптированная, безвозвратно теряется либо с продуктивными растворами при подземном и кучном выщелачивании, либо с пульпой при чановом.
Использование возвращаемой биомассы дает возможность значительно повысить концентрацию активных клеток в пульпе, окислительную активность бактериальных растворов и производительность установок.
Метод электрохимического культивирования является наиболее производительным из всех известных методов, однако выращивание адаптированной культуры в электрохимическом культиваторе в течение 72-96 часов не изменяет адаптивные свойства культуры. Поэтому такая культура может применяться в технологии чанового бактериального выщелачивания вместо адаптированной на начальном этапе процесса, значительно сокращая время ввода его в оптимальный режим. В дальнейшем концентрирование биомассы лучше осуществлять при использовании оборотных растворов или биомассы, выделенной из этих растворов сепарированием или центрифугированием. При выщелачивании золотомышьяковых концентратов скорость выщелачивания арсенопирита напрямую зависит от концентрации биомассы. Если при плотности биомассы 0,025 г/л по сухому весу выщелачивается 0,5 г/л мышьяка за 30 часов, то при плотности 2,5 г/л в раствор перешло мышьяка в 9 раз больше . Оптимальное соотношение концентрации биомассы, концентрации закисного железа и количества твердого в исходной пульпе при выщелачивании золотомышьяковых концентратов как 1:4:100. При таком соотношении за 65 часов выщелачивания содержание сульфидного мышьяка снижается в 3,5 раза, что достигается в присутствии неконцентрированной культуры за 120 часов, т.е. почти в 2 раза медленнее.
Для определения биомассы в технологических процессах выщелачивания применяется экспрессный метод, основанный на центрифугировании, по которому количество клеток пересчитывается по формуле:
x= m × 3,8 × 109 (10)
где х - количество клеток в мл;
m - масса бактерий, г/л по сырому весу.
Применяемые методы концентрирования клеток позволяют повысить их концентрацию до 3-5 г/л и более или 1010- 1011кл/мл.
При бактериальном окислении закисного железа использование иммобилизованной биомассы на твердом носителе позволяет в 2-3 раза уменьшить время окисления.
Технологические параметры
Среди параметров, определяющих эффективность бактериального выщелачивания чановым методом, особое значение приобретают такие специфичные для этого процесса параметры, как плотность выщелачиваемой пульпы, крупность и способ подготовки продукта к выщелачиванию, способ перемешивания и аэрации, схема выщелачивания, методы переработки оборотных растворов, требования к продуктам выщелачивания и т.п. Эти параметры определяют прежде всего технологическую схему, режим процесса и его аппаратурное оформление.
При выщелачивании концентратов и продуктов, имеющих не только сложный вещественный состав, но и различный характер и крупность вкрапленности выщелачиваемых минералов, гранулометрический состав этих продуктов является одним из основных параметров, определяющих кинетику и полноту выщелачивания.
Чановому выщелачиванию, как правило, подвергаются продукты гравитационного и флотационного обогащения, имеющие различную крупность. Гравитационные золотосодержащие концентраты крупностью 1-2 мм перед бактериальным выщелачиванием доизмельчаются до крупности 80-90% класса -0,074 м, т.е. до крупности флотационных концентратов. При этом необходимо определить для каждого конкретного продукта полноту раскрытия минералов и доступность их для действия бактериальных выщелачивающих растворов.
С уменьшением крупности исходного продукта увеличивается скорость выщелачивания и активность микроорганизмов. Увеличение активности бактерий с уменьшением крупности выщелачиваемого продукта безусловно связано с тем, что при тонком измельчении значительно увеличивается поверхность минерального субстрата - сульфидных минералов, являющихся энергетическим источником для микроорганизмов.
Для золотомышьяковых концентратов различного минерального состава крупность перед выщелачиванием должна быть не менее 90-95% класса -0,074 мм (около 80-85%- 0,044 мм), в некоторых случаях , например, при очень тонкой вкрапленности арсенопирита, она должна быть доведена до крупности 90-98% - 0,044 мм.
Так, наиболее высокие показатели извлечения золота достигнуты при крупности выщелачиваемого концентрата 88% класса - 0,044 мм. Для концентратов Майского месторождения крупность составляла в среднем 90-95% - 0,075 мм (86% - 0,044 мм). При такой крупности концентратов значительно повышается скорость выщелачивания арсенопирита, увеличивается извлечение в раствор мышьяка и повышается извлечение золота цианированием.
Характерным является изменение гранулометрического состава выщелачиваемых концентратов. Так, если в исходном концентрате материала крупностью -0,044 мм содержится 57%, то уже после первой стадии выщелачивания выход материала этой крупности достигает 84%, а количество материала крупностью менее 20 мкм увеличивается в два раза.
Изменение гранулометрического состава продуктов выщелачивания со временем может в значительной степени определить время, необходимое для оптимального вскрытия тонковкрапленного золота, а также всю технологическую схему выщелачивания. Как правило, основное количество сульфидов окисляется в первые 24-48 часов, степень окисления их при этом составляет 60-70%. Поэтому целесообразно выделение из выщелачиваемой пульпы уже разрушенных сульфидных минералов, имеющих крупность -0,044 мм, которые направляются на цианирование. Выход материала такой крупности составляет обычно 40-60% от исходного, а извлечение из него золота достигает 90 и более процентов. Так при бактериальном выщелачивании концентратов Майского месторождения при степени окисления сульфидов 67% извлечение золота достигает 96%.
При бактериальном выщелачивании концентрата Кок- Патасского месторождения из материала крупностью -0,044 мм после первой стадии выщелачивания золото цианируется на 90-92%, в то время как из песковой части его извлечение не превышает 81%. Вывод из пульпы уже выщелоченного материала позволил снизить общее время выщелачивания в 2 раза, т.е. на 42 часа.
Плотность выщелачиваемой пульпы также имеет особое значение в технологии чанового выщелачивания, т.к. она определяет производительность процесса по твердому и в конечном итоге основные технико-экономические показатели процесса.
В статических условиях высокие показатели по извлечению металлов достигаются только в сильно разбавленных пульпах ( Т:Ж = 1:50 ). Так при выщелачивании золотомышьякового концентрата Кок-Патасского месторождения, содержащего 10% мышьяка оптимальное соотношением Т:Ж в периодическом режиме составило от 1:30 до 1:50, при котором извлечение мышьяка в растворе достигало 88% за 100 часов. При увеличении плотности пульпы до Т:Ж =1:10 извлечение мышьяка составляло всего 30%, а количество клеток снижается с 106 до 102 в мл. Значительно снижается и их активность. Одной из причин подавления бактериальной активности клеток является накопление в выщелачивающих растворах продуктов окисления арсенопирита и прежде всего мышьяка. Если при Т:Ж = 1:50 содержание его в растворе составляет 1,15 г/л, то при Т:Ж = 1:10 его концентрация повышается до 2,5 г/л.
Создание оптимальных условий для жизнедеятельности микроорганизмов в плотной пульпе возможно только при постоянной смене раствора, т.е. при проточной технологии в непрерывном режиме выщелачивания. Промышленная практика эксплуатации установок чанового выщелачивания показала, что высокая активность бактерий и высокая скорость выщелачивания наблюдается при оптимальном соотношении Т:Ж = 1:4¸1:5. При такой плотности пульпы концентрация мышьяка в жидкой фазе составляет от 3 до 8 г/л в зависимости от его содержания в исходном продукте и оборотных растворах. При концентрации мышьяка более 8 г/л активность бактерий снижается с 2-2,5 г/л×ч до 0,6 г/л×ч при высокой плотности биомассы (2×1010 кл/мл). При этом, однако, в жидкой фазе наблюдается повышение до 40 г/л содержания Fe (III), которое также подавляет активность бактерий.
Отсюда следует очень важный технологический вывод: при выщелачивании золотомышьяковых концентратов с высоким содержанием мышьяка ( более 8-10 %) для поддержания высокой активности биомассы необходимо выделение из жидкой фазы растворенных форм мышьяка и железа (III) - ингибиторов жизнедеятельности клеток. Для концентратов, содержащих 2-3% мышьяка плотность выщелачиваемой пульпы может быть повышена до Т:Ж = 1:3.
При выщелачивании в плотных пульпах большое значение приобретает режим перемешивания и аэрации, создающий благоприятные условия для насыщения пульпы кислородом и углекислым газом. А режим перемешивания и аэрации в свою очередь зависит от типа аппарата, применяемого при выщелачивании. Помимо необходимости оптимального перемешивания и аэрации, выщелачивающие аппараты должны обеспечивать пропускную способность цикла выщелачивания с заданным временем выщелачивания, потребность в кислороде и углекислом газе, создание температурного режима.
Первые укрупненные исследования процесса бактериального выщелачивания в непрерывных условиях проводились в пневматических аппаратах типа “пачук”. При этих исследованиях была показана недостаточная эффективность перемешивания плотной пульпы и недостаточная степень аэрации, когда остаточная концентрация кислорода не превышала 1 мг/л. Поэтому в настоящее время основным типом выщелачивающих аппаратов на всех промышленных установках приняты реакторы (чаны) с механическим перемешиванием и принудительной подачей воздуха. Наилучшими конструкционными материалами для этих чанов являются нержавеющая сталь или углеродистая сталь с резиновой футеровкой, не влияющей на активность клеток. Объем чанов определяется требуемой производительностью и временем выщелачивания.
На первой промышленной установке Файрвью (ЮАР) при производительности 55 т/сутки необходимое время выщелачивания (100 часов) обеспечивается в 10 реакторах с общим объемом 764 м3. На фабрике Сан-Бенто (Бразилия) для бактериального выщелачивания установлен один реактор объемом 580 м3, а на фабрике Ашанти (Гана) 25 реакторов объемом 896 м3 каждый. Общее количество реакторов, снабженных системами аэрации и теплообмена, на большинстве фабрик составляет не менее 5-6. Охлаждение пульпы в чанах обычно осуществляется змеевиками из нержавеющей стали.
Перемешивание пульпы в чанах осуществляется 6- лопастными турбинами, но в последнее время они заменяются импеллерами с осевым потоком. Турбины с радиальным потоком эффективно аэрируют пульпу, но имеют низкую перемешивающую способность и большое потребление энергии, в то время как импеллеры с осевым потоком обеспечивают хорошее перемешивание и потребляют меньше энергии, кроме того, при высоких скоростях вращения они не оказывают вредного влияния на биомассу. Производительность установки с импеллерами с осевым потоком почти в 2 раза выше, чем с турбинами.
В реакторах с импеллерами, снабженных противозавихрительными перегородками утилизация кислорода составляет в среднем 15% ( максимум 25%) при концентрации растворенного кислорода 2,5 мг/л. Эффективность кислородного обмена составила 0,55/КВт×ч.
На фабрике “Конгресс” (Канада) при производительности 113 т/сутки и количестве чанов 10 (225 м3 каждый) удельный расход электроэнергии на перемешивание и подачу воздуха составил 104 квт×ч на 1 тонну концентрата. Снижение энергозатрат на процесс бактериального выщелачивания может осуществляться за счет уменьшения расхода воздуха, степени аэрации и перемешивания, увеличение плотности выщелачиваемой пульпы.
Для переработки упорных золотомышьяковых концентратов разрабатываются новые конструкции биореакторов.
В институте “Иргиредмет” и на Балейской опытной фабрике для процесса бактериального выщелачивания исследовано применение пульсационных колонн с насадками жалюзийного типа с углом наклона лопаток 200. При расходе воздуха 1 м3/мин на 1м3 рабочей емкости колонны происходит снижение энергозатрат в 1,5-2 раза. Весь цикл бактериального выщелачивания вместо 6 пачуков может осуществляться в одной колонне, имеющей удельную производительность в 2-3 раза больше по сравнению с пачуками.
Проведение процесса бактериального выщелачивания во вращающихся барабанах позволит значительно повысить эффективность выщелачивания, увеличить плотность пульпы и скорость бактериального
Выщелачивания мышьяка
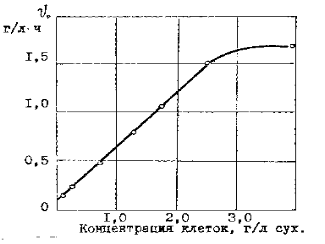
Рисунок 8
Таким образом, использование уравнений (21 ) и ( 24 ) для описания кинетических кривых возможно только до концентрации биомассы 2,5 г/л по сухому весу, поскольку в них входит величина
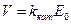 ( 27 )
( 27 )
где, 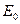 – концентрация «фермента» ( пропорциональна концентрации биомассы),
– концентрация «фермента» ( пропорциональна концентрации биомассы),
kкат – каталитическая константа
Применяя интегральный метод анализа с использованием уравнения ( 27) кинетики бактериального окисления сульфидных минералов в медно-цинковых и мышьяковистых концентратах было показано, что кинетика бактериальных окислительных процессов подчиняется уравнениям ферментативного катализа ( рисунок 9 и 10 ). Определенные кажущие величины констант Км = - 22 г/л и Vmax = -0,15 г/л ч имеют отрицательное значение,
Рисунок 9
что свидетельствует о наличии сильного конкурентного ингибирования ферментативной реакции продуктами выщелачивания (ионами железа, меди, цинка или мышьяка). В этом случае из одной кинетической кривой определить константы невозможно. Поэтому пользуются полными кинетическими кривыми для различных концентраций субстрата.
Рисунок 10
Явление конкурентного ингибирования в ферментативном катализе имеет место в случает закрепления ингибитора на активный цент фермента ( конкуренция за активный центр). При этом константа Михаэлиса увеличивается, а максимальная скорость реакции не изменяется. Конкурентное ингибирование продуктом реакции вызвано связыванием фермента продуктом или продуктами реакции Р в непродуктивный комплекс ЕР и может быть представлено в виде трехстадийной схемы
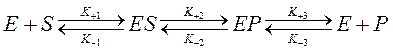 (28)
(28)
Дифференциальное уравнение скорости реакции по схеме ( 28 )можно представить в виде:
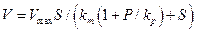 ( 29 )
( 29 )
Для необратимых реакций при бактериальном окислении сульфидов когда k-2→ 0, константа Михаэлиса km = k-1 k+3 + k+2 k+3 / ( k+1 k+2 + k+3 ), а константа ингибирования
kр + k+3/ k-3. Величина константы ингибирования характеризует сродство продукта к ферменту. Форма уравнения ( 29 ) аналогична ( 21 ) , поэтому по одной кинетической кривой нельзя определить замедление реакции по времени в результате накопления продукта окисления или истощением исходного субстрата.
Интегрируя (29 ), а затем линеаризуя, получим уравнение:
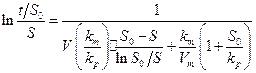 ( 30 )
( 30 )


которое выражается прямой линией в координатах 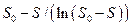 ,
, 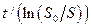
Действительно, при бактериальном окислении сульфидного мышьяка в мышьяксодержащем концентрате неадаптированной к мышьяку культурой А.ferrooxidans этот процесс хорошо описывается интегральным уравнением ферментативной кинетики с конкурентным ингибированием продуктом реакции ( 29 ). При этом на оси абсцисс отсекается отрезок, равный 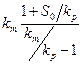 , а наклон прямых к оси абсцисс
, а наклон прямых к оси абсцисс
равен tgφ 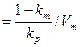
Отрицательное значение тангенса угла наклона характерно для случая km
Рисунок 11
> kp , т.е. сродство «фермента» к продукту окисления ( Fe3+, As3+, As5+ и другим ингибиторам) больше, чем к субстрату – арсенопириту. Увеличение тангенса угла наклона при постоянной концентрации фермента ( бактерий) характеризует снижение скорости окисления в результате уменьшения начальной концентрации сульфидного мышьяка ( кривая 1 рис. 24) или воздействием других факторов( например отсутствие в растворе дополнительного окислителя Fe3+ ( кривая 4 рисунок 11 ). Разница в величине отрезков на оси абсцисс зависит отначальной концентрации сульфидного мышьяка ( кривые 1,2,3 рисунок 11 ) в случае Е = const., т.е. при постоянной концентрации фермента.
При бактериальном выщелачивании сульфидного мышьяка при различной концентрации бактерий ( рисунок 11) в соответствии с уравнением ( 30) линейный характер зависимости скорости реакции окисления основного субстрата – арсенопирита от концентрации «фермента» сохраняется не только на участке начальных скоростей, но и в течении всего процесса. Тангенс угла наклона прямых к оси абсцисс на рисунке 12
Влияние концентрации биомассы на скорость бактериального выщелачивание мышьяка при S 0 = 17,4 г/л
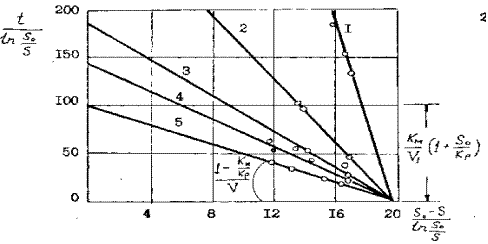
( 1 -0.25 г/л, 2 – 0,75 г/л, 3 – 1,25 г/л, ; - 1,75 г/л, 5 – 2,5 г/л )
Км = 3,6 г/л , V1 = 1,9 г/л ч, КР = 0,34 г/л, Ккат = 1,27 ч-1
Рисунок 12
обратно пропорционален концентрации бактерий. Величина отрезка, отсекаемого прямой на оси абсцисс равна 19,6. В этом случае в соответствии с ( 31 ) при начальной концентрации мышьяка 17,4 г/л соотношение km= 19,6 kp /2,2- Кр и имеет вид гиперболы, асимптотически приближающейся к прямой ( рисунок 13 ), при этом kр = 2,2, где 2,2 разница между абсциссами пересечения прямых м исходной концентрации субстрата , т.е.
19,6 – 17,4 = 2,2.
Соотношение Км и Кр в процессе бактериального выщелачивания
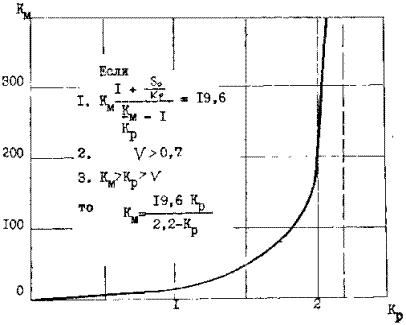
Рисунок 13
По одной кинетической кривой, как отмечалось ранее, при конкурентом ингибировании невозможно определить три кинетические величины kv, kp и Vmax, но они могут быть найдены при вышелачивании продуктов с различной исходной концентрацией мышьяка (So). Это можно осуществить при бактериальном выщелачивании мышьяка из золотомышьякового концентрата при различной плотности пульпы, т.е. при Т:Ж = 1:2,5 ; 1:5 и 1:10. Экспериментальные данные, обработанные по методу Корниш-Боуден показывают, что кинетические зависимости выражены параллельными прямыми с отрицательным тангенсом угла наклона к оси абсцисс ( рисунок 14 )
Исходного субстрата ( Т:Ж)
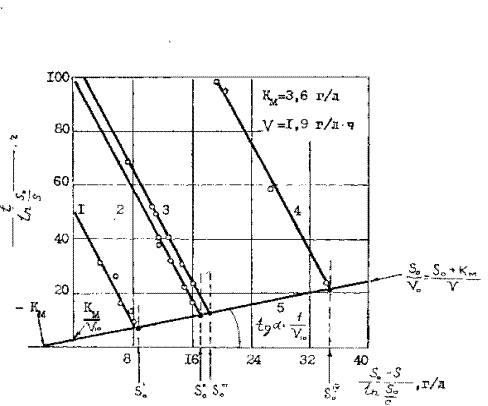
1 – S0 = 8,7 г/л ( Т:Ж = 1:10), 2 – S0 = 17,4 г/л (Т:Ж=1:5), 3 – S0 = 18,6 г/л (Т:Ж=1:5),4 - S0
4 – S0= 34,8 г/л, концентрация биомассы 2,5 г/л, начальная концентрация железа(II)-10 г/л
Рисунок 14
Путем экстраполяции ординаты  к значению
к значению 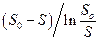 равному So, на каждой прямой получена точка с координатами So и So/V. Тогда при условии
равному So, на каждой прямой получена точка с координатами So и So/V. Тогда при условии 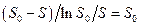 ( из уравнения ( 30 ) получается
( из уравнения ( 30 ) получается
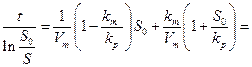
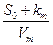 (31)
(31)
а из уравнения Михаэлиса-Ментен
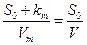 (32)
(32)
По прямой, соединяющей полученные точки с координатами  o;
o; 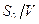 , определяются параметры
, определяются параметры  max и km. Тангенс угла наклона прямой к оси абсцисс равен 1/
max и km. Тангенс угла наклона прямой к оси абсцисс равен 1/  max, а отрезок, отсекаемый на этой оси равен – km. Константа Михаэлиса для бактериального выщелачивания мышьяка равна 3,6 г/л, при максимальной скорости выщелачивания 1, 9 г/л для растворов с концентрацией клеток 2,5 г/л и 0,19 г/л при концентрации клеток 0,25 г/л ( см. рисунок12 ).
max, а отрезок, отсекаемый на этой оси равен – km. Константа Михаэлиса для бактериального выщелачивания мышьяка равна 3,6 г/л, при максимальной скорости выщелачивания 1, 9 г/л для растворов с концентрацией клеток 2,5 г/л и 0,19 г/л при концентрации клеток 0,25 г/л ( см. рисунок12 ).
Из уравнения ( 28) определяется кинетическая константа бактериального выщелачивания сульфидного мышьяка с учетом того, что в единице сухой биомассы содержится 1/1,67 белка . Тогда за 1 час одна весовая часть белка биомассы А.ferrooxidans способна катализировать 1,3 частей арсенопирита. Каталитическая константа в этом случае определяется только на общее количество белка, а не на единицу веса фермента, т.к. фермент, участвующий в окислении не выделен, его вес и число активных центров неизвестны.
По уже известным величинам  max и km определяется константа ингибирования Kp, которая при бактериальном выщелачивания мышьяка из арсенопиритового концентрата культурой, неадаптированной к этому концентрату равна 0,34 г/л.
max и km определяется константа ингибирования Kp, которая при бактериальном выщелачивания мышьяка из арсенопиритового концентрата культурой, неадаптированной к этому концентрату равна 0,34 г/л.
Таким образом, сродство продуктов выщелачивания к ферменту (1/kp) при бактериальном выщелачивании сульфидного мышьяка, равное 2,94, в 10,8 раза больше сродства исходного субстрата ( арсенопирита), равного 0,27. Это означает , что основная часть фермента клеток связывается при выщелачивании в комплекс с мышьяком, как продуктом выщелачивания и в дальнейшем в каталитическом процессе не участвует. Этим можно объяснить ингибирование процесса выщелачивания при накоплении продуктов выщелачивания.
Таким образом, кинетика процессов бактериального окисления и выщелачивания подчиняется кинетическим закономерностям ферментативного катализа, где в качестве катализаторов выступают ферменты бактериальных клеток. Ингибирование бактериального выщелачивания, например, арсенопирита в мышьяксодержащих концентратах протекает по конкурентному механизму ингибирования. Снижение скорости выщелачивания, наблюдаемое при выщелачивании практически любых сульфидных минералов и концентратов происходит за счет связывания большей части активных ферментов в непродуктивный комплекс с продуктами метаболизма. В этих условиях наиболее эффективным методом интенсификации биогидрометаллургических процессов является поддержание активно растущей биомассы бактерий в пульпе, регуляции плотности пульпы, скорости ее протока и частичного вывода продуктов окисления сульфидов в оборотные растворы, из которых они удаляются во избежания ингибирования процесса.
Бактериями А. ferrooxidans
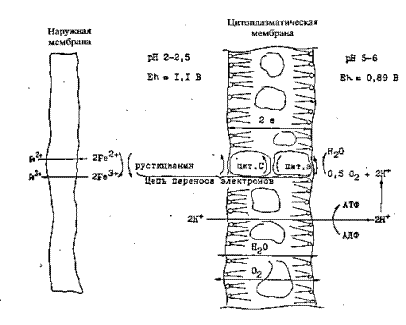
Рисунок 15
Далее электрон переносится по цитохромной цепи на кислород. Восстановление кислорода осуществляется уже на внутренней стороне цитоплазматической мембраны. Таким образом, реакция окисления железа (II) происходит на внешней стороне мембраны, причем Fe2+ , Н+ и О2 поступают из внешней фазы, а продукты окисления Fe3+ и Н2О возвращаются в нее. Причем Fe3+ возвращается в раствор в виде хелатных соединений с ферментами, часть его разрушается, а около 50% его постоянно присутствует в растворе в виде отрицательно заряженного комплекса.
При переносе электронов по цитохромной цепи от железа на кислород создается протонный потенциал и выделяется достаточное количество энергии для того, чтобы синтезировать 1 молекулу АТФ на два прошедших электрона. Для этого необходимо чтобы величина Еh была равна 0,33 В. На внутренней стороне мембраны, где происходит восстановление кислорода, потенциал пары 0,5 O2/H2O при рН 5-6 равен 0,89 В, в то время как на внешней стороне мембраны при рН 2 этот потенциал составляет 0,22 В. Эта разница образуется в основном за счет градиента рН и только 0,12 В поступает от дыхательной цепи клетки.
Таким образом, основная часть энергии при окислении Fe2+ бактериями генерируется при передаче ионов Н+ в результате хемиоосмотической АТФ-фазной реакции, протекание которой обеспечивается градиентом рН и мембранным или протонным потенциалом. Потребление протона на внутренней стороне цитоплазматической мембраны при окислении железа приводит к подщелачиванию среды внутри клетки до рН 5,5-6 по реакции
2Fe2+ + 0,5O2+2H+= 2Fe3+ +H2O (37)
Окисление железа (II) происходит на внешней стороне цитоплазматической мембраны, когда электроны посредством цитохромной системы проходят через мембрану и поступают в клетку, где кислород, принимая электроны, окисляется до воды, и получаемая при этом энергия идет для синтеза АТФ, используемой бактериями для фиксации углекислоты в процессе хемосинтеза и роста клеток.
Сера, как известно, входит в состав сульфидных минералов в виде S2-. При бактериальном окислении сульфидов окисление сульфидной серы до элементной происходит при электрохимической реакции окисления сульфидной поверхности и под действием бактерий, например:
FeS2 + Fe2(SO4)3 = 3FeSO4+2S (38)
при участии ферментов- сульфидооксидазы и полисульфидооксидазы . Окисление этой серы бактериями сопряжено также с генерацией АТФ.
Образующаяся элементная сера является единственным твердым продуктом окисления таких сульфидных минералов, как арсенопирит, пирит, пирротин, халькопирит и др. Элементная сера переходит в пульпу при выщелачивании в виде отдельных агрегатов, а также покрывает поверхность минералов. На этой сере происходит адгезия минеральных клеток, которые при таком непосредственном контакте осуществляют ее окисление до сульфат-ионов. Следует учитывать, что при бактериальном окислении таких хорошо окисляющихся минералов, как пирротин, образуется большое количество элементной серы, которая является хорошим субстратом для бактерий А. thiooxidans. Поэтому в жидкой фазе пульпы количество этих бактерий увеличивается до 109-1010 кл/мл.
Общая схема бактериального окисления сульфидной серы может быть представлена в виде:
S2- ® Sоb ® SO32-® SO42- (39)
Ромбическая элементная сера перед окислением ее ферментами должна быть в таком состоянии, при котором возможно ее растворение липидами и фосфолипидами микробного синтеза. Поэтому при бактериальном окислении сульфидной серы образуется элементная сера b-модификации, которая хорошо растворяется в таких органических растворителях как липиды и фосфолипиды. Сера b-модификации, растворенная компонентами мембраны клеток, транспортируется в периплазматическое пространство клетки, где окисляется на наружной стороне цитоплазматической мембраны и на ее инвагинатах при участии ферментов
Арсенопирита
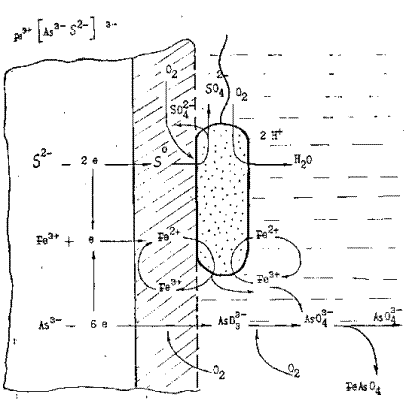
Рисунок 16
Подобный механизм бактериального окисления и выщелачивания сульфидных минералов характерен и для других минералов, как содержащих в своей структуре железо, так и не имеющих его.
Общими при бактериальном окислении сульфидных минералов, содержащих железо, будут реакции 43 и 44, остальные реакции окисления будут
для пирита
2 FeS2 + 7 O2 + 2 H2O ® 2 Fe2+ + 4 SO2-4 + 4 H+ (49)
FeS2 + 14 Fe3++ 8 H2O ® 15 Fe2++ 2 SO42-+ 16 H+ (50)
Для халькопирита:
2 CuFeS2+ 8,5 O2+ 2 H+® Cu2++ 2 Fe3++ 4 SO42++ H2O (51)
CuFeS + 4 Fe3+® Cu2++ 5 Fe2++ 2 S0 (52)
Для пирротина:
2 FeS + 4,5 O2+ 2 H+®2 Fe3++ 2 SO42-+ H2O (53)
2 FeS + 1,5 O2+ 6 H+®2 Fe3++ 2 S0 + 3H2O (54)
FeS + 8 Fe3++ 4 H2O® 9 Fe2++ SO42-+ 8 H+ (55)
Для сульфидов, не содержащих железа, например, сфалерита:
ZnS + 2,5 O2 + 2 H+® Zn2++ SO42-+ H2O (56)
ZnS = Zn2++ S0 + 2e (57)
Однако в рассматриваемом механизме не учитывается один немаловажный фактор - наличие в выщелачиваемом материале нескольких сульфидных минералов, которые отличаются своими электрохимическими характеристиками, а, следовательно, находясь в пульпе в присутствии бактерий, оказывают взаимное влияние на окисление и выщелачивание друг друга. Поэтому исследователи стали уделять внимание электрохимическим аспектам бактериального выщелачивания сульфидных минералов. Наличие минералов с различными электродными потенциалами создает гальванический эффект, по которому скорость окисления более отрицательно заряженного минерала-анода ускоряется, а менее отрицательного - катода- замедляется. В соответствии со значением электродного потенциала минералов составлены гальванические ряды, которыми можно руководствоваться при определении селективности процесса бактериального выщелачивания .
Рассмотрим механизм электрохимических реакций при бактериальном выщелачивании смеси минералов - арсенопирита и пирита.
Катодная реакция гальванического взаимодействия арсенопирита и пирита (j=0,45 В) может осуществляться тремя различными путями.
Деполяризация пирита кислородом
O2 + 4 H+ + 4e ® 2 H2O (58)
Деполяризация пирита окисным железом
Fe3+ + e ® Fe2+ (59)
Смешанная деполяризация кислородом и окисным железом
O2 +Fe3+ + 4 H+ + 5e ® Fe2+ + 2 H2O (60)
Эти катодные реакции дополняются анодной
FeAsS + 3 H2O ® Fe2+ + AsO33- + 6 H+ + S0 +5e (61)
Сумма реакций 58 и 61
4 FeAsS + 2 H2O + 5 O2 + 4 H2SO4 ® 4 FeSO4 + 4 H3AsO3 + 4 S0 (62)
представляет собой механизм окисления арсенопирита при непосредственном взаимодействии его с бактериями и кислородом, т.е. “прямой” механизм.
Сумма реакций (60) и (61)
2 FeAsS + 2 O2 + Fe2(SO4)3 +H2SO4 + 2 H2O® 4 FeSO4 + 2 S0 + 2 H3AsO3 (63)
представляет собой механизм окисления арсенопирита окисным железом при участии бактерий, т.е. “косвенный” механизм.
При деполяризации пирита в условиях бактериального выщелачивания основным деполяризатором является оксидное железо. Скорость реакции, проходящей при участии кислорода в 500-600 раз меньше скорости, обусловленной наличием оксидного железа, которого в 20-25 тысяч раз больше концентрации кислорода. Поэтому основная роль при окислении арсенопирита принадлежит Fe3+, по катодной (56) и анодной (58) реакциям, т.е.
2 FeAsS + 5 Fe2(SO4)3 + 6 H2O® 12 FeSO4 + 2 S0 + 2 H3AsO3 + 3 H2SO4 (64)
Помимо реакции (64) протекают реакции:
4 FeSO4 + O2 + 2 H2SO4 ® 2 Fe2(SO4)3 + 2 H2O (65)
2 S0 + 3 O2 +2 H2O ® 2 H2SO4 (66)
3 H3AsO3 + 2 Fe2(SO4)3 + 2 H2O® 4 FeSO4 + 2 H2SO4 + 2 H3AsO4 (67)
Fe2(SO4)3 + H3AsO4 ® 2 FeAsO4¯ + 3 H2SO4 (68)
Итоговая реакция аналогична реакции (48), т.е.
2 FeAsS + 7 O2 + 2 H2O ® 2 FeAsO4 + 2 H2SO4 (69)
Схема механизма бактериального окисления арсенопирита в присутствии пирита и микроорганизмов представлена на рисунке 17.
Схема механизма бактериального окисления пирита и арсенопирита

или:
Рисунок 17
При рН 2,0-1,2, ОВП жидкой фазы 0,78- 0,84 В и концентрации железа 7-15 г/л, арсенопирит термодинамически неустойчив и деструктирует через промежуточные фазы реальгара и аурипигмента с образованием закисного железа, о-мышьяковистой кислоты и элементной серы. Арсенопирит заряжается отрицательно, координируя вокруг себя положительно заряженную сферу.
Пирит является первичным акцептором электронов. Ионы окисного железа (0,5-1 моль/л) восстанавливаются на пирите до закисного, который выполняет функцию вторичного акцептора электронов. При этом анодная и катодная реакции делокализованы в пространстве. Образующееся закисное железо окисляется бактериями до окисного. Конечным акцептором электронов является кислород. Окисление закисного железа осуществляется бактериями, как находящимися в растворе, так и иммобилизованными на минерале. Окисление элементной серы бактериями происходит в основном на поверхности минерала. Таким образом, бактерии катализируют процессы окисления элементов кристаллической решетки (Fe2+ и S2-), т.е. служат переносчиками электронов к их конечному акцептору кислороду через цепь промежуточных акцепторов - пирит и окисное железо
Рис. 27
железа, после второй стадии - 7,6 г/л мышьяка и 11 г/л железа. Содержание золота не превышает 0,01 мг/л.
Полученные при кислотном выщелачивании растворы после первой стадии содержат 12 г/л мышьяка, 15 г/л железа, после второй стадии - 7,6 г/л мышьяка и 11 г/л железа. Содержание золота не превышает 0,01 мг/л.
В процессе кислотного выщелачивания мышьяк на 93-94% переходит в раствор, а из него - на 80% в мышьяковистый кек.
Представляет интерес безреагентное осаждение мышьяка и железа из выщелачивающих растворов, которые подвергаются нагреванию до 900С в течение одного часа. При этом получается мышьяковистый осадок, содержащий более 23% мышьяка и 25% железа. Выход этого осадка в 2 раза меньше по сравнению с осадком, выделяемым известковым методом, содержание в нем мышьяка повышается в 2-2,5 раза. При этом извлечение мышьяка в осадок достигает 89-90%, а железа 78%.
| |
По схеме с частичной очисткой оборотных растворов доизмельченный до крупности 95-97% -0,074 мм концентрат сгущается в обезвоживающем конусе. Сгущенный продукт распульповывается в контактном чане до Т:Ж = 1:4 оборотными растворами, содержащими 3-4 г/л мышьяка, 6-8 г/л железа, 0,6 г/л биомассы. Окислительная активность этих растворов равна 0,2-0,5 г/л×ч при рН 2,3-2,4. В контактный чан подаются также биогенные элементы - сульфат аммония (2 кг/т) и двузамещенный фосфат калия (1 кг/т). Через пачук, в котором осуществляется культивирование бактерий проходило около 20-30% пульпы от общего потока. Значение рН при выщелачивании поддерживалось только в первые 70 часов выщелачивания на уровне 1,9-2,0, затем значение рН снижалось до 1,6. Такой режим приводит к усилению коррозионного взаимодействия между арсенопиритом и пиритом. Так, в первые 25 часов выщелачивается около 75% арсенопирита и только 30% пирита. За 100 часов арсенопирит разрушается на 95-96%, а пирит на 85-87%. Содержание мышьяка в жидкой фазе пульпы увеличивается с 4,4 до 5,7 г/л, железа с 10 до 17 г/л, а количество биомассы с 1,8 до 4 г/л при окислительной активности ее 3,9-2,6 г/л×ч.
Осаждение мышьяка и железа производилось из слива сгустителя и фильтрата известковым молоком (5 кг/т) при рН 2,3-2,5. После этого осаждения растворы направлялись на приготовление пульпы.
По схеме бактериального выщелачивания без очистки оборотных растворов (см.рис.26) значение рН на уровне 2,0-2,2 поддерживалось первые 46 часов, что необходимо для роста бактерий. В дальнейшем кислотность среды не регулировалась и к концу процесса выщелачивания снизилась до 1,2-1,25. В этих условиях характерной является кинетика выщелачивания. Так, максимальная скорость выщелачивания мышьяка отмечается в первые 10 часов и составляет 0,7-1,0 г/л×ч, при скорости выщелачивания железа из пирита 0,05-0,1 г/л×ч. После 50 часов выщелачивания, когда практически весь арсенопирит уже разрушился, скорость выщелачивания железа из пирита достигает 0,4 г/л×ч.
Подача оборотных растворов без удаления железа и мышьяка в голову процесса повлияла не только на изменение рН, но и на рост и развитие культуры, а также на изменение состава жидкой фазы пульпы. Так, количество биомассы по мере выщелачивания снизилось с 9,8 до 4,5 г/л, а ее активность упала с 4,0 до 2,5 г/л×ч. Это вызвано повышением концентрации железа до 27 г/л и мышьяка до 8 г/л. Однако это не оказало сильного влияния на окисление арсенопирита и пирита. За 100 часов выщелачивания арсенопирит окислился на 98%, а пирит на 89%. При последующем цианировании золото из остатков выщелачивания извлекается на 92-94%, в то время как без бактериального вскрытия - только на 38-40%.
При бактериальном выщелачивании концентрата Майского месторождения, содержащего 5,7% мышьяка, 1,4% сурьмы, 19,8% железа, 18,3% серы и 60,8 г/т золота, степень окисления арсенопирита составила 96,2%, пирита 69,9%. Содержание мышьяка в кеке бактериального выщелачивания было снижено до 0,24%. При сорбционном цианировании остатков бактериального выщелачивания извлечение золота достигло 94,6%, в то время как из исходного концентрата золота цианированием извлекалось не более 10%.
Наиболее сложным объектом для бактериального выщелачивания оказались золотомышьяковые концентраты, получаемые при гравитационном и флотационном обогащении первичных руд Олимпиадинского месторождения (табл.6 и 7). Они отличаются высоким содержанием пирротина (более 30%) и антимонита (7%), что несомненно оказывает отрицательное влияние как на процесс бактериального окисления арсенопирита, так и на цианирование золота.
Таблица 6 – Химический состав концентратов Олимпиадинского месторождения
| Элементы | Содержание, % | |
| гравитационный концентрат | флотационный концентрат | |
| Мышьяк | 4,75 | 4,15-4,48 |
| Сера | 23,73 | 16,34-21,63 |
| Железо | 26,76 | 31,63-35,94 |
| Сурьма | 6,25 | 0,40-1,72 |
| Углерод органический | 0,04 | 0,40-0,68 |
| Золото, г/т | 60,8 | 182-226,1 |
Таблица 7 – Минералогический состав концентратов Олимпиадинского месторождения
| Минералы | Содержание, % | |
| гравитационный концентрат | флотационный концентрат | |
| Пирротин | 33,0 | 31-36,5 |
| Пирит | 12,0 | 5,0-6,0 |
| Арсенопирит | 8,0 | 9,1-10,0 |
| Антимонит | 7 | 0,5-1,5 |
| Кварц, алюмосиликаты и др. | 35 | 47,0-53,0 |
Основное количество золота (81-85%) находится в свободном состоянии и сростках и хорошо извлекается цианированием. Количество золота, связанного с арсенопиритом и пиритом, составляет всего 9,5-10%. Пирротин золота не содержит. Однако в хвостах цианирования исходных концентратов содержание золота не снижается ниже 24-28 г/т, вероятно из-за присутствия в концентрате антимонита.
Процесс бактериального выщелачивания концентратов осуществляется по схеме, представленной на рис.28, а схема цепи аппаратов на рис.29.
Рис. 30.
Таблица 10 – Результаты обогащения остатков бактериального выщелачивания
олово-медно-мышьякового концентрата
| Продукты | Выход, % | Содержание, % | Извлечение, % | ||
| медь | олово | медь | олово | ||
| I медный концентрат | 19,10 | 22,00 | 0,18 | 48,90 | 2,80 |
| II медный концентрат | 26,30 | 13,40 | 0,40 | 41,00 | 8,50 |
| Общий медный концентрат | 45,50 | 17,00 | 0,30 | 89,90 | 11,40 |
| Оловянный концентрат | 5,20 | 3,80 | 20,00 | 2,30 | 84,60 |
| Хвосты отвальные | 49,30 | 1,30 | 0,10 | 7,80 | 4,00 |
| Исходный продукт (остатки БВ) | 100,00 | 8,60 | 1,23 | 100,00 | 100,00 |
Рисунок 33
Рисунок 34
Золотомышьяковые концентраты, перерабатываемые на этой фабрике, отличаются высоким содержанием пирротина (19%). Поэтому эти концентраты (150 т/сут) направляются на бактериальное выщелачивание в биореактор объемом 580 м3, где в течение 4 часов окисляется 30% сульфидов, и прежде всего, пирротин. Затем, после сгущения, кек бактериального выщелачивания направляется на автоклавный процесс, где происходит окончательное вскрытие золота, извлечение которого последующим цианированием достигает 92%. Введение процесса БВ в технологию переработки золотомышьяковых концентратов позволило увеличить общую производительность цикла окисления на 25% .
В США первая промышленная установка биогидрометаллургической технологии извлечения золота из упорных сульфидных руд внедрена на новой фабрике “Tonkin Springs” компании US Gold и Homestake Mining. На фабрике перерабатывается упорная золотосодержащая руда, в которой тонковкрапленное и микроскопическое золото находится в тонкозернистых сульфидах. В руде содержится 3,9 г/т золота, 0,25% мышьяка, 1,34% серы, 1,76% железа и 0,39% органического углерода. При прямом цианировании тонкоизмельченной руды извлечение золота не превышает 60%. Поэтому для вскрытия золота в сульфидах было использовано бактериальное окисление исходной руды, измельченной до крупности 0,044 мм (рис.39). БВ руды (1500 т/сутки) осуществляется при рН 2-1,0 в 4-х биореакторах диаметром 16 м и высотой 13 м с использованием бактерий T.ferrooxidans. Оптимальная температура в биореакторах поддерживается на уровне 30-400С, плотность пульпы - не более 30% твердого. Продолжительность бактериального выщелачивания при этих условиях составляет 60 часов. После сгущения и нейтрализации пульпа направляется на сорбционное цианирование в течение 24 часов. Извлечение золота по такой технологии составляет 90%.
В 1989 году процесс бактериального выщелачивания внедрен компанией “Костич Рисеч” на фабрике “Austin” (штат Невада) для выщелачивания флотационного концентрата крупностью -0,074 мм, содержащий 90-170 г/т золота. Этот концентрат в количестве 45-50 т/сутки подвергается БВ в трех параллельно работающих биореакторах в течение 120 ч.(рисунок 35) При степени окисления сульфидов 80% извлечение золота в цикле цианирования достигает 90%, в то время как при прямом цианировании оно не превышает 74-78%
Схема переработки золотосодержащей руды на фабрике «Аустин» (США)
Рисунок 35.
В Канаде на фабрике “Салмита” работает опытно- промышленная установка бактериального выщелачивания золота производительностью 10 т руды/ сутки, на которой отрабатываются параметры и режимы выщелачивания руды, содержащей 0,75% мышьяка, 0,95% серы и 21 г/т золота. Извлечение золота после бактериального выщелачивания достигает 95,6%, что на 30% выше, чем при прямом цианировании руды.
Построена установка на фабрике “Конгресс” (Британская Колумбия), где также проводятся исследования биогидрометаллургических технологий различных упорных концентратов ( рисунок 36)
Схема переработки упорной золотомышьяковой руды на фабрике «Тонкин Спрингс» (США)
Рисунок 36
Исходный продукт
Технология
Содержание, %
Таблица 18 - Экономические показатели процессов переработки золотосодержащих
концентратов
| Виды затрат | Страна производительность, т/сут | Технология | |
| Автоклавное выщелачивание | Бактериальное выщелачивание | ||
| Капитальные затраты, % | 90 ЮАР | 230 | 100 |
| Эксплуатационные расходы, % | 110 | 100 | |
| Капитальные затраты, % | 50 Канада | 286 | 100 |
| Эксплуатационные расходы, % | 180 | 100 |
При выборе технологии для переработки золотомышьяковых концентратов месторождения “Олимпия” (Греция) было проведено технико-экономическое сравнение конкурирующих технологий: обжиг, автоклавное выщелачивание и бактериальное выщелачивание. Это сравнение также показало высокую экономическую эффективность последнего (таблица 19) при производительности 100 тыс.т/год .
Таблица 19 - Экономическое сравнение процессов переработки золотомышьяковых
концентратов месторождения “Олимпия” (Греция)
| Виды затрат | Варианты технологии | ||
| Обжиг | Автоклавное выщелачивание | Бактериальное выщелачивание | |
| Капитальные вложения, % | 280 | 280 | 100 |
| Эксплуатационные затраты, % | 77,0 | 126 | 100 |
| Прибыль, % | 84,0 | 96,0 | 100 |
При переработке золотомышьякового концентрата, содержащего 278 г/т золота, на установке производительностью 100 т/сутки наименьшие капитальные вложения и эксплуатационные затраты достигаются также по технологии бактериального выщелачивания (табл.20).
Таблица 20 - Экономическое сравнение процессов переработки золотомышьякового концентрата на установке, производительностью 100 т/сут.
| Виды затрат | Технология | ||
| Обжиг | Автоклавное выщелачивание | Бактериальное выщелачивание | |
| Капитальные затраты, % | 130 | 198 | 100 |
| Эксплуатационные расходы: дол/т % | 55,90 129 | 42,79 99,5 | 43,09 100 |
Основные технико-экономические показатели различных вариантов технологии переработки золотомышьяковых концентратов Бакырчикского месторождения, которые определены институтом Гиналмаззолото, показывают, что для этих концентратов также наиболее экономичным и эффективным процессом вскрытия золота является бактериальное выщелачивание. При переработке в год 75 тыс.тонн золотомышьякового концентрата капитальные вложения в 2,3 раза меньше, чем по процессу «обжиг- цианирование». Для процесса характерным является самый низкий уровень эксплуатационных расходов и приведенных затрат.
Для определения экономичности процесса кучного выщелачивания меди были проведены экономические расчеты работы установки объемом 20 млн. т руды. При выщелачивании кучи руды высотой 35 м в течение 5 лет ежедневно извлекалось 16 т руды и за 350 дней 5625 т. Капитальные затраты при одновременном выщелачивании 5 млн. т составили 1 млн долларов, эксплуатационные затраты – 385 тыс. долл. Таким образом общие затраты на переработку 1 т руды составили 0,132 долл. , или на получение 1 кг меди расходуется всего 1,35 долл
СПИСОК ЛИТЕРАТУРЫ
1. Полькин С.И., Адамов Э.В., Панин В.В. Технология бактериального выщелачивания цветных и редких металлов. М.: Недра, 1982. 288 с.
2. . 2. 1988. P.1158-1168
3. Каравайко Г.И., Кузнецов С.И., Голомзик А.И. Роль микроорганизмов в выщелачивании металлов из руд. М., Наука, 1972
4. Адамов Э.В., Панин В.В. Бактериальное и химическое выщелачивание металлов из руд. Итоги науки и техники. Обогащение полезных ископаемых. М.: ВИНИТИ. 1974. Т.8., с.5-67.
5 Биогеотехнология металлов. Практическое руководство. ГКНТ, 1989.- 375 с.
Оглавление
Оглавление.. 3
ВВЕДЕНИЕ.. 5
1.Основные области использования процессов биотехнологии металлов.. 6
2. Систематика и классификация микроорганизмов.. 9
3. Основные параметры чанового процесса бактериального выщелачивания золотомышьяковых концентратов.. 18
3.1 Физико-химические параметры. 20
3.2 Биологические параметры. 28
3.3.Технологические параметры... 33
4. Теоретические основы бактериального окисления и выщелачивания сульфидных минералов.. 38
4.1. Кинетика бактериального окисления и выщелачивания сульфидных минералов.. 46
4.2. Механизм биохимического окисления железа и сульфидной серы. 59
4.3. Механизм бактериального окисления и выщелачивания сульфидных минералов.. 62
5. Методы интенсификации процессов бактериального окисления и выщелачивания 68
6. Технология чанового бактериально-химического выщелачивания сульфидных концентратов и продуктов.. 74
6.1. Технология бактериального выщелачивания упорных золотомышьяковых концентратов.. 74
6.2. Комбинированная технология переработки мышьяксодержащих продуктов и концентратов с использованием процесса бактериального выщелачивания.. 105
6.3. Технология бактериального выщелачивания коллективных концентратов цветных металлов. 111
7. Технология кучного бактериального выщелачивания медных, и золотосодержащих руд.. 123
8. Промышленная практика технологии чанового бактериального выщелачивания 134
9. Экономика технологии переработки руд цветных металлов с прнменением процесса бактериального выщелачивания.. 145
9.1. Технико-экономический расчет эффективности применения бактериального выщелачивания и бактериальных растворов цинкового купороса при флотационном обогащении упорных медно-цинковых руд.. 149
СПИСОК ЛИТЕРАТУРЫ... 156
ВВЕДЕНИЕ
Бактериальные методы выщелачивания относятся к одному из современных направлений научно-технического прогресса в области переработки минерального сырья - биотехнологии металлов, которая позволяет значительно повысить комплексность использования этого сырья и обеспечить эффективную защиту окружающей среды.
Роль бактерий в круговороте веществ известна давно, однако, как считалось ранее, деятельность всех видов микроорганизмов сводится только к разрушению и преобразованию различных органических соединений. Известно более 2500 видов микроорганизмов и среди них немало тех, которые принимают участие в деструкции и синтезе неорганических веществ, в геохимических процессах на Земле. Открытие С.Н. Виноградским явления хемосинтеза - автотрофного усвоения углекислоты микроорганизмами, окисляющими неорганические вещества, - положило начало исследованиям геохимической деятельности микроорганизмов.
Бактерии «... производят в биосфере огромную геохимическую работу, как разлагая соединения, так и создавая, как следствие этого разложения, новые синтезы. Их роль значительна в истории углерода, серы, азота, железа, марганца и вероятно многих других элементов нашей планеты» - писал основоположник биогеохимии - науки о роли микроорганизмов в геохимических процессах, В.И. Вернадский - «... они обеспечивали и обеспечивают непрерывный поток элементов в биогенном облике веществ на нашей планете». Огромную роль микроорганизмов в природе отмечал и Б.Л.Исаченко_ выдающийся русский микробиолог: « Микробы нарушители равновесия в природе. Бесчисленное множество их своим неустанным участием приводит в беспокойство чуть ли ни все элементы менделеевской системы». Действительно, установлено участие микроорганизмов в концентрировании и рассеивании более 60 элементов, в формировании ореолов из рассеивания, химического состава подземных вод, в генезисе месторождений серы, железа, цветных и редких металлов.
В 1921-22 г. были проведены первые исследования , которые показали, что некоторые неидентифицированные серуокисляющие микроорганизмы способны окислять пирит и сфалерит. В это же время Ваксманом и Джоффи были выделены автотрофные ацидофильные микроорганизмы, окисляющие серу и ее восстановленные соединения до сульфата.
В 1947 году Хинкелем и Колмером из дренажных кислых вод угольной шахты штата Зап. Вирджиния (США) были выделены микроорганизмы, способные принимать участие в окислении двухвалентного железа до трехвалетного. Однако первые установки по выщелачиванию металлов из руд и горных пород появились еще в ХVΙ веке (Венгрия, Германия, Испания) и только в 1958 году был получен патент на процесс кучного бактериального выщелачивания меди в Бингамском Каньоне (США).
Научными трудами крупнейших отечественных и зарубежных микробиологов показана огромная роль бактерий в геохимических процессах образования и разрушения месторождений серы, сульфидных, железных, марганцевых и других руд.
Геологическая микробиология, как наука о роли микроорганизмов в круговороте химических элементов в биосфере из чисто теоретической превратилась в технологическую с большим теоретическим фундаментом. Это произошло благодаря тому, что микробиологические процессы, которые происходят в месторождениях полезных ископаемых, идут настолько интенсивно, что могут направленно использоваться в практических целях.
Биотехнология занимается не только бактериальным выщелачиванием металлов из твердых минеральных субстратов, но и выделением их из промышленных растворов и сточных вод. Особая ценность большинства процессов биотехнологии металлов заключается в минимальном воздействии на окружающую среду или полностью исключающей ее загрязнение.
Особенно большой прогресс в последние годы достигнут в развитии процессов чанового бактериального выщелачивания, основы которого были разработаны в Московском институте стали и сплавов на кафедре обогащения руд цветных и редких металлов, совместно с Институтом микробиологии РАН.
В настоящее время созданы не только научные основы процесса, но и разработаны, испытаны и действуют промышленные установки чанового процесса бактериального выщелачивания .
Основные области использования процессов биотехнологии металлов
Теоретические исследования процесса взаимодействия микроорганизмов с минералами, а также имеющийся промышленный опыт применения технологии чанового выщелачивания позволили определить основные направления использования технологии чанового бактериального выщелачивания. ( Рисунок. 1). Это прежде всего бактериальное вскрытие золота, тонковкрапленного в сульфидные минералы, особенно в арсенопирит и пирит, удаление мышьяка как вредной примеси из мышьяксодержащих концентратов и продуктов, получаемых при обогащении руд цветных и редких металлов. Этим методом можно эффективно разделять такие коллективные концентраты цветных металлов, как медно-цинковые, медно-никелевые и т.п. Предварительная бактериальная обработка минеральных продуктов и концентратов перед обогатительными, металлургическими процессами значительно интенсифицирует их и увеличивает полноту извлечения металлов.
Эффективно использование чанового процесса при очистке промышленных сточных вод и серосодержащих газов металлургических производств. Разработанные научные основы и промышленный опыт показали, что чановый метод обладает рядом достоинств, что позволяет широко использовать его наряду с другими гидрометаллургическими процессами и делает его перспективным при переработке труднообогатимого минерального сырья.
Разработанные научные основы и промышленный опыт показали, что чановый метод обладает рядом достоинств, что позволяет широко использовать его наряду с другими гидрометаллургическими процессами и делает его перспективным при переработке труднообогатимого минерального сырья.
Во-первых, этот метод в отличие от кучного и подземного выщелачивания является полностью контролируемым и управляемым. Во-вторых, он применяется для тонкоизмельченных продуктов, что значительно ускоряет процесс бактериального окисления и деструкции минералов. В-третьих, создавая определенные условия выщелачивания, можно достичь высокой степени селективности при извлечении ценных минеральных продуктов. В-четвертых, метод не требует применения специального оборудования, от может осуществляться, например, в кислотостойких чанах или пачуках. И, наконец, этот метод низкотемпературный, без выбросов в атмосферу вредных отходов, с замкнутым водооборотом, т.е. экологически чистый. В настоящее время в промышленных масштабах бактериальные методы выщелачивания применяются примерно в двадцати странах мира, на 40 предприятиях при подземном и кучном выщелачивании меди, урана из бедных и забалансовых руд, при переработке отвалов обогатительных фабрик и горнорудных предприятий. Уже сейчас бактериально-химическими методами добывается около 20% меди и значительная часть урана (США, Канада, Мексика, Перу, Испания, Австралия, Югославия и др.). В США в 2000 году этими методами добывалось меди и урана на сумму 5 млрд. долларов.
Основные процессы биотехнологии металлов
 | |||||||
 | |||||||
|
| ||||||
Рисунок 1
Независимо от вида применяемого технологического процесса современное микробиологическое выщелачивание представляет собой специфичный гидрометаллургический процесс, при котором окисление и выщелачивание сульфидных минералов осуществляется в сернокислой среде в присутствии хемолитоавтотрофных тионовых бактерий.
Чановый метод бактериального выщелачивания (БВ) является сравнительно новым. Развитие его связано с необходимостью переработки труднообогатимых руд, промпродуктов и некондиционных упорных концентратов, получаемых при обогащении сложного полиметаллического сырья, для которых обычные механические и физико-химические методы переработки малоэффективны. Практическая ценность этого метода заключается в том, что он может применяться для очистки концентратов от таких вредных примесей, как мышьяк, для разрушения кристаллической решетки сульфидных минералов с целью вскрытия тонковкрапленного в них золота, для селективного извлечения металлов из коллективных концентратов или промпродуктов, для повышения качества некондиционных концентратов и т.п.
Важной особенностью чанового выщелачивания металлов является то, что при сочетании его с другими методами переработки обеспечиваются гораздо большие скорости, нежели при подземном и кучном. Скорость процесса в основном и определяет технологию выщелачивания и ее экономичность.
В настоящее время исследованиями процесса бактериального окисления и выщзелачивания занимается около 100 научных организаций и фирм в 25 странах. Построены и действуют около 15 промышленных установок бактериального выщелачивания в 8 странах (ЮАР, Австралия, Бразилия, США, Канада, Замбия, Гана, Россия ), большое количество опытно-промышленных установок в целом ряде стран.
Дата: 2019-07-30, просмотров: 399.