Этиология
Причиной дефицита железа является нарушение его баланса в сторону преобладания расходования железа над поступлением, наблюдаемое при различных физиологических состояниях или заболеваниях:
· кровопотери различного генеза;
· повышенная потребность в железе;
· нарушение усвоения железа;
· врождённый дефицит железа;
· нарушение транспорта железа вследствие дефицита трансферрина.
Кровопотери различного генеза
Повышенное расходование железа, вызывающее развитие гипосидеропении, чаще всего связано с кровопотерей или с усиленным его использованием при некоторых физиологических состояниях (беременность, период быстрого роста). У взрослых дефицит железа развивается, как правило, вследствие кровопотери. Чаще всего к отрицательному балансу железа приводят постоянные небольшие кровопотери и хронические скрытые кровотечения (5 — 10 мл/сут). Иногда дефицит железа может развиться после однократной массивной потери крови, превышающей запасы железа в организме, а также вследствие повторных значительных кровотечений, после которых запасы железа не успевают восстановиться.
По статистическим данным, у 20 — 30 % женщин детородного возраста наблюдается скрытый дефицит железа, у 8 — 10 % обнаруживается железодефицитная анемия. Основной причиной возникновения гипосидероза у женщин, кроме беременности, являются патологическая менструация и маточные кровотечения. Полименорея может быть причиной уменьшения запасов железа в организме и развития скрытого дефицита железа, а затем и железодефицитной анемии. Маточные кровотечения в наибольшей мере увеличивают объем кровопотери у женщин и способствуют возникновению железодефицитных состояний. Существует мнение о том, что фибромиома матки, даже при отсутствии менструальных кровотечений, может привести к развитию дефицита железа. Но чаще причиной анемии при фибромиоме является повышенная кровопотеря.
Развитие постгеморрагической железодефицитной анемии, также вызывают кровопотери из пищеварительного канала, которые часто имеют скрытый характер и трудно диагностируются. Такие кровопотери могут быть обусловлены заболеваниями органов пищеварения и болезнями других органов. Нарушения баланса железа могут сопровождать повторные острые эрозивные или геморрагические эзофагиты и гастриты, язвенная болезнь желудка и двенадцатиперстной кишки с повторными кровотечениями, хронические инфекционные и воспалительные заболевания пищеварительного канала. При гигантском гипертрофическом гастрите (болезни Менетрие) и полипозном гастрите слизистая оболочка легко ранима и часто кровоточит. Частой причиной скрытых труднодиагностируемых кровопотерь является грыжа пищевого отверстия диафрагмы, варикозное расширение вен пищевода и прямой кишки при портальной гипертензии, геморрой, дивертикулы пищевода, желудка, кишок, протока Меккеля, опухоли. Легочные кровотечения — редкая причина развития дефицита железа. К развитию дефицита железа иногда могут приводить кровотечения из почек и мочевых путей. Очень часто сопровождаются гематурией гипернефромы.
В некоторых случаях кровопотери различной локализации, являющиеся причиной железодефицитной анемии, связаны с гематологическими заболеваниями (коагулопатиями, тромбоцитопениями и тромбоцитопатиями), а также с поражением сосудов при васкулитах, коллагенозах, болезни Рандю — Вебера — Ослера, гематомах.
Несбалансированное питание
Дефицит железа алиментарного происхождения может развиться у детей и взрослых при недостаточном его содержании в пищевом рационе, что наблюдается при хроническом недоедании и голодании, при ограничении питания с лечебной целью, при однообразной пище с преимущественным содержанием жиров и сахаров. У детей может наблюдаться недостаточное поступление железа из организма матери как следствие железодефицитной анемии во время беременности, преждевременных родов, при многоплодности и недоношенности, преждевременной перевязке пуповины до прекращения пульсации.
Нарушение усвоения железа
Длительное время считали основной причиной развития дефицита железа отсутствие хлористоводородной кислоты в желудочном соке. Соответственно выделяли гастрогенную или ахлоргидрическую железодефицитную анемию. В настоящее время установлено, что ахилия может иметь только дополнительное значение в нарушении всасывания железа в условиях повышенной потребности в нем организма. Атрофический гастрит с ахилией возникает вследствие дефицита железа, обусловленного снижением активности ферментов и клеточного дыхания в слизистой оболочке желудка.
К нарушению всасывания железа могут приводить воспалительные, рубцовые или атрофические процессы в тонкой кишке, резекция тонкой кишки. Существует ряд физиологических состояний, при которых потребность в железе резко увеличивается. К ним относятся беременность и лактация, а также периоды усиленного роста у детей. Во время беременности расходование железа резко повышается на потребности плода и плаценты, кровопотерю при родах и лактацию. Баланс железа в этот период находится на грани дефицита, и различные факторы, уменьшающие поступление или увеличивающие расход железа, могут приводить к развитию железодефицитной анемии.
Железодефицитная анемия иногда, особенно в грудном и пожилом возрасте, развивается при инфекционных и воспалительных заболеваниях, ожогах, опухолях, вследствие нарушения обмена железа при сохранённом его общем количестве.
Железодефицитная анемия
Железодефицитное состояние зависит от степени дефицита железа и скорости его развития и включает признаки анемии и тканевого дефицита железа (сидеропении). Явления тканевого дефицита железа отсутствуют лишь при некоторых железодефицитных анемиях, обусловленных нарушением утилизации железа, когда депо переполнены железом. Таким образом, железодефицитная анемия в своем течении проходит два периода: период скрытого дефицита железа и период явной анемии, вызванной дефицитом железа. В период скрытого дефицита железа появляются многие субъективные жалобы и клинические признаки, характерные для железодефицитных анемий, только менее выраженные. Больные отмечают общую слабость, недомогание, снижение работоспособности. Уже в этот период могут наблюдаться извращение вкуса, сухость и пощипывание языка, нарушение глотания с ощущением инородного тела в горле (синдром Пламмера — Винсона), сердцебиение, одышка..
При объективном обследовании больных обнаруживаются «малые симптомы дефицита железа»: атрофия сосочков языка, хейлит («заеды»), сухость кожи и волос, ломкость ногтей, жжение и зуд вульвы. Все эти признаки нарушения трофики эпителиальных тканей связаны с тканевой сидеропенией и гипоксией.
Скрытый дефицит железа может быть единственным признаком недостаточности железа. К таким случаям относятся нерезко выраженные сидеропении, развивающиеся на протяжении длительного времени у женщин зрелого возраста вследствие повторных беременностей, родов и абортов, у женщин — доноров, у лиц обоего пола в период усиленного роста. У большинства больных при продолжающемся дефиците железа после исчерпания его тканевых резервов развивается железодефицитная анемия, являющаяся признаком тяжелой недостаточности железа в организме. Изменения функции различных органов и систем при железодефицитной анемии являются не столько следствием малокровия, сколько тканевого дефицита железа. Доказательством этого служит несоответствие тяжести клинических проявлений болезни и степени анемии и появление их уже в стадии скрытого дефицита железа.
Больные железодефицитной анемией отмечают общую слабость, быструю утомляемость, затруднение в сосредоточении внимания, иногда сонливость. Появляются головная боль после переутомления, головокружение. При тяжелой анемии возможны обмороки. Эти жалобы, как правило, зависят не от степени малокровия, а от продолжительности заболевания и возраста больных.
Железодефицитная анемия характеризуется изменениями кожи, ногтей и волос. Кожа обычно бледная, иногда с легким зеленоватым оттенком (хлороз) и с легко возникающим румянцем щек, она становится сухой, дряблой, шелушится, легко образуются трещины. Волосы теряют блеск, сереют, истончаются, легко ломаются, редеют и рано седеют. Специфичны изменения ногтей: они становятся тонкими, матовыми, уплощаются, легко расслаиваются и ломаются, появляется исчерченность. При выраженных изменениях ногти приобретают вогнутую, ложкообразную форму (койлонихия).
Диагностика
Клинический анализ крови
В общем анализе крови при ЖДА будут регистрироваться снижение уровня гемоглобина и эритроцитов. Умеренная эритроцитопения может проявляться при Hb <98 г/л, однако снижение эритроцитов <2·1012/л для ЖДА не характерно. При ЖДА будут регистрироваться изменения морфологических характеристик эритроцитов и эритроцитарных индексов, отражающих количественно морфологические характеристики эритроцитов.
Для ЖДА характерно наличие микроцитоза (уменьшение размера эритроцитов). Анизоцитоз — различия в размерах эритроцитов у одного и того же человека. Для ЖДА характерен выраженный анизоцитоз. Пойкилоцитоз — наличие в крови одного и того же человека эритроцитов разной формы. При ЖДА может быть выраженный пойкилоцитоз. Цветовой показатель эритроцитарных клеток (ЦП) зависит от содержания в них гемоглобина. Возможны следующие варианты окрашивания эритроцитов:
· нормохромные эритроциты (ЦП= 0,85-1,05) — нормальное содержание гемоглобина в эритроцитах. Эритроциты в мазке крови имеют равномерную розовую окраску умеренной интенсивности с небольшим просветлением в центре;
· гипохромные эритроциты (ЦП<0,85) — содержание гемоглобина в эритроците снижено. В мазке крови такие эритроциты имеют бледно-розовую окраску с резким просветлением в центре. Для ЖДА гипохромия эритроцитов является характерной и часто сочетается с микроцитозом;
· гиперхромные эритроциты (ЦП>1,05) — содержание гемоглобина в эритроцитах повышено. В мазке крови эти эритроциты имеют более интенсивную окраску, просвет в центре значительно уменьшен либо отсутствует. Гиперхромия связана с увеличением толщины эритроцитов и часто сочетается с макроцитозом;
· полихроматофилы — эритроциты, окрашенные в мазке крови в светло-фиолетовый, сиреневый цвет. При специальной суправитальной окраске это — ретикулоциты. В норме могут быть единичными в мазке.
Биохимический анализ крови
При развитии ЖДА в биохимическом анализе крови будут регистрироваться:
· уменьшение концентрации сывороточного ферритина;
· уменьшение концентрации сывороточного железа;
· повышение ОЖСС;
· уменьшение насыщения трансферрина железом.
Лечение
Лечение проводится только длительным приёмом препаратов двухвалентного железа внутрь в умеренных дозах, причём существенный прирост гемоглобина, в отличие от улучшения самочувствия, будет не скорым — через 4—6 недель.
Обычно назначается любой препарат двухвалентного железа — чаще это сульфат железа — лучше его пролонгированная лекарственная форма, в средней лечебной дозе на несколько месяцев, затем доза снижается до минимальной ещё на несколько месяцев, а затем (если причина малокровия не устранена), продолжается приём поддерживающей минимальной дозы в течение недели ежемесячно многие годы. Так, эта практика хорошо оправдала себя при лечении тардифероном женщин с хронической постгеморрагической железодефицитной анемией вследствие многолетней гиперполименорреи — одна таблетка утром и вечером 6 месяцев без перерыва, затем одна таблетка в день ещё 6 месяцев, затем несколько лет каждый день в течение недели в дни месячных. Это обеспечивает нагрузку железом при появлении затянутых обильных месячных в период климакса. Бессмысленным анахронизмом является определение уровня гемоглобина до и после месячных.
Беременным с дефицитом железа и малокровием (небольшое снижение уровня гемоглобина и числа эритроцитов физиологично вследствие умеренной гидремии и не требует лечения) назначается средняя доза сульфата железа внутрь до родов и в период кормления грудью, если у ребёнка не возникнет диарея, что обычно случается редко.
Профилактика:
· периодическое наблюдение за картиной крови;
· употребление пищи с высоким содержанием железа (мясо, печень и др.);
· профилактический прием препаратов железа в группах риска.
· оперативная ликвидация источников кровопотерь.
23. Мегалобластные анемии
Мегалобластные анемии – группа заболеваний крови, общим признаком которых является подавление нормального кроветворения с переходом на эмбриональный мегалобластный тип эритропоэза, что обусловлено дефицитом в организме цианкобаламина (витамин В12) и/или фолиевой кислоты.
МКБ-10: D51. - Витамин-В12-дефицитная анемия.
D52. – Фолиеводефицитная анемия.
Этиология. Причиной мегалобластных анемий являются недостаточное содержание в организме больного витамина В12(цианкобаламина) и/или фолиевой кислоты.
Витамин В12 и фолиевая кислота эндогенно не продуцируются и поступают в организм с мясными продуктами, дрожжами. Фолиевая кислоты присутствует практически во всех зеленых овощах и фруктах, мясных продуктах, не подвергавшихся длительной и интенсивной термической обработке.
Поступающий с пищей витамин В12 связывается с гастромукопротеином и всасывается в кровь в тонком кишечнике. Депонируется главным образом в печени.
Фолиевая кислота всасывается в кишечнике без посредников. Она лучше всасывается в присутствии аскорбиновой кислоты.
Имеющиеся в организме запасы витамина В12 могут обеспечить нормальное кроветворение в течение 3-4 лет, запасы фолиевой кислоты – 4-5 месяцев.
Дефицит витамина В12 вызывают следующие обстоятельства :
· Длительное недостаточное поступление с пищей. Встречается у строгих вегетарианцев, пожилых малообеспеченных людей
· Нарушение усвоения витамина при отсутствии его переносчика - гастромукопротеина, секретируемого слизистой желудка. Причиной такой патологии чаще всего является атрофический гастрит типа А, при котором имеет место гистаминрезистентная ахлоргидрия, аутоиммунная реактивность к обкладочным клеткам. Наблюдается также при опухолях желудка, после операций гастрэктомии.
· Нарушение всасывания витамина в тонком кишечнике. Встречается при хронических заболеваниях кишечника (терминальный илеит, дивертикулез, опухоли, состояние после резекций тонкой кишки).
· Избыточный расход поступающего с пищей витамина на этапах его транспортировки. Встречается при инвазии кишечника широким лентецом, при гемобластозах.
· Недостаточная способность накапливать и сохранять витамин в его основном депонирующем органе – печени. Встречается у больных с циррозом, фиброзом печени.
· Врожденные дефекты механизмов транспорта и утилизации витамина В12.
К дефициту фолиевой кислоты ведут следующие причины :
· Алиментарная недостаточность (однообразная консервированная животная пища – у моряков, участников длительных экспедиций).
· Алкоголизм.
· Беременность.
· Побочные эффекты фармакотерапии (при лечении антагонистами фолиевой кислоты, противосудорожными препаратами, сульфаниламидами и др.).
· Хронические воспалительные заболевания тонкого кишечника, резекции тонкой кишки.
Патогенез. Витамин В12 является предшественником двух коферментов: метилкобаламина и дезоксиаденозилкобаламина.
Метилкобаламин необходим для синтеза ДНК. При его недостатке нарушается цикл преобразования фолиевой кислоты, обеспечивающий переход уридинмонофосфата в тимидинмонофосфат. Возникающие в связи с этим нарушения структуры ДНК аналогичны таковым при дефиците фолиевой кислоты. Происходит торможение деления клеток быстро пролиферирующих тканей, в первую очередь клеток кроветворной системы.
Дезоксиаденозилкобаламин участвует в обмене жирных кислот. При его недостатке не происходит переход метилмалоновой кислоты в янтарную. Метилмалоновая кислота токсична для нервной системы. При ее избытке возникает дегенерация заднебоковых столбов спинного мозга - фуникулярный миелоз. Дефицит фолиевой кислоты таких сдвигов не вызывает.
Клиническая картина. Внешне больные выглядят бледными с легкой зеленоватой иктеричностью – кожа цвета слоновой кости. Для пожилых больных характерна яркая, серебристая седина. Иктеричность, а нередко и выраженная желтуха обусловлены неконьюгированной гипербилирубинемией, являющейся результатом внутрикостномозгового гемолиза гемоглобинсодержащих эритрокариоцитов (шунт-гемолиз). В период обострения заболевания может повышаться температура тела от субфебрилитета до 38 градусов и выше.
В клинической картине мегалобластной анемии можно выделить три синдрома: анемический, поражения органов пищеварения, расстройств нервной системы.
Анемический синдром при мегалобластной анемии в основных чертах такой же, как и при других вариантах анемий. Проявляется общей слабостью, сердцебиением, одышкой при небольшой физической нагрузке. Возможны жалобы на шум в ушах, головокружение, колющие боли в сердце, пастозность нижних конечностей. Выраженность клинических проявлений анемического синдрома зависит от степени и быстроты развития анемии. Быстрая анемизация нередко приводит к ишемии головного мозга с возникновением коматозного состояния, декомпенсированной недостаточности кровообращения.
Синдром патологии органов пищеварения проявляется ощущениями жжения в языке, потерей вкусовых ощущений, жалобами на слабый аппетит, чувство тяжести, боли в подложечной области, поносы. Типично поражение языка - глоссит Гунтера. Характеризуется появлением вначале ярких воспалительных участков, афтозных высыпаний, трещин на кончике и на боковых поверхностях языка. Затем язык становится гладким, блестящим ("лакированным"), темно-малинового цвета. Дистрофические изменения в слизистой оболочке желудка и кишечника проявляются симптомами атрофического гастрита, энтерита. Печень постоянно умеренно увеличена, безболезненная. Изредка выявляется небольшая спленомегалия. У отдельных больных обнаруживаются выраженная гепатоспленомегалия, симптомы нарушения портальной гемодинамики, другие признаки цирроза печени. В некоторых случаях имеют место диарея, симптомы мальабсорбции, что может являться свидетельством нарушения всасывания витамина В12 в кишечнике.
Синдром неврологических расстройств связан с поражением заднебоковых столбов спинного мозга - фуникулярным миелозом. В некоторых случаях это один из ранних признаков заболевания. Характеризуется парастезиями, нарушениями вибрационной и глубокой чувствительности. Расстройства глубокой чувствительности появляются раньше и более выражены в дистальных отделах нижних конечностей. В связи с расстройствами глубокой чувствительности развивается атаксия. Наблюдаются двигательные расстройства, слабость, парезы нижних конечностей, снижение или исчезновение сухожильных рефлексов. Появляются патологические симптомы Бабинского, Россолимо. Иногда возникают офтальмоплегия, атония мочевого пузыря, ретробульбарные невриты. Очень редко происходят изменения психики с галлюцинациями, маниакальными вспышками, параноидным состоянием, которые быстро исчезают при своевременно начатом лечении.
Диагностика. Общий анализ крови: отмечается нормохромная или гиперхромная анемия, лейкопения, тромбоцитопения. Имеет место резко выраженный макроовалоцитоз, анизоцитоз, пойкилоцитоз. Наряду с эритроцитами неправильной формы (шизоциты) выявляются крупные клетки - мегалоциты. В эритроцитах повышено содержание гемоглобина – гиперхромия (цветной показатель больше 1). Видны внутриклеточные включения – тельца Жоли, кольца Кебота, диффузная полихроматофилия клеток. Выявляются гиперсегментированные нейтрофилы. Количество тромбоцитов умеренно снижено.
Биохимическое исследование крови: определяется повышение содержания в плазме крови билирубина за счет неконьюгированной фракции, небольшое увеличение концентрации сывороточного железа.
Иммунологическое исследование: выявляются антитела класса IgG специфичные против антигенов цитоплазмы париетальных клеток желудка и гастромукопротеина.
Анализ мочи: обнаруживается уробилин (свидетельство внутрикостномозгового шунт-гемолиза эритрокариоцитов)
Копрограмма: у отдельных больных выявляются яйца и фрагменты стробилы широкого лентеца.
Стернальная пункция: обнаруживается мегалобластный тип эритропоэза. Эритроидный росток преобладает (соотношение лейко/эритро становится большим, чем 1/2, тогда как в норме – 3/1-4/1). Видны признаки аномального лейкопоэза – необычно большие гранулоциты разных стадий созревания, гигантские гиперсегментированные нейтрофилы. Уменьшено количество мегакариоцитов. При обработке стернального пунктата ализариновым красным у больных с В12 дефицитной анемией наблюдается окрашивание клеток, тогда как у больных с дефицитом фолиевой кислоты такой окраски не происходит.
По данным лабораторной диагностики желудочной секреции имеет место гистаминоустойчивая ахлоргидрия, с отсутствием секреции гастромукопротеина.
ФГДС: признаки атрофического гастрита. При морфологическом исследовании биоптатов слизистой желудка определяются признаки кишечной метаплазии желудочного эпителия. В некоторых случаях диагностируется клинически латентный рак желудка.
Рентгенологическое исследование: наблюдается сглаженность, уплощение складок слизистой, снижение тонуса, нарушение моторной функции желудка. Возможна диагностика опухолевого поражения органа.
УЗИ: у некоторых больных выявляются признаки цирроза печени, нарушения портальной гемодинамики.
ЭКГ: тахикардия, диффузные изменения (дистрофия) миокарда желудочков.
ЭхоКГ: дилатация полостей желудочков и предсердий, увеличение систолического индекса (при выраженном анемическом синдроме).
Дифференциальный диагноз. Дифференциально-диагностическими критериями В12-дефицитной анемии являются сочетание мегалобластного типа кроветворения по данным стернальной биопсии костного мозга с атрофическим глосситом, атрофическим гастритом, умеренной гипербилирубинемией, нормальным или умеренно повышенным содержанием железа в сыворотке, наличием специфических неврологических расстройств, относительно пожилым возрастом больных.
Для фолиеводефицитной анемии при сходных с обнаруживаемыми у больных с В12-дефицитом морфологических изменениях в костном мозге отсутствует окрашивание мегалобластов ализариновым красным, нет признаков атрофического глоссита, атрофического гастрита, абсолютно не характерны неврологические симптомы фуникулярного миелоза, преобладает молодой возраст больных.
В отличие от микросфероцитарной гемолитической анемии, при которой больные «в большей степени желтушны, чем анемичны» у больных с В12 и/или фолиеводефицитной анемией характерен макроцитоз, гиперхромия эритроцитов, гиперсегментированные нейтрофилы в периферической крови, мегалобластный тип кроветворения по данным стернальной биопсии костного мозга.
Для диагностики и дифференциальной диагностики В12-дефицитной анемии как причины желтухи и гипербилирубинемии у больных с клиническими признаками цирроза печени обязательно следует выполнять стернальную пункцию и морфологический анализ костного мозга.
Наличие морфологических признаков мегалобластного кроветворения в костном мозге обязательно требует детального обследования всеми методами, включая компьютерную рентгеновскую, ЯМР томография, ультразвуковой скрининг с целью выявления или исключения возможного опухолевого поражения внутренних органов.
План обследования.
· Общий анализ крови.
· Общий анализ мочи.
· Биохимическое исследование крови с обязательным определением концентрации билирубина, железа.
· Копрограмма.
· Стернальная пункция и морфологический анализ костного мозга.
· ФГДС.
· Рентгенологическое исследование желудка.
· УЗИ органов брюшной полости (выявление признаков цирроза печени, опухолевого поражения органов пищеварения).
· ЭКГ.
· ЭхоКГ.
· Консультация невропатолога.
Лечение. К лечению В12-дефицитной анемии можно приступать только после верификации диагноза путем морфологического анализа стернальной миелограммы. До стернальной пункции назначать вслепую препараты и коферменты витамина В12категорически нельзя.
Лечение проводят внутримышечными инъекциями цианкобаламина по 400-500 мкг ежедневно в течение 4-6 недель. Свидетельством перехода мегалобластного кроветворения в нормобластное является ретикулоцитарный криз (появление большого количества молодых нормальных эритроцитов в периферической крови), обычно развивающийся через 4-6 дней лечения. На этом фоне препарат продолжают вводить в тех же разовых дозах, но через день, вплоть до развития полной гематологической ремиссии. Закрепляющее лечение можно проводить цианкобаламином по 400-500 мкг внутримышечно 2 раза в неделю или оксикобаламином 1 раз в неделю по 500 мкг внутримышечно в течение 3 месяцев.
Критерием ремиссии является нормализация состава периферической крови, костномозгового кроветворения, уровня витамина В12 в крови и моче. В дальнейшем проводится поддерживающая терапия цианкобаламином по 400 мкг 2 раза в месяц или оксикобаламином по 500 мкг 1 раз в месяц в течение всей жизни больного.
В случаях тяжелой анемии и при явлениях фуникулярного миелоза цианкобаламин вводят в дозе 1000 мкг ежедневно в течение 5-10 дней. Одновременно необходимо вводить кофермент витамина В12 кобамин по 500 мкг 1 раз в день внутримышечно (он помогает быстрее ликвидировать токсическое влияние метилмолоновой кислоты на спинной мозг). В дальнейшем, при улучшении состояния, препараты продолжают вводить 2 раза в неделю до получения стойкой гематологической ремиссии. Консолидация ремиссии и пожизненное поддерживающее лечение проводят по описанной выше методиками препаратами цианкобаламина или оксикобаламина.
При глубокой анемии и угрозе развития анемической комы наряду с введением не менее 1000 мкг цианкобаламина и 500 мкг кобамина в сутки проводят трансфузии эритроцитарной массы, реополиглюкина. В случаях резистентности анемии к лечению витамином В12, при выявлении высоких титров аутоантител к париетальным клеткам желудка и гастромукопротеину применяют глюкокортикоидные гормоны в средних дозах (преднизолон до 40-60 мг в сутки перорально).
Фолиевую кислоту назначают перорально только в случаях доказанной фолиеводефицитной мегалобластной анемии в дозе 5-15 мг в сутки. При витамин В12- дефицитной анемии фолиевую кислоту в лечебную программу не включают. Вместе с тем, таким больным следует назначить диету, включающую продукты и блюда богатые фолиевой кислотой естественного происхождения, исключить прием лекарственных препаратов, обладающих свойствами антагонистов фолиевой кислоты.
Прогноз. Прогноз благоприятный при своевременной диагностике и рано начатом лечении, пожизненной профилактике, и в целом определяется прогнозом заболевания, вызвавшего мегалобластную анемию.
24. Гемолитические анемии
Анемия, при которой процесс разрушения эритроцитов преобладает над процессом регенерации, называется гемолитической.
Естественная гибель эритроцита (эритродиерез) происходит спустя 90-120 дней после его рождения в сосудистых пространствах ретикулогистиоцитарной системы, главным образом в синусоидах селезенки и значительно реже непосредственно в кровеносном русле. При гемолитической анемии наблюдается преждевременное разрушение (гемолиз) эритроцитов. Устойчивость эритроцита к различным воздействиям внутренней среды обусловлена как структурными белками клеточной мембраны (спектрин, анкирин, белок 4,1 и др.), так и ее ферментным составом, кроме того, нормальным гемоглобином и физиологическими свойствами крови и других сред, в которых циркулирует эритроцит. При нарушении свойств эритроцита или изменении среды его пребывания, он преждевременно разрушается в кровеносном русле либо в ретикулогистиоцитарной системе различных органов, прежде всего селезенки.
Гемолитические анемии гетерогенны по своему патогенезу, поэтому установление механизма гемолиза является важной клинической задачей, не всегда легко решаемой.
Классификация.
Обычно выделяют наследственные и приобретенные гемолитические анемии, поскольку они имеют различные механизмы развития и отличаются подходом к лечению. Реже классифицируют гемолитические анемии по наличию или отсутствию иммунопатологии, различая аутоиммунные и неиммунные гемолитические анемии, к которым относятся врожденные гемолитические анемии, приобретенные гемолитические анемии у больных циррозом печени, а также при наличии протезов сердечных клапанов и так называемая маршевая гемоглобинурия.
Гемолитическим анемиям присущ ряд признаков, которые выделяют их из анемий другого происхождения. Прежде всего, это гиперрегенераторные анемии, протекающие с гемолитической желтухой и спленомегалией. Высокий ретикулоцитоз при гемолитическим анемиям обусловлен тем, что при распаде эритроцитов образуются все необходимые элементы для построения нового эритроцита и, как правило, отсутствует де фицит эритропоэтина, витамина В12, фолиевой кислоты и железа. Разрушение эритроцитов сопровождается увеличением содержания в крови свободного билирубина; когда его уровень превышает 25 мкмоль/л, появляется истеричность склер и кожных покровов. Увеличение селезенки (спленомегалия) - результат гиперплазии ее ретикулогистиоцитарной ткани, обусловленной повышенным гемолизом эритроцитов. Общепринятой классификации гемолитических анемий нет.
План обследования больного при подозрении на гемолитическую анемию.
План обследования больного можно условно разделить на два этапа:
1. общие для всех гемолитических анемий лабораторно-инструментальные исследования
2. специфические исследования.
Первый этап:
1. Общий анализ крови с определением количества ретикулоцитов и морфологическим исследованием эритроцитов.
2. Биохимический анализ крови на содержание билирубина и его фракций, сывороточного железа.
3. Ультразвуковое исследование селезенки и печени.
4. Исследование ОРЭ.
5. Общий анализ мочи.
Наличие регенераторной анемии с повышенным уровнем свободного билирубина и сывороточного железа, а также морфологических изменений эритроцитов, спленомегалии и ОРЭ подтверждает гемолитическую анемию. Кроме того, результаты исследования на первом этапе позволяют наметить направление дальнейших исследований на втором этапе:
1. Общий анализ крови, морфология эритроцитов, биохимический анализ крови у родственников (в случае обнаружения изменений морфологии эритроцитов и раннего развития анемии у пациента; наличия у него в анамнезе или у его родственников желчнокаменной болезни, особенно развившейся в молодом возрасте).
2. Пробы на серповидность эритроцитов, электрофорез гемоглобина (если анемия выявлена у пациента с черной кожей или если гемолитическая анемия проявляется клиническими признаками внутрисосудистого гемолиза).
3. Исследуют ферменты эритроцитов (если анемия несфероцитарная и появляется после употребления лекарств, конских бобов).
4. Пробы Хема, Гартмана, исследование мочи на гемосидерин, гемоглобин и железо (когда у больного наблюдается ночной или пароксизмальная гемоглобинурия, черная или темно-коричневая моча после сна, на фоне инфекций, третичного сифилиса, а в моче обнаруживают эритроциты, протеинурию).
5. Определение антител с помощью пробы Кумбса, полимеразной цепной реакции, ИФА или радиоиммунного анализа (при нормоцитарной гемолитической анемией, наличии признаков внесосудистого гемолиза, спленомегалии, развитии анемии у женщин).
6. Исследуют холодовые антитела при помощи холодовых проб (при наличии Холодовых провоцирующих факторов, признаков внесосудистого гемолиза).
7. Электрофорез гемоглобина (при обнаружении мишеневидных эритроцитов у больных определенных этнических групп, а также спленомегалии).
8. Исследуют сыворотку крови на наличие свинца при профессиональной или бытовой интоксикации; уровень сывороточного железа, сидеробласты костного мозга - при симптомах железодефицитной анемии; эритроциты - на плазмодии малярии (при наличии клинических признаков).
9. Исследуют биохимические показатели наличия ДВС-синдрома (при обнаружении большого количества фрагментированных эритроцитов в мазке крови).
25. Хронический лейкоз
Хронические лейкозы – это такие формы лейкозов, при которых морфологическим субстратом опухолевых (лейкозных) разрастании являются более зрелые, чем бластные, клетки крови, достигшие определенного уровня дифференцировки. Все ХЛ характеризуются длительным течением доброкачественной стадии и коротким терминальной (злокачественной). Среди ХЛ выделяют миелопролиферативные и лимфопролиферативные заболевания.
К хроническим миелопролиферативным процессам относятся хронический миелолейкоз, эритремия, алейкемический миелоз. При этих заболеваниях наблюдается мутация на уровне полипотентной стволовой клетки, далее продуцирующийся на классе олигопотентных стволовых клеток, которые дают начало трем линиям миелоидного кроветворения: эритроцитарного, гранулоцитарного и мегакариоцитарного.
Острые осложнения СД
Острые осложнения рассматриваемого заболевания представляют собой наибольшую опасность и угрозу для жизни диабетика, так как именно они способны привести к гибели больного.
К острым осложнениям относят:
· Кетоацидоз. Развивается из-за накопления продуктов метаболизма в крови. К основным симптомам причисляют: потерю сознания, функциональной нарушение работы различных внутренних систем и органов. Кетоацидозу наиболее подвержены люди, страдающие от СД 1 типа.
· Гипогликемию. Может развиваться по причине резкого снижения уровня глюкозы в плазме. Симптоматика: отсутствие должной реакции зрачков на свет, потеря сознания, резкое увеличение количества сахара в плазме в кратчайшие сроки, судороги, чрезмерное потоотделение, в некоторых случаях — кома. Гипогликемия может развиться у диабетиков, больных не только 1, но и 2 типом СД.
· Гиперосмолярную кому. Появляется при повышенном содержании в крови глюкозы, а также натрия. Ее развитие сопровождается длительным обезвоживанием организма. К основным симптомам можно отнести полидипсию и полиурию. Развитию этого осложнения наиболее подвержены пожилые люди, больные сахарным диабетом 2 типа.
· Лактацидотическую кому. В основе развития стоит избыточное накопление в крови молочной кислоты. Ее основными симптомами выступают: помрачение сознания, резкие скачки артериального давления, нарушение дыхания, затрудненное мочевыделение. Данное осложнение в большинстве случаев появляется у диабетиков зрелого возраста (50 лет и старше).
Стоит отметить тот факт, что острые осложнения сахарного диабета у детей и у взрослых идентичны, поэтому важно внимательно наблюдать за состоянием здоровья и проявляющейся специфической симптоматикой у диабетика любой возрастной категории. Каждое из вышеперечисленных осложнений способно развиться очень быстро, в некоторых случаях за несколько часов. При резком ухудшении самочувствия и появлении любого из вышеперечисленных признаков осложнений сахарного диабета, необходимо незамедлительно обращаться за квалифицированной медицинской помощью.
Хронические осложнения СД
Хронические осложнения при сахарном диабете обусловлены длительным течением заболевания. Даже при должном соблюдении всех необходимых лечебных мероприятий сахарный диабет серьезным образом усугубляет состояние здоровья каждого больного. Так как это заболевание на протяжении длительного периода способно изменить состав крови в патологическую сторону, можно ожидать появление различных хронических осложнений, поражающих любые внутренние органы и системы человека.
Наиболее часто при хронических осложнениях страдают:
· Сосуды. Их просвет при длительном СД может существенно сужаться, а их стенки истончаются и становятся менее проницаемыми для всех, поступающих в организм, полезных веществ. Это способно спровоцировать развитие различных серьезных патологий сердца.
· Почки. При длительном течении заболевания в большинстве случаев развивается почечная недостаточность.
· Кожа. СД способен пагубно влиять и на кожный покров человека. Так как при этом заболевании значительно уменьшается кровоснабжение в тканях кожи, на ней могут появляться трофические язвы, которые зачастую становятся основным источником различных инфекций и поражений.
· Нервная система. При сахарном диабете подвергается значительным изменениям и нервная система. В первую очередь подобные изменения находят свое отражение в появлении синдрома нечувствительности конечностей. Больной начинает испытывать постоянную слабость в конечностях, сопровождающуюся сильной и продолжительной болью. В некоторых, наиболее сложных, случаях изменения в нервной системе способны спровоцировать развитие паралича.
Поздние осложнения СД
Поздние осложнения сахарного диабета, как правило, развиваются медленно, в течение нескольких лет прогрессирования этого заболевания. Опасность таких осложнений заключается в том, что они постепенно, но весьма серьезно ухудшают общее состояние здоровья диабетика. Специалисты медицины утверждают, что даже при грамотном и регулярном осуществлении всех предусмотренных лечебных мер уберечься от развития подобных осложнений крайне сложно.
К поздним осложнениям относят:
· Ретинопатию. Характеризуется поражением сетчатки глаза, которое способно спровоцировать не только ее отслоение, но и кровоизлияние в глазном дне. Данное заболевание может привести к полной утери зрительной функции. Ретинопатия часто встречается у диабетиков «со стажем», страдающих заболеванием любого типа, однако, наиболее часто она развивается у людей с СД 2 типа.
· Ангиопатию. Является нарушением проницаемости сосудов. Способна провоцировать появление тромбоза и атеросклероза. Ангиопатия развивается очень быстро, в некоторых случаях менее чем за год. Данной патологии могут быть подвержены больные 1 и 2 типом СД.
· Полинейропатию. При данной болезни человек теряет чувствительность к боли и тепло в нижних и верхних конечностях. К симптомам можно отнести чувства жжения и онемения в руках и ногах. Эта патология может появиться у любого диабетика.
· Диабетическую стопу. Поражение ног, при котором на стопах появляются язвы и нарывы. В большинстве случаев эта патология приводит к хирургическому вмешательству, в том числе, и к ампутации пораженной конечности.
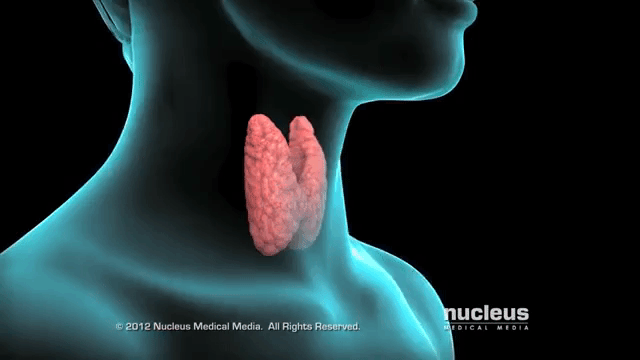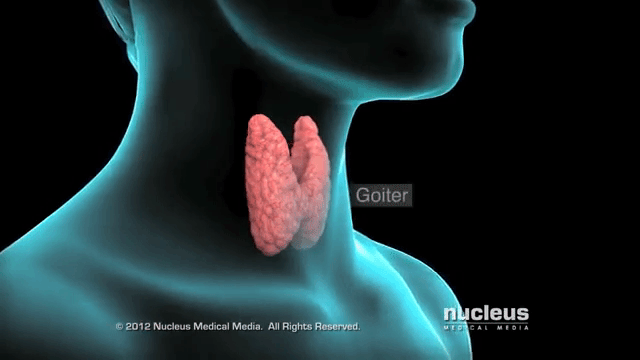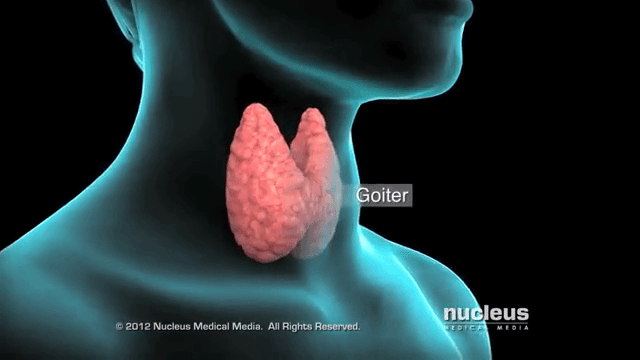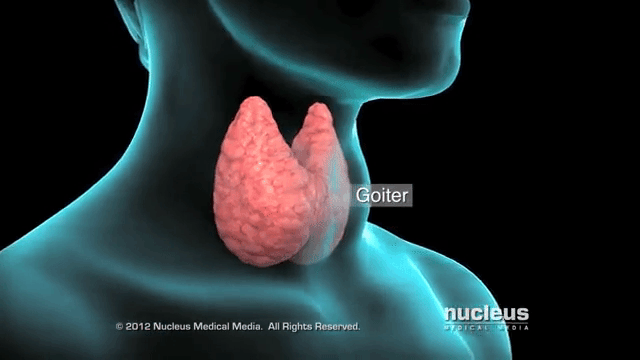
28. Эутиреоидный (нетоксический) зоб
Нетоксический зоб – это разрастание тканей щитовидной железы из-за нехватки йода, при этом функции органа сохраняются. Особенно неприятные последствия при беременности, ведь не только у женщины ухудшается самочувствие, возможно развитие кретинизма у ребенка.
Зоб означает увеличение щитовидной железы в размерах. Его эндокринолог определяет на основании пальпации (прощупывания) органа, иногда изменение переднего контура шеи видно и при внешнем осмотре. Точно подтвердить степень разрастания тканей помогает УЗИ. Нетоксическим считается зоб при нормальной функции щитовидной железы – эутиреозе. При этом обязательными условиями является отсутствие воспаления и опухолевого процесса.
Наиболее распространенная причина болезни – это дефицит йода. Он обычно возникает при длительном проживании в местностях, удаленных от морского побережья. Проведенными исследованиями доказано, что это не единственный фактор зобообразования. Обнаружены бактерии, которые тормозят усвоение микроэлемента, его встраивание в гормоны щитовидки. При этом важно, что коррекцией питания их действие не нейтрализуется.
Йододефициту также способствуют:
·недостаток витамина А, молибдена, меди, цинка и кобальта, избыток кальция в воде, продуктах питания;
·преобладание в рационе всех видов капусты, кукурузы, сои;
·высокая потребность в поступлении йода (подростковый период, беременность, кормление грудью, после наступления климакса).
 Рекомендуем прочитать статью об узловом зобе щитовидной железы. Из нее вы узнаете о причинах формирования узлового зоба щитовидной железы, чем опасен, классификации, видах и степенях, а также о методах диагностики и лечения узлового зоба щитовидной железы.
Рекомендуем прочитать статью об узловом зобе щитовидной железы. Из нее вы узнаете о причинах формирования узлового зоба щитовидной железы, чем опасен, классификации, видах и степенях, а также о методах диагностики и лечения узлового зоба щитовидной железы.
А здесь подробнее об эндемическом зобе.
Эутиреоз у больных
Эутиреоидное состояние означает, что железа вырабатывает то количество гормонов, в котором имеется потребность организма. При этом у пациентов нет симптомов усталости, изменения веса при стандартном рационе, отклонений в работе сердца, нервной системы.
Увеличение щитовидки (эутиреоидный зоб) возникает как ответная реакция на нехватку йода. Основными фазами такого процесса являются:
·снижение в клетке уровня жиров, соединенных с йодом (в норме они тормозят вещества, стимулирующие рост щитовидки);
·ростовые факторы способствуют ускоренному делению клеток, увеличивается объем функционирующей ткани (гиперплазия);
·в ответ на нехватку йода образуется больше трийодтиронина (в нем на 1 молекулу йода меньше, чем в тироксине), что позволяет экономно расходовать дефицитный микроэлемент;
·относительное снижение концентрации тироксина;
·по принципу обратной связи увеличивается образование гипофизом тиреотропного гормона, стимулирующего щитовидку;
·клетки под действием тиреотропина увеличивают свой объем (гипертрофия).
 Диффузный эутиреоидный зоб
Диффузный эутиреоидный зоб
Виды образования щитовидной железы
Нетоксический зоб протекает в нескольких вариантах. Они в некоторых случаях сочетаются между собой.
Диффузный
Если у пациента выявлено равномерное увеличение органа из-за большого числа клеток и размера каждой из них, то зоб называется диффузным. Процесс разрастания ткани и укрупнения клеток охватывает весь орган, при ультразвуковом исследовании узлы не обнаруживают. Как правило, в такой форме протекает эндемический зоб в регионах с йодным дефицитом. Нехватка йода обычно слабая или умеренная. Болеют чаще дети, молодые женщины, подростки.
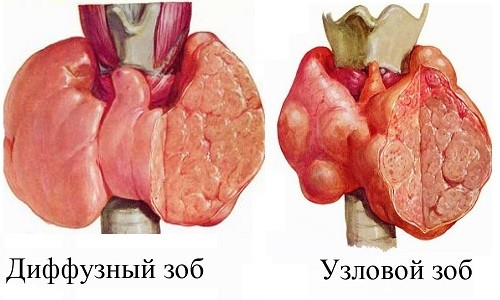
Узловой, одноузловой
Если при йодном дефиците на пациента воздействуют и дополнительные факторы (курение, инфекции, медикаменты, частые ангины), то часть клеток железы начинает ускоренно делиться. Такое очаговое скопление (узел) имеет четкую плотную капсулу, при размере более 1-1,5 см прощупывается в виде локального уплотнения. Менее крупный узел можно увидеть только на УЗИ.
Узловой зоб часто обнаруживают у женщин после наступления климакса, нередко он сочетается с миомой матки.
У пожилых пациентов подобное состояние бывает признаком возрастных изменений гормонального фона организма.
Коллоидный
Дефицит йода способствует усиленному образованию щитовидной железой коллоидного вещества. Оно является «хранилищем» тиреоглобулина, используемого для дальнейшего синтеза тироксина и трийодтиронина. Фолликулы переполняются коллоидом, что и вызывает увеличение размеров органа. Коллоидный зоб еще называют простым, так как сама структура железы не меняется, ее функция может долгое время быть нормальной.
Полинодозный
Нодус в переводе означает узел. Полинодозным (многоузловым) считается зоб, если в ткани железы обнаружено несколько очагов разрастания (больше одного). Его образование вызвано тем, что клетки (тироциты) имеют неодинаковую способность реагировать на факторы роста и тиреотропин гипофиза. Часть из них способна делиться и увеличиваться быстрее других, что и провоцирует формирование множества узлов.
Частота обнаружения болезни выше у пациентов зрелого и пожилого возраста, женщины страдают многоузловым зобом чаще мужчин.
Симптомы появления
При небольшом увеличении и маленьком узле нетоксический зоб протекает бессимптомно. Если ткани железы увеличиваются быстро, то возникает болезненность в области шеи. Чаще всего это дискомфортные ощущения при повороте, наклоне головы. Крупная железа становится заметной, ее можно определить по симметричному или одностороннему изменению контуров шеи. Когда зоб начинает сдавливать соседние ткани, у больного возникают такие проявления:
·затруднения при глотании,
·ком в горле,
·хриплый, сиплый голос,
·постоянное покашливание.
При нарастании механического давления на ткани, а особенно при загрудинном расположении железы, появляются:
·приступы удушья;
·одышка в состоянии покоя;
·шум в голове, головокружение;
·нарушение оттока крови из тканей головного мозга с упорными головными болями, отечностью лица;
·обморочные состояния.
Диагностика больного
Если эндокринолог при осмотре обнаружил увеличение железы, то для постановки окончательного диагноза назначается обследование:
·УЗИ – объем ткани превышает возрастную норму, имеются диффузные (распространенные) изменения, узел или несколько;
·тиреотропный гормон в крови – если он в норме, то исследования тироксина не требуется, а у больного имеется эутиреоз. При отклонениях нужно исключить бессимптомные формы низкой или высокой функции;
·антитела к тиреопероксидазе исследуют при признаках неоднородной структуры на УЗИ, потому что это может быть симптомом аутоиммунного тиреоидита (воспаления с образованием антител к своим клеткам).
УЗИ щитовидной железы
При наличии загрудинного зоба необходимо дополнить диагностику сцинтиграфией (сканирование после введения радиоактивного изотопа) и рентгенографией грудной клетки с контрастированием барием пищевода.
Одиночный крупный узел с низкой плотностью (гипоэхогенный на УЗИ) может быть подозрителен в отношении опухоли, поэтому при сомнениях назначают его тонкоигольную биопсию (взятие клеток на исследование).
Критериями постановки диагноза нетоксического зоба являются:
·увеличение объема при УЗИ (диффузная форма);
·обнаружен 1 узел (узловой зоб), несколько (многоузловой);
·норма тиреотропина (по анализу крови);
·исключена доброкачественная, злокачественная опухоль при биопсии узла.
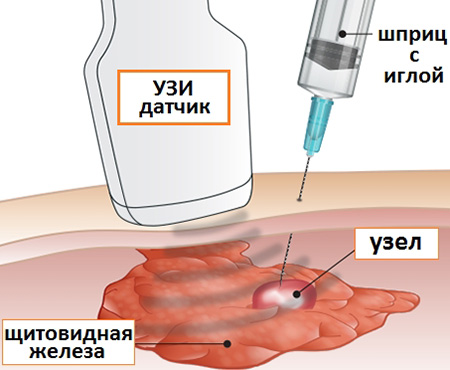 Биопсия щитовидной железы
Биопсия щитовидной железы
Медикаментозная терапия
Для детей, подростков, при незначительном разрастании ткани применяют йод для восстановления размеров щитовидной железы. Такая методика дает медленный, но стабильный результат.
Вторым вариантом является применение левотироксина (Эутирокса). Он позволяет быстро уменьшить объем железы, но после прекращения приема возникает синдром отмены. Чаще всего такая терапия проходит в два этапа. В первые 6 месяцев стремятся уменьшить размеры щитовидки за счет того, что снижается стимулирующее влияние на нее гормона гипофиза – тиреотропина.
После того, как нормализован объем ткани, применяется йод в профилактической дозировке. Эта схема показана молодым пациентам.
После 40 лет использование левотироксина повышает риск болезней сердца, снижения плотности костной ткани (остеопороза и переломов). При значительном размере зоба и противопоказаниях к оперативному лечению больному назначают радиоактивный йод.
Одним из альтернативных способов является местная инъекция этилового спирта для замещения узла рубцовой тканью. Такая процедура болезненная и ее нужно повторять, при большом очаге может быть неэффективной.
Таблица 1.Клинические проявления кровотечений из желудочно-кишечного тракта.
| Проявление | Возможный источник |
| Рвота неизмененной кровью со сгустками | Разрыв варикозно-расширенных вен пищевода, массивное кровотечение из язвы желудка; синдром Маллори - Вейсса |
| Рвота «кофейной гущей» | Кровотечение из язвы желудка или двенадцатиперстной кишки, другие причины кровотечения в желудке |
| Дегтеобразный стул (мелена) | Источник кровотечения, скорее всего, в пищеводе, желудке или двенадцатиперстной кишке, источник кровотечения может находиться в слепой или восходящей ободочной кишке |
| Темно-красная кровь, равномерно перемешанная с калом | Источник кровотечения, скорее всего, находится в слепой или восходящей ободочной кишке |
| Прожилки или сгустки крови в кале обычного цвета | Источник кровотечения в нисходящей ободочной, сигмовидной или прямой кишке |
| Алая кровь выделяется в виде капель в конце дефекации | Геморроидальное кровотечение, реже кровотечение из анальной трещины |
Когда возникает вопрос о локализации ЖКК, прежде всего рекомендуют ввести больному зонд в желудок. Аспирированная через зонд кровь подтверждает локализацию источника в верхних отделах. Наряду с этим, отрицательный результат аспирации не всегда свидетельствует об отсутствии кровотечения в верхних отделах пищеварительного тракта. Кровотечение из луковичной язвы может не сопровождаться появлением крови в желудке. В таких случаях о высокой локализации источника можно судить по другим признакам: наличию гиперреактивных кишечных шумов и повышению азотистых соединений в крови (прежде всего креатинина и мочевины). Тем не менее, диагностика ЖКК нередко бывает весьма сложной, особенно в первые часы от начала заболевания, когда больной уже находится в тяжелом состоянии, а кровавой рвоты нет и дегтеобразного стула ещё не появилось. Если наличие и локализация источника кровотечения остаются неясными – вопрос решает эндоскопическое исследование.
Таблица 2. Диагностическое значение болевого синдрома при кровотечениях из нижних отделов ЖКТ(А.А.Шептулин,2000)
Характер болей Возможные причины
Боли предшествуют кишечным Острые или хронические
кровотечениям воспалительные заболевания
кишечника
Внезапные боли с последующим Разрыв аневризмы аорты в
профузным кровотечением просвет тонкой кишки
Боли в области заднего прохода, Геморрой, анальная трещина
возникающие во время
дефекации или после неё
Безболевое кишечное кровотечение Телеангиоэктазии слизистой
оболочки кишечника
Пальпация брюшной полости и пальцевое исследование заднего прохода являются обязательными у всех больных, помогая пальпаторно обнаружить новообразование слепой кишки, а при ректальном исследовании нащупать низкорасположенную опухоль прямой кишки, геморроидальные узлы или анальную трещину. Пальцевое ректальное исследование по статистике позволяет выявить до 30% всех опухолей толстой кишки, в том числе и осложненных кровотечением. Следующим этапом диагностики является аноскопия и ректосигмоскопия, эффективность которых при онкологических заболеваниях толстой кишки составляет 60%. Процедура затруднена при сильном кровотечении, когда бывает трудно определить, поступает ли кровь сверху или забрасывается снизу (например при геморрое). При наличии дегтеобразного стула, который может быть следствием как гастродуоденальных кровотечений, так и кровотечений из подвздошной кишки и правых отделов толстого кишечника, рекомендуется произвести назогастральную аспирацию через зонд и выполнить ЭГДСдля исключения патологии желудка и двенадцатиперстной кишки. Колоноскопия является самым информативным методом диагностики при толстокишечной патологии, однако при интенсивном кровотечении её выполнить бывает довольно трудно. Если кровотечение останавливается хотя бы на время, то с помощью этой процедуры может быть диагностирована самая разнообразная патология, в т.ч. и сосудистая.
Мезентериальная артериография у больных с кишечным кровотечением позволяет выявить экстравазацию контраста и определить сторону и ориентировочную локализацию источника. Ангиография – это в настоящее время единственный метод, позволяющий диагностировать кровотечение в тонкой кишке и ввести вазопрессин прямо в кровоточащую артерию. Экстравазация определяется только при достаточно массивных кровотечениях, но и при отсутствии её признаков артериография может обнаружить патологию сосудов, являющуюся причиной кровотечения. Сцинтиграфия с эритроцитами, мечен-ными технецием-99 (99тТс) или тромбоцитами, меченными радиоактивным индием (In), является более чувствительным методом и позволяет выявить источник кровотечения даже при относительно небольшой его интенсивности, но требует много времени и вряд ли может расцениваться как метод экстренной диагностики. Контрастные методы рентгенологического исследования (ирригоскопия и ирригография) не в состоянии выявить источник кровотечения, но могут помочь в диагностике опухоли, дивертикулеза, инвагинации и других заболеваний, осложняющихся кровотечением.
Основные причины кровотечений из нижних отделов ЖКТ и их специфическая терапия. По разнообразию причин кровотечения из нижних отделов пищеварительного тракта не уступают гастродуоденальным.
О  дной из самых частых причин гематохезии у пожилых больных являетсядивертикулез толстой кишки. Частота этой патологии увеличивается с возрастом и у лиц старше 70 лет дивертикулы обнаруживают при колоноскопии в 10 –15% случаев (у каждого 10 пациента). Образованию дивертикулов способствует малоподвижный образ жизни, нарушения функции толстой кишки (склонность к запорам), дисбактериоз кишечника. По данным разных авторов кровотечения, нередко массивные, осложняют течение дивертикулеза в 10 – 30% случаев. Дело в том, что выпячивания, как правило, возникают в слабых местах кишечной стенки, нередко там, где проходит перфорирующая стенку артерия, и её аррозия под влиянием часто развивающегося в просвете дивертикула воспаления приводит к кровотечению. Считается, что дивертикулы чаще локализуются в нисходящей и сигмовидной кишке, однако они могут наблюдаться и в поперечно-ободочной кишке, и в правой половине толстой кишки. Кровотечению при дивертикулезе могут предшествовать боли в животе, но часто оно имеет внезапное начало и болями не сопровождается. Истечение крови может остановиться самостоятельно и рецидивировать спустя несколько часов или суток. Наряду с этим почти в половине случаев кровотечение бывает однократным.
дной из самых частых причин гематохезии у пожилых больных являетсядивертикулез толстой кишки. Частота этой патологии увеличивается с возрастом и у лиц старше 70 лет дивертикулы обнаруживают при колоноскопии в 10 –15% случаев (у каждого 10 пациента). Образованию дивертикулов способствует малоподвижный образ жизни, нарушения функции толстой кишки (склонность к запорам), дисбактериоз кишечника. По данным разных авторов кровотечения, нередко массивные, осложняют течение дивертикулеза в 10 – 30% случаев. Дело в том, что выпячивания, как правило, возникают в слабых местах кишечной стенки, нередко там, где проходит перфорирующая стенку артерия, и её аррозия под влиянием часто развивающегося в просвете дивертикула воспаления приводит к кровотечению. Считается, что дивертикулы чаще локализуются в нисходящей и сигмовидной кишке, однако они могут наблюдаться и в поперечно-ободочной кишке, и в правой половине толстой кишки. Кровотечению при дивертикулезе могут предшествовать боли в животе, но часто оно имеет внезапное начало и болями не сопровождается. Истечение крови может остановиться самостоятельно и рецидивировать спустя несколько часов или суток. Наряду с этим почти в половине случаев кровотечение бывает однократным.
Консервативная терапия (переливание свежей крови, тромбоцитарной массы, введение эпсилон-аминокапроновой кислоты, децинона), а так же введение вазопрессина в мезентериальную артерию во время ангиографии оказывается эффективным у большинства больных. В некоторых клиниках после ангиографии применяют чрескатетерную эмболизацию (А.Шептулин,2000). Если при колоноскопии удается обнаружить источник, что бывает довольно редко, тогда можно расчитывать и на эффект местных гемостатических мероприятий (электрокоагуляция, орошение капрофером). При продолжающемся или рецидивирующем кровотечении приходится прибегать к хирургическому вмешательству- резекции толстой кишки, объем которой тем меньше, чем точнее топическая диагностика.
Кровотечение при полипах толстой кишки может изредка возникать при самопроизвольном отрыве ножки полипа или значительно чаще при воспалении и изъязвлении его поверхности. Массивное кровотечение из распадающейся злокачественной опухоли толстой кишки встречается очень редко. Чаще отмечаются хронические перемежающиеся кровотечения в виде небольших “плевков” крови, иногда в смеси со слизью, или, при высоком расположении опухоли, с изменением цвета и консистенции каловых масс.
Кровотечения умеренной или малой интенсивности могут возникать при неспецифических колитах (неспецифический язвенный колит и болезнь Крона), при туберкулезе кишечника и острых инфекционных колитах. Для этих заболеваний характерны боли в животе, предшествующие появлению крови, как правило смешанной со слизью. Хронические заболевания кишечника (НЯК, болезнь Крона) часто сопровождаются длительной лихорадкой, похуданием, артритом, узловатой эритемой, иридоциклитом. Для инфекционных колитов более характерно острое начало, высокая температура, диарея, тенезмы. В диагностике и дифференциальной диагностике колитических кровотечений важную роль играет колоноскопия, позволяющая выявить различия в эндоскопических проявлениях отдельных заболеваний (множественные изъязвления и псевдополипы между ними при неспецифическом язвенном колите, мелкобугристая слизистая типа «булыжной мостовой» и глубокие трещины на слизистой при болезни Крона, наложения на слизистой при псевдомембранозном инфекционном колите). Уточнить диагноз помогает морфологическое исследование биоптатов кишечной стенки, позволяющее обнаружить саркоидоподобные эпителиоидно-клеточные гранулемы без признаков казеоза при болезни Крона, эпителиоидные гранулемы с гигантскими многоядерными клетками Пирогова-Лангганса при туберкулезном колите.2
Эмболия и тромбоз мезентериальных сосудов при атеросклеротическом их поражении у стариков, эндартериитах и системных васкулитах у более молодых пациентов, эмболия из полостей сердца (при инфаркте миокарда, пороках сердца) или из аорты (при её атеросклеротическом поражении) могут явиться причинами острых нарушений мезентериального кроообращения и развития ишемических поражений и геморрагического инфаркта кишечника, проявляющихся выделением довольно большого количества измененой крови. Для таких кровотечений характерно наличие предшествующего им выраженного болевого симптома, тошноты, рвоты, иногда коллаптоидного состояния, а по мере прогрессирования болезни – нарастания симптомов интоксикации и появления перитонеальных явлений.
При колоноскопии у больных с геморрагическим инфарктом толстой кишки в зависимости от стадии заболевания находят обширные участки отечной, цианотичной или пропитанной кровью слизистой, с повышенной кровоточивостью, множественные подслизистые кровоизлияния, локализация и протяженность которых определяется уровнем сосудистой окклюзии. Позднее появляются поверхностные кровоточащие изъязвления и могут возникать участки некроза с последующим распадом тканей и перфорацией. При высокой окклюзии верхней брыжеечной артерии может наблюдаться инфаркт и некроз всего тонкого кишечника и правой половины толстой кишки, а при тромбозах нижней брыжеечной артерии в связи с наличием мощных сосудистых коллатералей инфарцирование обычно ограничивается сигмовидной кишкой.
В сложных диагностических ситуациях весьма полезна ангиография, с помощью которой можно точно установить характер нарушения кровотока, локализацию и протяженность окклюзии, а так же наличие коллатералей. При подозрении на инфаркт кишечника важную диагностическую информацию можно получить при лапароскопии.
Лечение больных с кишечным кровотечением на фоне острых нарушений мезентериального кровообращения, как правило, оперативное (Таблица 3). Поскольку кровь в просвете кишки обычно появляется на стадии инфаркта кишечника, что свидетельствует о декомпенсации мезентериального кровообращения, выполняют резекцию необратимо измененных участков кишки, которую дополняют вмешательством на брыжеечных сосудах с целью восстановления кровообращения жизнеспособных остающихся отделов (В.С.Савельев и И.В.Спиридонов, 1986).
Таблица 3. Лечение больных с острыми нарушениями мезентериального кровообращения.
| Формы течения и стадии заболевания | Лечение |
| При компенсации мезентериального кровообращения | Консервативное (спазмолитики, антикоагулянты и т.д.) |
| При субкомпенсации мезентериального кровообращения | Консервативное. В последующем консервативное или оперативное в зависимости от клинической формы |
| При декомпенсации мезентериального кровообращения: | Только оперативное |
| - в стадии ишемии | Сосудистые операции |
| - в стадии инфаркта | Сосудистые операции + резекция кишечника. Резекция кишечника. Профилактика перитонита |
| - в стадии перитонита | Сосудистые операции + резекция кишечника. Резекция кишечника. Лечение перитонита |
Довольно редкой причиной кишечных кровотечений является геморрагический ангиоматоз толстой и тонкой кишки, являющийся проявлением ангиодисплазии, известной под названием болезни (синдрома) Рандю-Ослера-Вебера. В основе этого заболевания лежит врожденное расширение мелких сосудов кожи и слизистых оболочек в виде гемангиоэктазий и ангиом. Наиболее типичным местом их локализации являются губ  ы, язык, десны, слизистая оболочка носа. Ангиомы могут так же находиться на всем протяжении ЖКТ, в том числе в тонкой и толстой кишке. Заболевание носит семейно-наследственный характер и наследуется по аутосомно-доминантному типу, поэтому его признаки можно при расспросе обнаружить у родственников больного. Диагностику облегчает современная видеоколоноскопия с высоким разрешением, позволяющая обнаружить даже мелкие изменения сосудистого рисунка слизистой.
ы, язык, десны, слизистая оболочка носа. Ангиомы могут так же находиться на всем протяжении ЖКТ, в том числе в тонкой и толстой кишке. Заболевание носит семейно-наследственный характер и наследуется по аутосомно-доминантному типу, поэтому его признаки можно при расспросе обнаружить у родственников больного. Диагностику облегчает современная видеоколоноскопия с высоким разрешением, позволяющая обнаружить даже мелкие изменения сосудистого рисунка слизистой.
Капиллярные и кавернозные гемангиомы и ангиодисплазии тонкой и толстой кишки (артериовенозные мальформации), по данным А.А.Шептулина (2000), являются причиной массивных кишечных кровотечений в 30% случаев. Ведущим клиническим проявлением заболевания являются кровотечения из прямой кишки во время дефекации и вне зависимости от неё. При кавернозных гемангиомах могут наблюдаться массивные кровотечения, сопровождающиеся коллапсом. Изредка отмечаются боли в нижних отделах живота, усиливающиеся перед кровотечением. Для ангиом прямой кишки характерны ложные позывы на дефекацию, чувство неполного опорожнения, временами возникают запоры. Дифференциальная диагностика с другими причинами гематохезии, особенно с кровоточащими неспецифическими колитами, туберкулезом кишечника, геморрооем, бывает очень непростой. Нередко больных длительно и безуспешно лечат от этих заболеваний, а иногда и подвергают неадекватным оперативным вмешательствам.
Основную роль в диагностике гемангиом толстой кишки играют ректосигмоскопия и колоноскопия. При эндоскопическом исследовании выявляют синюшно-багровый цвет слизстой кишки на ограниченном участке, отсутствие типичной складчастости, расширенные, извитые, выбухающие сосуды, образующие неправильной формы сплетения, четко отграниченные от неизмененных участков слизистой. Биопсия таких образований может привести к массивному кровотечению, остановить которое бывает очень трудно. Основным и наиболее радикальным методом лечения гемангиом кишечника является хирургическая операция, хотя, по мнению В.Д.Федорова, лечебная тактика требует дифференциального подхода. При развитии массивного кровотечения из низкорасположенных гемангиом М.Н.Аничкин с соавт.(1981) производил эмболизацию и перевязку верхней прямокишечной артерии, что эффективно приводило к остановке кровотечения, хотя и временной. При незначительном и периодически повторяющемся кровотечении, не сказывающемся на общем состоянии больного, допустима выжидательная тактика. После прекращения выделения крови небольшие ангиомы дистальных отделов толстой кишки могут быть удалены методом электроэксцизии или подвергнуты склеротерапии.
Самой частой причиной ректального кровотечения является геморрой, весьма распространенное заболевание, которое встречается почти с одинаковой частотой у мужчин и у женщин. Геморроем страдает более 10% взрослого населения и выделение свежей крови из прямой кишки - один из основных его симптомов. Алая кровь при геморрое обычно становится заметной в конце акта дефекации в виде капель, попадающих на стенки унитаза или следов на туалетной бумаге. Она, как правило, не смешивается с калом, который сохраняет свой обычный цвет. Кровотечение может сопровождаться болями и чувством жжения в заднем проходе, усиливающимися во время дефекации и после неё. Нередко геморроидальные узлы выпадают наружу при натуживании. Описаны и массивные геморроидальные кровотечения, требующие активной гемостатической терапии. При повторных кровотечениях рекомендуют назначать гливенол внутрь (по 1 капсуле 4 раза в день) и свечи с тромбином или с адреналином. Возможно применение инъекций склерозирующих препаратов. Радикальным методом лечения являются различные виды геморроидэктомии. Сходную клиническую картину имеет трещина заднего прохода, которая так же может сопровождаться небольшими выделениями свежей крови. Для дифференциальной диагностики с геморроидальным кровотечением, как правило, бывает достаточно пальцевого ректального исследования и аноскопии.
Значительные кровотечения в детском возрасте могут быть вызваны изъязвлениями слизистой оболочки дивертикула Меккеля. Клиническая картина меккелевого дивертикулита очень похожа на проявления острого аппендицита и диагноз у большинства больных устанавливается во время аппендэктомии. У детей первых двух лет жизни выделение порции крови со слизью (имеющей вид малинового желе) из заднего прохода в сочетании с беспокойством и криком ребенка является основным симптомом инвагинации толстой кишки – острого заболевания, весьма частого в этом возрасте. Для его диагностики, а иногда и лечения применяют воздушную ирригоскопию (дозированное введение воздуха в толстую кишку под контролем рентгеновского экрана).
У части больных с кровотечением из нижних отделов ЖКТ, поступающих в хирургический стационар, уточнить причину геморрагии не удается, несмотря на проведение комплексного инструментального обследования. В это число входит и большинство больных с источниками кровотечения в тонком кишечнике, диагноз у которых нередко устанавливают лишь методом исключения или во время лапаротомии.
35. Острые аллергические заболевания
Аллергия – иммунная реакция организма, сопровождающаяся повреждением собственных тканей. Наиболее часто аллергические заболевания возникают на пищевые аллергены, антигены паразитов, лекарственные средства, рентген контрастные вещества, витамины, анестетики, на пыльцу растений, укус насекомых.
Острые аллергические заболевания можно подразделить следующим образом:
· Легкие – крапивница, аллергический ринит, поллиноз
· Средней тяжести – генерализованная крапивница, отек Квинке.
· Тяжелые - обострения бронхиальной астмы (астматический статус), анафилактический шок.
Крапивница – внезапно возникающее поражение поверхностной части кожи с образованием резко очерченных округлых волдырей с приподнятыми фестончатыми краями и бледным центром, сопровождается выраженным зудом. Может быть повышение температуры, лимфоаденопатия. Сыпь может оставаться в течение 1-3 суток, не оставляя пегментации
Аллергический ринит – отек слизистой оболочки носа, выделение обильного водянистого слизистого секрета, заложенность носа, чувство жжения в коньюктиве и слезотечение.
Поллиноз - сезонная аллергическая реакция на пыльцу растений, проявляющаяся острым коньюктивитом или ринитом, или приступом бронхиальной астмы.
Ангионевротический отек - на фоне сыпи, гиперемии, развивается острый отек кожи, подкожной клетчатки, слизистых оболочек без четкого ограничения. Боли и кожного зуда, как правило, не бывает.
Неотложная помощь
· При легких аллергических заболеваниях: антигистаминные препараты (семпрекс, кларитин, кларотадин, кестин)
Отек Квинке – (гигантская крапивница, ангионевротический отек). Локальные поражения захватывают веки, слизистые оболочки полости рта, губы, шею, ушные раковины. Отек большой, бледный, плотный, при надавливании ямка не остается. Особенно опасным является отек в области гортани, который проявляется охриплостью голоса, «лающий» кашель, удушье, частое поверхностное дыхание, возможна смерть от асфиксии.
Неотложная помощь
· срочный вызов врача;
· глюкокортикоиды – преднизолон 60-150 мг в/в;
· антигистаминные препараты нового поколения;
· при асфиксии – коникотомия или трахеостомия.
Анафилактический шок – системная реакция, развивается не зависимо от путей попадания антигена. Развитие шока может быть следствием многих факторов, включая воздействие пищевых аллергенов, лекарственных препаратов, укуса насекомых. В клинике шока можно выделить две стадии:
Первая стадия – эректильная - возбуждение, продолжительность от нескольких секунд до пяти минут.
· двигательное возбуждение;
· гиперемия кожи;
· чувство жара;
· АД повышено.
Вторая стадия – торпидная – угнетение
· артериальная гипотензия и оглушенность при легком течении;
· колляпс и потеря сознания при тяжелом течении;
· нарушение дыхания вследствие отека гортани и бронхоспазма;
· боль в животе, нарушение ритма сердца.
У 90% больных этим симптомам предшествует появление крапивницы, кожного зуда, ангионевротического отека. Клиника развивается в течение часа после контакта с аллергеном (чаще в течение первых пяти минут). Чем быстрее развиваются симптомы анафилаксии, тем, как правило, они тяжелее. Смерть может наступить через 8-10 минут. В литературе выделяют типичную форму анафилактического шока и 4 его варианта – асфиксический, гемодинамический, церебральный и абдоминальный, когда преобладают нарушения соответствующей системы.
Неотложная помощь
При в/м и п/к инъекциях – прекратить введение препарата и убрать иглу. При в/в инъекциях прекратить введение препарата, из вены не выходить.
· больного уложить (голова ниже ног), обеспечить проходимость дыхательных путей, повернуть голову в сторону (для профилактики аспирации рвотных масс), выдвинуть нижнюю челюсть, удалить съемные зубные протезы;
· ввести адреналин 0,1% - 0,3-0,5 мл п/к или в/м, повторить можно через 15 мин, при тяжелом состоянии начать в/в струйное введение 1 мл 0,1% р-ра адреналина в 20 мл любого р-ра;
· выше места поражения накладывают жгут на 25-30 мин, ослаблять который следует на 1-2 мин. каждые 10 мин;
· преднизолон – 90-150 мг в/в;
· в/в струйное введение жидкости (полиглюкин, реополиглюкин, 0,9% р-р натрия хлорида, 5% р-р глюкозы);
· антигистаминные препараты 2 мл 2,5% р-ра пипольфена или 2 мл тавегила в/м;
· при бронхоспазме – в/в медленно 10 мл 2-4% р-ра эуфиллина;
· при не возможности интубации трахеи – коникотомия;
· госпитализация в стационар в положении лежа на носилках.
Бронхиальная астма – хроническое аллергическое воспаление дыхательных путей, приводящая к гиперреактивности бронхов, клинически проявляющейся приступом удушья. Выделяют несколько клинических форм в зависимости от причины: атопическая, аспириновая, инфекционная, астма физического усилия, гормонозависимая. Независимо от факторов, вызывающих развитие бронхиальной астмы в основе приступа лежит бронхоспазм – резкое и длительное сужение мелких бронхов и бронхиол, отек слизистой бронхов, повышенная секреция слизи. В результате спазма, отека и гиперсекреции просвет бронхов резко суживается вплоть до полной непроходимости.
Клиника
Приступ начинается остро. Больные занимают вынужденное положение: сидя с упором рук на какой-либо предмет, стоя у окна, опираясь на стол или спинку стула. Экспираторная одышка: затрудненный удлиненный выдох., грудная клетка как бы застывает в фазе глубокого вдоха. Сухие, свистящие хрипы, слышимые на расстоянии. Кожные покровы цианотичные. Приступ сопровождается сухим кашлем. В конце приступа начинает выделяться вязкая стекловидная мокрота. Тахикардия. При аускультации – в легкие большое количество сухих святящих, жужжащих хрипов.
Неотложная помощь
· обеспечить доступ воздуха, расстегнуть стесняющую одежду;
· для снятия бронхоспазма используют стимуляторы бэтта – адренорецепторы: биротек, сальбутамол (вентолин) и тербуталин. Более выраженным эффектом обладает комбинированный препарат беродуал (1-4 мл на ингаляцию). Все названные препараты используют в виде аэрозольных ингаляций или через небулайзер, для купирования приступа достаточно 1-2 вдоха препарата (использование небулайзера позволяет получить эффективные концентрации указанных препаратов в дистальных отделах бронхов), действие препарата начинается через 4-5 мин. и длится 4-5 ч.;
· при невозможности проведения небулайзерной терапии или ее неэффективности предпочтение отдают эуфиллину 2-4% 10,0 мл в/в медленно;
· гормоны – преднизолон 30-60 мг в/в;
· госпитализация в стационар показана при некупирующемся приступе бронхиальной астмы.
Астматический статус – состояние удушья, обусловленное стойким и длительным нарушением бронхиальной проходимости, затянувшийся до 12 часов. В возникновении обструкции дыхательных путей во время астматического статуса первостепенную роль играют аллергический и воспалительный отек слизистой оболочки бронхиол, сгущение мокроты и нарушение ее выделения, что вызывает закупорку бронхов, а также спазм гладкой мускулатуры бронхов.
Клиника
Состояние больного тяжелое, диффузный цианоз, дыхание редкое 7-10 в мин, шумное, с участием вспомогательной мускулатуры, резкая одышка, тахикардия становится выраженной, АД – либо нормальное, либо имеет место тенденция гипотензии, количество хрипов при выслушивании резко уменьшается – «немые легкие». Объем отделяемой мокроты резко уменьшается вследствие постепенно нарастающей обструкции бронхов. Астматический статус представляет реальную угрозу для жизни больного и требует незамедлительного начала интенсивной терапии.
Неотложная помощь
· введение фенотерола (беротека) в дозе 0,5 –1,5 мг с помощью небулайзера или беродуала в дозировке 1- 4 мл на ингаляцию;
· эуфиллин применяется при отсутствии небулайзера или в особо тяжелых случаях при не эффективности небулайзерной терапии (10-15 мл 2-4% р-ра в/в медленно в течение 5-7 мин.);
· глюкокортикоидные гармоны 120-180 мг в/в струйно;
· гепарин 5000-10000 ед. в/в капельно с одним из плазмозамещающих р-ов;
· транспортировка в стационар на фоне проводимой терапии.
Тромбоэмболия легочной артерии (ТЭЛА)
Тромбоэмболия легочной артерии (ТЭЛА) – закупорка тромбом сосудистого русла в бассейне легочной артерии, определяется как синдром острой дыхательной и сердечной недостаточности.
Этиология:
1.Тромбоз глубоких вен голени-5% пациентов.
2.Тромбоз в системе нижней полой вены-83%б-х.
3.Заболевания сердечно сос. системы.
4.Злокачественные новообразования
5.Генерализованный септический процесс
6.Тромбофилические заболевания
7.Антифосфолипидный синдром.
Факторы риска.
Длительный постельный режим и сердечная недостаточность с развитием венозного застоя, массивная диуретическая терапия (приводит к дегидратации, увеличению показателей гемотокрита и вязкозти крови), некоторые виды гемибластозов, длительный прием гормональных контрацептивов, системные заболевания соединительной ткани, сахарный диабет, гиперлипидемия, варикозное расширение вен, нефротический синдром, постоянный катетер в вене, инсульты, травмы спинного мозга, химиотерапия по поводу рака.
Клинические формы ТЭЛА
1.Молниеносная.2. Острая. 3.Подострая. 4.Хроническая. 5.Рецидивирующая. 6.Стертая.
Клиника.
Внезапно появляется одышка, как в покое так и при физической нагрузке. По характеру «тихая» ЧДД от 24-72 в мин., цианоз лица, чаще бывает бледо-пепельного, сероватого оттенка. Болевой синдром отмечается в большинстве случаев ТЭЛА, выраженность его крайне вариабельна – от резчайших болей до умеренно выраженного чувства тяжести и давления в груди. При развитии инфаркта легкого боли приобретают «плевральный» характер, они связаны с дыханием, кашлем, сопровождаются появлением кровохарканья. Кровохарканье, не столь частый симптом ТЭЛА. Нарушения мозговой перфузии вызывают обмороки, головокружения, очаговую неврологическую симптоматику. Кашель встречается у многих больных с первых часов развития ТЭЛА, мокрота имеет слизистый, позднее – кровянистый характер. Подъем температуры тела отмечается у большинства пациентов с массивным ТЭЛА. Острая правожелудочковая недостаточность проявляется резко выраженной синусовой тахикардией, с расширением границ сердца вправо, пульсацией в надчревной области, акцентом II тона над легочной артерией, появлением систоличекого шума, набухание шейных вен, признаки перегрузки правых отделов сердца на ЭКГ. Артериальная гипотензия в первые минуты часто рефлекторная, в последующем переходит в стойкий коллапс.
ЭКГ-отмечаются признаки перегрузки правых отделов сердца: картина S1,Q3,Т3, которая состоит из глубокого зубца S в I стандартном отведении, глубокого зубца Q и инверсия зубца Т в III отведении. Наблюдается увеличение зубца R в III отведении и смещение переходной зоны влево ( в V4-V6 ), расщепление комплекса QRS ( в V1-V2), признаки блокады правой ножки п. Гиса.
Неотложная помощь.
· Реаниммационное пособие при необходимости.
· обезболивание - 1 мл 1% р-ра морфина разводят в 10 мл изотонического р-ра натрия хлорида или фентанила 1-2 мл 0,005 % р-ра в/в;
· антикоагулянтная терапия – струйное в/в введение 10000 тыс. ЕД гепарина;
· противошоковая терапия – допамин (дофамин) в/в капельно 5 мкг/(кг х мин), при необходимости 10мг. 2,4% р-ра эуфиллина в/в, 90-120мг преднизолона;
· Записать ЭКГ;
· госпитализация в стационар на носилках.
36. Кетоацидотическая кома
Кетоацидотическая (диабетическая) кома — это острое осложнение сахарного диабета в стадии декомпенсации, вызванное чрезмерным образованием в организме кетоновых тел, которые оказывают токсическое влияние на системы организма, в частности головной мозг, а также характеризующееся развитием обезвоживания, метаболического ацидоза и гиперосмолярности плазмы крови. Диабетическую кому регистрируют у 1—6 % больных с сахарным диабетом.
Различают два типа сахарного диабета (табл. 3).
Таблица 3. Типы сахарного диабета
| Признак | I тип | II тип |
| Распространенность | 10—20 % | 80—9р % |
| Возраст | До 25 лет | После 35 лет |
| Начало | Острое | Постепенное |
| Масса тела | Нормальная или пониженная | Увеличенная |
| Клинические симптомы | Выраженные | Стертые |
| Кетоацидоз | Выраженный | Отсутствует |
| Повреждения сосудов | Мелкие сосуды | Магистральные сосуды |
| Чувствительность к инсулину | Выражена | Не выражена |
| Количество инсулиновых рецепторов | В пределах нормы | Мало |
| Антитела | + | - |
Этиология:
· нелеченый сахарный диабет;
· нарушения режима лечения (прекращение введения инсулшла, необоснованное снижение дозы);
· несоблюдение диеты;
· алкогольная или пищевая интоксикация.
Факторы риска: ожирение, акромегалия, стресс, панкреатит, цирроз печени, употребление глюкокортикоидов, мочегонных средств, контрацептивов, беременность, отягощенная наследственность.
Патогенез. Основным патогенетическим фактором кетоацидотической комы является инсулиновая недостаточность, которая приводит к: снижению утилизации глюкозы периферическими тканями, неполному окислению жиров с накоплением кетоновых тел; гипергликемии с повышением осмотического давления в межклеточной жидкости, клеточной дегидратации с потерей клетками ионов калия и фосфора; глюкозурии, повышению диуреза, дегидратации, ацидозу.
Клинические проявления комы развиваются медленно — в течение нескольких часов или даже суток; у детей кома наступает быстрее, чем у взрослых.
Стадии кетоацидотической комы:
I стадия — компенсированный кетоацидоз;
II стадия — декомпенсированный кетоацидоз (прекома);
III стадия — кетоацидотическая кома.
Характерные признаки I стадии: общая слабость, повышенная утомляемость, головная боль, понижение аппетита, жажда, тошнота, полиурия.
Во II стадии нарастают апатия, сонливость, одышка (дыхание Куссмауля), жажда усиливается, появляются рвота и абдоминальная боль. Язык сухой, обложен; тургор кожи понижен, выражена полиурия, в выдыхаемом воздухе — запах ацетона.
Для III стадии характерны: тяжелые расстройства сознания (ступор или глубокая кома), зрачки сужены, черты лица обострены; тонус глазных яблок, мышц, сухожильных рефлексов резко снижен; признаки нарушения периферического кровообращения (артериальная гипотензия, тахикардия, холодные конечности). Несмотря на выраженную дегидратацию сохраняется повышенный диурез. Дыхание глубокое, громкое (дыхание Куссмауля), в выдыхаемом воздухе — запах ацетона.
Клинические формы кетоацидотической комы:
· абдоминальная, или псевдоперитонеальная (выражен болевой синдром, положительные симптомы раздражения брюшины, парез кишечника);
· сердечно-сосудистая (выражены нарушения гемодинамики);
· почечная (олиг- или анурия);
· энцефалопатическая (напоминает инсульт).
Дифференциальную диагностику кетоацидотической комы необходимо проводить с апоплексической, алкогольной, гиперосмолярной, лактатацидотической, гипогликемической, печеночной, уремической, гипохлоремической комами и различными отравлениями (см. табл. 2). Явления кетоацидоза характерны для состояния после продолжительного голодания, алкогольной интоксикации, заболеваний желудка, кишечника, печени.
Алкогольный кетоацидоз развивается после избыточного употребления алкоголя у лиц, страдающих хроническим алкоголизмом. При нормальном или низком уровне гликемии в сочетании с кетонемией и метаболическим ацидозом наиболее возможно развитие алкогольного кетоацидоза.
Развитие лактат-ацидоза возможно при уровне лактата в крови около 5 ммоль/л. Лактат-ацидоз может сочетаться с диабетическим кетоацидозом. При подозрении на лактат-ацидоз необходимо исследование содержания лактата в крови.
При интоксикации салицилатами развивается метаболический ацидоз, но возможно развитие первичного респираторного алкалоза, при этом уровень гликемии — в норме или снижен. Необходимо исследование уровня салицилатов в крови.
Уровень кетонов при отравлении метанолом повышен незначительно. Характерны нарушения зрения, боль в брюшной полости. Уровень гликемии — в норме или повышен. Необходимо исследование уровня метанола.
При ХПН обнаруживают умеренный ацидоз, при этом уровень кетонов — в пределах нормы. Характерно повышение содержания креатинина в крови.
Лечение начинают с введения изотонического раствора натрия хлорида после определения уровня глюкозы в крови. Немедленно внутривенно вводят инсулин (10 ЕД, или 0,15 ЕД/кг, через 2ч — внутривенно капельно б ЕД/ч). При отсутствии эффекта скорость введения удваивают. При снижении уровня гликемии до 13 ммоль/л переходят на внутривенное введение 5—10 % раствора глюкозы с инсулином. При снижении уровня глюкозы в крови менее 14 ммоль/л проводят инфузию 5 % раствора глюкозы (1000 мл в течение первого часа, 500 мл/ч — в течение следующих двух часов, с 4-го часа — 300 мл/ч).
При гипокалиемии (менее 3 ммоль/л) и сохраненном диурезе назначают препараты калия. Коррекцию нарушений КОС раствором натрия гидрокарбоната проводят, если рН менее 7,1.
37. Гиперосмолярная кома
Гиперосмолярную кому регистрируют в 10 раз реже, чем классическую кетоацидотическую диабетическую кому, чаще у больных старшего возраста на фоне латентного течения сахарного диабета. Для гиперосмолярной комы характерна гипергликемия тяжелой степени (уровень глюкозы в крови может превышать 30 ммоль/л), что предопределяет увеличение осмолярности крови и развитие выраженной дегидратации. Кетоацидоз и ацетонемия при этой коме не выражены.
Этиология: сахарный диабет, заболевания почек и поджелудочной железы, продолжительная диарея, неукротимая рвота, массивное введение углеводов, избыточное употребление мочегонных средств, глкюкокортикоидов, иммунодепрессантов.
Клинические проявления. Развитие медленное, чаще на фоне латентного течения сахарного диабета. В течение нескольких дней постепенно нарастают симптомы общей слабости, апатии, сонливости, полиурии, полидипсии, обезвоживания. Отмечают снижение тонуса глазных яблок, артериальную гипотензию, тахикардию, олигурию. Появляется неврологическая симптоматика: двусторонний спонтанный нистагм, мышечный гипертонус, гипо- или гиперрефлексия, гемипарез, параличи, патологические рефлексы, судороги, вестибулярные нарушения, галлюцинации, психические расстройства. Дыхание поверхностное, частое, но не Куссмауля, запаха ацетона в выдыхаемом воздухе нет. Возможно развитие гиповолемического шока, отека мозга, инфаркта миокарда.
Лечение. Всех больных с гиперосмолярной комой обязательно госпитализируют в ОИТ, где проводят следующие лечебные мероприятия:
· вводят коррегирующие дозы инсулина;
· осуществляют регидратационную терапию сначала 0,45 % раствором натрия хлорида, при наличии артериальной гипотензии вводят изотонический раствор натрия хлорида. При снижении содержания глюкозы в крови до 14 ммоль/л переходят на введение 5 % раствора глюкозы (1500 мл/ч в течение первого часа, 1000 мл/ч — в течение следующих двух часов, 500 мл/ч — с 4-го часа и далее). Инфузионную терапию прекращают, если состояние больного стабилизируется, метаболический ацидоз откорректирован, пациент может самостоятельно глотать, нет тошноты и рвоты.
38. Молочно-кислый ацидоз
Этиология. Лактатацидотическая кома развивается вследствие нарушений КОС и накопления в крови молочной кислоты, что обусловлено тканевой гипоксией, шоком, левожелудочковой недостаточностью, анемией тяжелой степени (лактат-ацидоз типа А), почечной или печеночной недостаточностью, передозировкой салицилатов, алкогольной интоксикацией (лактат-ацидоз типа В). Этот вид комы может развиваться при декомпенсированном сахарном диабете, особенно на фоне лечения фенилэтилбигуанидами (фенформином, метформином, др.). Дефицит витамина В1, тиаминпирофосфата и магния увеличивает риск развития лактат-ацидоза.
Факторы риска: панкреатит, сепсис, почечная или печеночная недостаточность, шок, терапия бигуанидами.
Клинические проявления. Предвестники комы: диспепсические проявления (анорексия, тошнота, рвота), апатия, сонливость или возбуждение, бессонница, боль за грудиной, астения.
Чаще лактатацидемическая кома начинается внезапно: в течение нескольких часов развиваются сонливость, оглушение, потеря сознания, признаки дегидратации, понижение температуры тела, дыхание по типу Куссмауля, понижение уровня АД, коллапс с олиго- или анурией. Рефлексы, мышечный тонус, гликемия — в пределах нормы; кетоза нет или легкой степени, ацидоз — выражен; осмолярность — в норме или несколько повышена.
У некоторых больных развивается болевой синдром за грудиной по типу стенокардитического. Характерны биохимические изменения в крови: метаболический ацидоз (рН крови 6,8-7,0, содержание лактата в сыворотке крови - 2-4 ммоль/л).
Лечение. Прогноз при лактатацидотической коме тесно коррелирует с содержанием лактата в сыворотке крови, поэтому успех лечения зависит от эффективности мероприятий, направленных на устранение причин лактат-ацидоза. С этой целью проводят симптоматическую терапию для устранения явлений шока, гиповолемии и гипоксии. В первую очередь, проводят оксигенотерапию, внутривенно вводят кристаллоидные растворы для восстановления объема внутрисосудистой жидкости.
С одной стороны, лактат-ацидоз понижает способность периферических тканей метаболизировать лактат, с другой — развивается своеобразный реверсивный эффект, при котором во внутренних органах, которые утилизируют лактат (например, печень), происходит синтез молочной кислоты. Возникает замкнутый круг, и возможность компенсации ацидоза с помощью инфузии натрия гидрокарбоната становится проблематичной (щелочная резистентность). Разорвать этот замкнутый круг возможно только проведением мероприятий, направленных на устранение причин лактат-ацидоза. Инфузию натрия гидрокарбоната необходимо проводить только при рН<7,0-7,1. Обязательной является коррекция гипокалиемии. Инфузия натрия гидрокарбоната без введения препаратов калия способствует развитию значительно выраженной гипокалиемии, которая может стать причиной смерти.
Прогноз при лактатацидотической коме неблагоприятный. Смертность достигает 70-80 %. Прогноз определяется уровнем лактата в крови: при содержании более 4 ммоль/л смертность достигает 98 %,
39. Гипогликемическая кома
Этиология, патогенез. Гипогликемическая кома развивается вследствие недостаточного обеспечения глюкозой клеток мозга, развития гипоксии, дегенеративных изменений, отека, некроза участков мозга, то есть при гипогликемии различного генеза.
Классификация:
· гипогликемия органического генеза — при поражении поджелудочной железы, например инсуломе;
· функциональная — после оперативных вмешательств, алиментарная, при гилопитуитаризме, гипоадренокортикоидизме, заболеваниях печени, недостаточности кровообращения, ХПН, ферментодефицитная (первичный рак печени, заболевания системы пищеварения, эктопия инсулярных клеток), при усиленном поглощении глюкозы опухолью, гипермоторике желудка и кишечника;
· этаноловая (этанол тормозит гликогенез и стимулирует секрецию инсулина);
· при тиреотоксикозе, физической нагрузке, у беременных (усиленном расщеплении гликогена и повышенной утилизации глюкозы), черепно-мозговой травме, посттравматической диэнцефалопатии;
· ятрогенная - чаще на фоне перорального употребления сахаропонижающих препаратов.
Клинические проявления:
· I стадия — гипогликемическое состояние чаще развивается в течение 60 мин. (иногда — внезапно): ощущение беспокойства, общая слабость, повышенная утомляемость, потливость, бледность кожи, ощущение голода, дрожание, парестезии, сердцебиение.
· II стадия — кома (дезориентация, агрессивность, немотивированные поступки, галлюцинации, двигательные нарушения, судороги, вплоть до эпистатуса).
Лечение. Немедленно внутривенно капельно вводят 40 % раствор глюкозы 40-60 мл до
восстановления сознания. При продолжительной коме показаны глюкокортикоиды. С целью профилактики отека мозга назначают магния сульфат. При артериальной гипотензии применяют симпатомиметические средства.
Этиология
Причиной дефицита железа является нарушение его баланса в сторону преобладания расходования железа над поступлением, наблюдаемое при различных физиологических состояниях или заболеваниях:
· кровопотери различного генеза;
· повышенная потребность в железе;
· нарушение усвоения железа;
· врождённый дефицит железа;
· нарушение транспорта железа вследствие дефицита трансферрина.
Кровопотери различного генеза
Повышенное расходование железа, вызывающее развитие гипосидеропении, чаще всего связано с кровопотерей или с усиленным его использованием при некоторых физиологических состояниях (беременность, период быстрого роста). У взрослых дефицит железа развивается, как правило, вследствие кровопотери. Чаще всего к отрицательному балансу железа приводят постоянные небольшие кровопотери и хронические скрытые кровотечения (5 — 10 мл/сут). Иногда дефицит железа может развиться после однократной массивной потери крови, превышающей запасы железа в организме, а также вследствие повторных значительных кровотечений, после которых запасы железа не успевают восстановиться.
По статистическим данным, у 20 — 30 % женщин детородного возраста наблюдается скрытый дефицит железа, у 8 — 10 % обнаруживается железодефицитная анемия. Основной причиной возникновения гипосидероза у женщин, кроме беременности, являются патологическая менструация и маточные кровотечения. Полименорея может быть причиной уменьшения запасов железа в организме и развития скрытого дефицита железа, а затем и железодефицитной анемии. Маточные кровотечения в наибольшей мере увеличивают объем кровопотери у женщин и способствуют возникновению железодефицитных состояний. Существует мнение о том, что фибромиома матки, даже при отсутствии менструальных кровотечений, может привести к развитию дефицита железа. Но чаще причиной анемии при фибромиоме является повышенная кровопотеря.
Развитие постгеморрагической железодефицитной анемии, также вызывают кровопотери из пищеварительного канала, которые часто имеют скрытый характер и трудно диагностируются. Такие кровопотери могут быть обусловлены заболеваниями органов пищеварения и болезнями других органов. Нарушения баланса железа могут сопровождать повторные острые эрозивные или геморрагические эзофагиты и гастриты, язвенная болезнь желудка и двенадцатиперстной кишки с повторными кровотечениями, хронические инфекционные и воспалительные заболевания пищеварительного канала. При гигантском гипертрофическом гастрите (болезни Менетрие) и полипозном гастрите слизистая оболочка легко ранима и часто кровоточит. Частой причиной скрытых труднодиагностируемых кровопотерь является грыжа пищевого отверстия диафрагмы, варикозное расширение вен пищевода и прямой кишки при портальной гипертензии, геморрой, дивертикулы пищевода, желудка, кишок, протока Меккеля, опухоли. Легочные кровотечения — редкая причина развития дефицита железа. К развитию дефицита железа иногда могут приводить кровотечения из почек и мочевых путей. Очень часто сопровождаются гематурией гипернефромы.
В некоторых случаях кровопотери различной локализации, являющиеся причиной железодефицитной анемии, связаны с гематологическими заболеваниями (коагулопатиями, тромбоцитопениями и тромбоцитопатиями), а также с поражением сосудов при васкулитах, коллагенозах, болезни Рандю — Вебера — Ослера, гематомах.
Несбалансированное питание
Дефицит железа алиментарного происхождения может развиться у детей и взрослых при недостаточном его содержании в пищевом рационе, что наблюдается при хроническом недоедании и голодании, при ограничении питания с лечебной целью, при однообразной пище с преимущественным содержанием жиров и сахаров. У детей может наблюдаться недостаточное поступление железа из организма матери как следствие железодефицитной анемии во время беременности, преждевременных родов, при многоплодности и недоношенности, преждевременной перевязке пуповины до прекращения пульсации.
Нарушение усвоения железа
Длительное время считали основной причиной развития дефицита железа отсутствие хлористоводородной кислоты в желудочном соке. Соответственно выделяли гастрогенную или ахлоргидрическую железодефицитную анемию. В настоящее время установлено, что ахилия может иметь только дополнительное значение в нарушении всасывания железа в условиях повышенной потребности в нем организма. Атрофический гастрит с ахилией возникает вследствие дефицита железа, обусловленного снижением активности ферментов и клеточного дыхания в слизистой оболочке желудка.
К нарушению всасывания железа могут приводить воспалительные, рубцовые или атрофические процессы в тонкой кишке, резекция тонкой кишки. Существует ряд физиологических состояний, при которых потребность в железе резко увеличивается. К ним относятся беременность и лактация, а также периоды усиленного роста у детей. Во время беременности расходование железа резко повышается на потребности плода и плаценты, кровопотерю при родах и лактацию. Баланс железа в этот период находится на грани дефицита, и различные факторы, уменьшающие поступление или увеличивающие расход железа, могут приводить к развитию железодефицитной анемии.
Железодефицитная анемия иногда, особенно в грудном и пожилом возрасте, развивается при инфекционных и воспалительных заболеваниях, ожогах, опухолях, вследствие нарушения обмена железа при сохранённом его общем количестве.
Дата: 2019-07-30, просмотров: 468.