Парообразование - конденсация.
Процесс перехода жидкости в пар может происходить двумя способами: кипение или же испарение. Процесс испарения происходит благодаря молекулам с большой кинетической энергией, которая позволяет им отрываться с поверхности жидкости. В зависимости от некоторых условий, скорость испарения может изменяться. Испарение зависит от: размеров поверхности жидкости; от типа жидкости; от температуры; от давления; от содержания пара над жидкостью. При испарении уменьшается температура тела. Когда молекулы над жидкостью расходуют свою энергию, они частично возвращаются обратно, данный процесс называется конденсацией. Посредством этих двух взаимообратных процессов происходит круговорот воды в природе: сначала жидкость испаряется, а потом возвращается на Землю в виде облаков, дождя и росы.
Кипение - это процесс парообразования со всего объема жидкости. Он возможен только в том случае, когда в жидкости имеется газ, проникший в нее с помощью диффузии. При повышении температуры жидкости, пузырьки газа начинают увеличивать на протяжении всего процесса нагревания и кипения. С повышением температуры и давления, пузырьки начинают всплывать на поверхность благодаря силе Архимеда. Когда попадают на границу раздела сред, они начинают лопаться. Именно этот звук мы слышим, когда жидкость кипит. Вокруг этих пузырьков находится насыщенный пар, который благодаря кипению, попадает в воздух в момент разрыва шариков воздуха. Температура кипения каждой жидкости индивидуальна. Более того, она меняется в результате изменения давления. Например: при давлении в 1атм=105Па, температура кипения воды 1000С; при давлении в два раза меньшем вода закипит при температуре 800С; если же давление увеличить до 15атм, то температура кипения жидкости будет равна 2000С. При нормальных условиях жидкость не может нагреться выше температуры кипения.
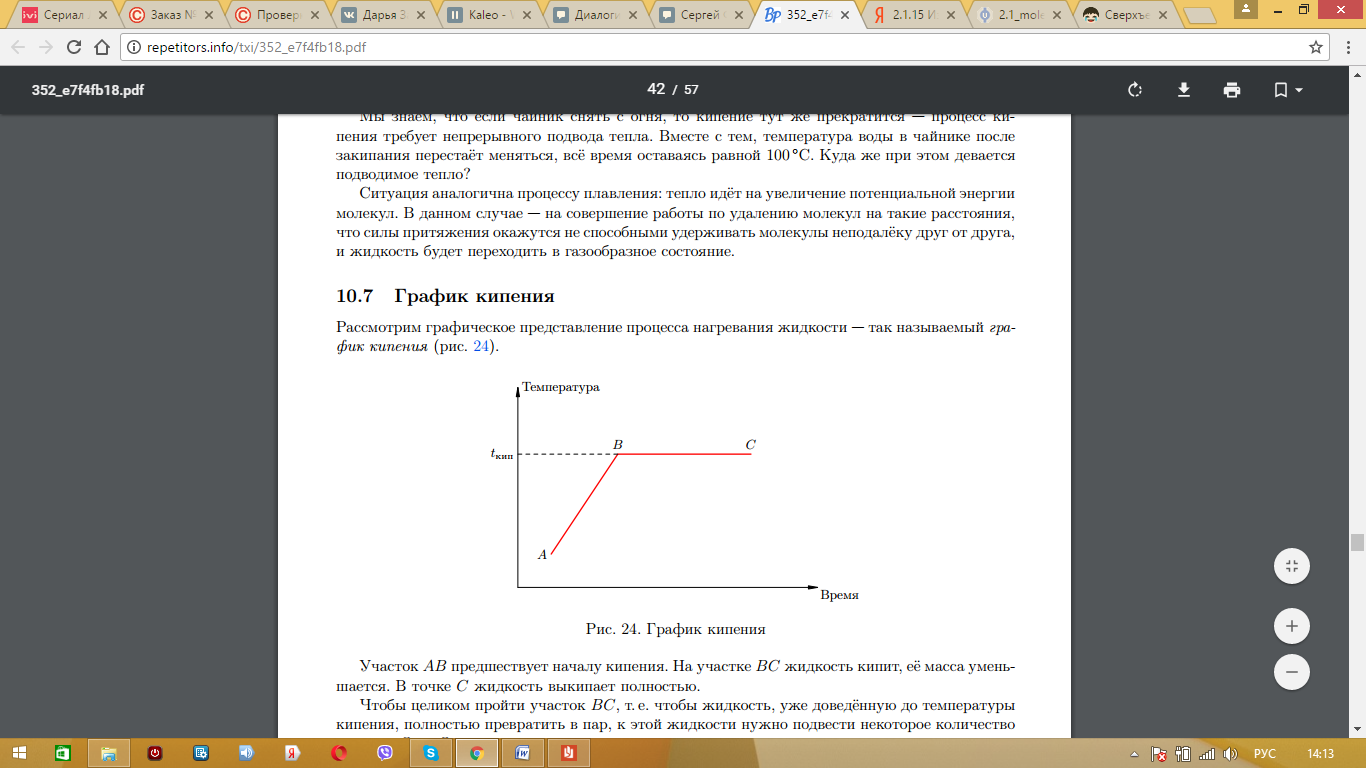
Чтобы жидкость кипела, необходимо постоянная передача некоторого количества тепла. До момента кипения необходимо передать тепло:
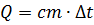 , где
, где
с – удельная теплоемкость вещества тела, Дж/(кг×0С),
m – масса тела, кг,
Dt – изменение температуры тела, 0С,
Для испарения некоторой массы жидкости необходимо передать ей следующее количество теплоты:
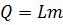 , где
, где
L – удельная теплота парообразования жидкости, Дж/кг,
m – масса жидкости, кг.
Плавление и кристаллизация.
Все твердые тела делятся на кристаллические и аморфные. Аморфные тела имеют свойства жидкости и твердого тела. В отличие их от кристаллических тел, в них отсутствует определенная температура для плавления. Они переходят в жидкое состояние на протяжении всего времени, вне зависимости от условий. В основе кристаллических тел лежит кристаллическая решетка, в которой структурные элементы постоянно находятся в колебательном движении вокруг состояния равновесия.
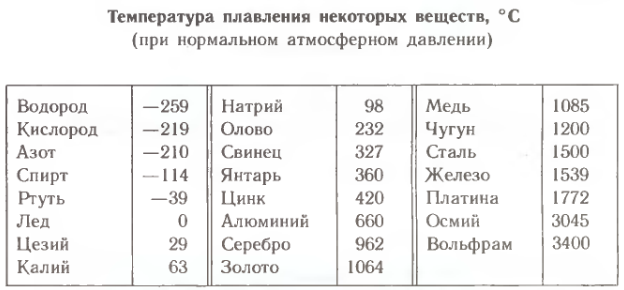
Процесс, при котором твердое тело переходит в жидкое состояние, называется плавлением. На плавление не влияет форма или размер тела, оно зависит только от температуры. Каждое кристаллическое тело имеет собственную температуру плавления, при которой происходит разрушение связей в узлах решетки. Когда тело нагревается, каждой структурной единице дается энергия, необходимая для разрыва связи, в результате чего тело становится жидким. Если данное тело прекратить нагревать, то оно снова переходит в твердое состояние. Температуру плавления для конкретного вещества можно найти в специальных таблицах.
Рассмотрим график плавления твердого тела.
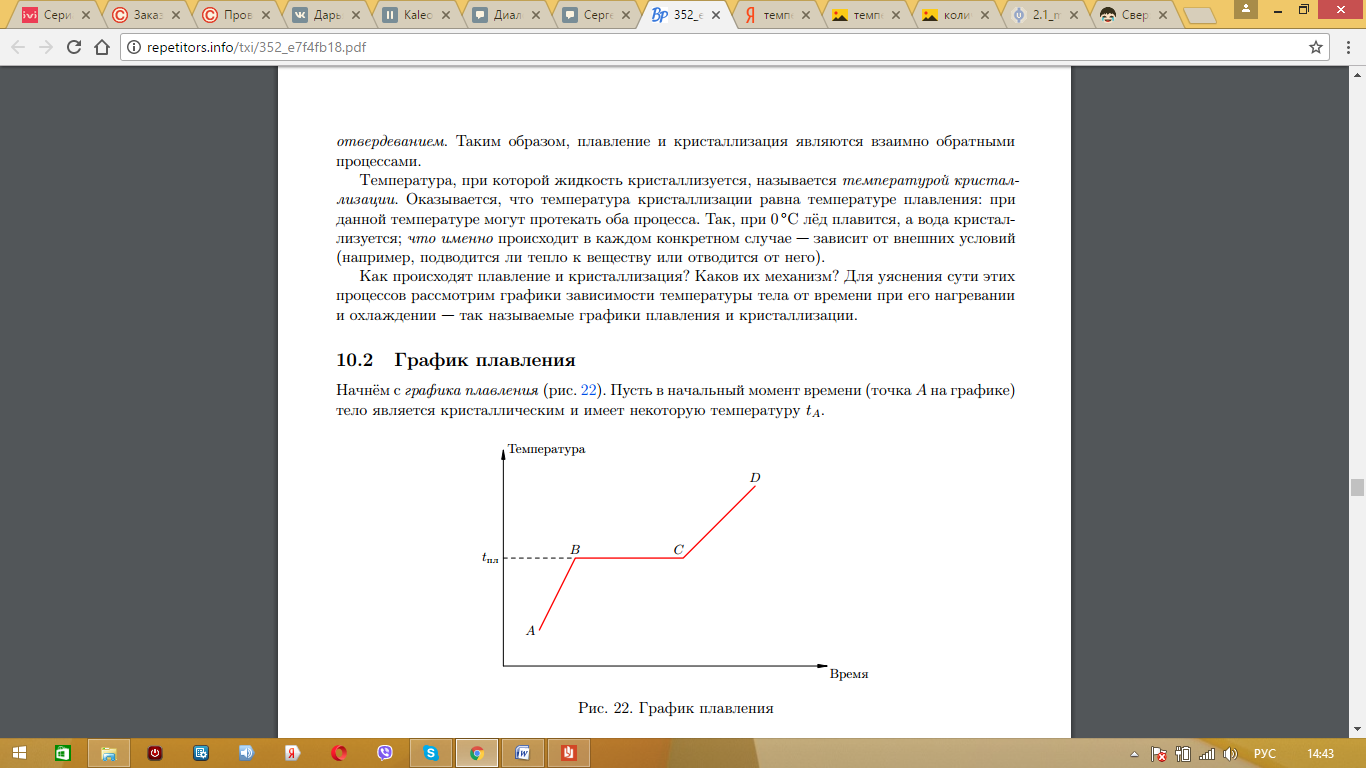
На участке АВ указан процесс нагревания твердого тела до некоторой температуры плавления. Чтобы определить количество теплоты, необходимое для нагревания, следует воспользоваться формулой:
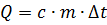 , где
, где
с –удельная теплоемкость вещества тела, ДЖ/(кг×0С),
m – масса тела, кг,
Dt – изменение температуры тела, 0С.
Когда тело нагрето до температуры плавления, оно начинает плавиться. Процесс плавления указан на участке ВС. Если поддерживать необходимую температуру, то можно расплавить всю массу твердого тела. Процесс плавления происходит без изменения температуры. Чтобы определить необходимое количество теплоты для плавления, следует воспользоваться формулой:
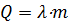 , где
, где
λ – удельная теплота плавления вещества тела, Дж/кг,
m- масса тела, кг.
На участке СД указано нагревание расплавленного твердого тела.
Процесс кристаллизации полностью обратный процессу плавления.
Фазовые переходы - это процессы, при которых тело меняет свое агрегатное состояние. Во время плавления для разрушения связей между структурными единицами необходима энергия. Поэтому, чтобы тело перешло в жидкое состояние, ему требуется энергия. Поэтому в результате подвода тепла внутренняя энергия тела увеличивается. Во время процесса кристаллизации происходит обратный процесс - молекулы становятся в узлы кристаллической решетки, для этого температуру тела уменьшают, поэтому внутренняя энергия также уменьшается. Когда жидкости передается достаточное количество энергии, она переходит в газообразное состояние. Это значит, что внутренняя энергия тела увеличивается. В момент конденсации жидкость наоборот отдает энергию, следовательно, внутренняя энергия тела уменьшается. Следовательно, можно сделать вывод, что во время процессов кристаллизации и конденсациивнутренняя энергия структурных единиц уменьшается, а при испарении и плавлении - увеличивается.
ЛЕКЦИЯ 2. Термодинамика.
Дата: 2019-07-31, просмотров: 325.