Модуль 2.
Молекулярная физика
ЛЕКЦИЯ 1. Молекулярно-кинетическая теория.
Агрегатные состояния вещества.
Все вещества могут находиться в трех основных агрегатных состояниях: газ, жидкость, твердое тело. В зависимости от молекулярного строения различные вещества могут иметь различные физические свойства. При этом каждое агрегатное состояние имеет свои основные свойства. Многие вещества могут находиться во всех трех состояниях. Для перехода необходимо создать необходимые условия. Для всех нас известно, что вода может быть жидкой, твердой и газообразной.
Вещества в газообразном состоянии отличаются от других тем, что в них структурные единицы находятся на большом расстоянии друг от друга, намного большем, чем размер структурных единиц. Двигаются они хаотически. Такой вид движения называется тепловым - чем больше температура, тем больше скорость движения структурных единиц. Также его называют броуновским движением. Если любое количество газа запустить в емкость произвольного объема и формы, то он заполнит все пространство. От размера емкости будет зависеть только концентрация и плотность данного газа.
Структурные единицы жидкости находятся друг от друга на расстоянии, соизмеримом с размером молекул. Жидкость имеет собственный объем, в отличие от газообразного состояния, не может заполнить всю ёмкость. Не смотря на то, что жидкость принимает фиксированный объем, под действием силы тяжести растекается или принимает форму сосуда. Если же на жидкость не действует сила тяжести, то она принимает форму шара. Жидкость обладает текучестью. В результате того, что движение в жидкости происходит слоями, иногда молекулы могут перескочить с одного слоя в другой, под действием внешней силы она может вытекать в направлении её действия.
Твердое агрегатное состояние - полная противоположность газам. Структурные единицы твердого тела находятся на расстоянии, намного меньшем, чем размер молекул. Твердые тела имеют свой объем. Чтобы твердое тело изменило свою форму, необходимо приложить определенную силы. Под действием только силы тяжести твердое тело сохраняет свою форму. Твердые тела бывают кристаллические или же аморфные. Структурной единицей кристаллических тел является решетка (металлы, соли). Такие вещества имеют четкую температуру плавления. Аморфные - близки по свойствам к воде. У них нет температуры плавления, они обладают текучестью (стекло, смола, воск).
Стоит отметить, что кроме основных трех состояний были открыты и еще три состояния: плазма, фермионный конденсат, конденсат Бозе-Эйнштейна. К плазме относятся верхние слои атмосферы, так же е используют для люминесцентных ламп. Чтобы получить другие два состояния вещества, необходимо приблизить температуру к абсолютному нулю.
Основное уравнение МКТ
Идеальный газ можно описать с помощью макро и микро параметров.
Микропараметры описывают характеристики структурных составляющих вещества. К ним можно отнести массу, скорость, энергию молекулы газа. Что касается макропараметров, то это физические величины, характеризующие общие характеристики вещества в целом, вызванные микропараметрами. К ним относится температура, связанная с энергией и скоростью молекул, объем, а также давление, которое производится всеми молекулами газа на стенки ёмкости, в которой находятся.
Уравнение, способное объединить макро и микропараметры идеального газа, называется основным уравнением МКТ: 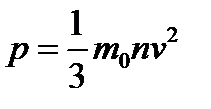 , где m0 - масса одной молекулы, n - концентрация молекул, v - среднеквадратическая скорость молекул газа. Из основного уравнения МКТ вытекает связь давления с кинетической энергией:
, где m0 - масса одной молекулы, n - концентрация молекул, v - среднеквадратическая скорость молекул газа. Из основного уравнения МКТ вытекает связь давления с кинетической энергией: 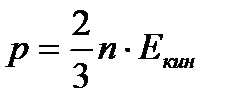
Эта формула показывает, что давление газа зависит от количества молекул в некотором объеме, от их массы, а также скоростей, с которыми они двигаются. Данное уравнение наиболее точно описывает характеристики разреженных газов. Воздух при нормальных условиях является приближенным к идеальному газу. Уравнения были выведены с некоторыми упрощениями:
1. Все молекулы взаимодействуют упруго. В реальных газах часть скорости и энергии теряется за счет передачи импульса стенкам сосуда, в котором находится газ.
2. Использовать уравнения можно только в случае, когда структурные единицы практически не взаимодействуют. Если достаточно увеличить давление и значительно уменьшить температуру, то молекулы будут постоянно взаимодействовать друг с другом.
3. Допустимы пренебрежения размерами и формами структурных единиц.
4. Справедливо для одного вида газа. В реальном воздухе имеется примесь газов, что влияет на массу молекул, которая впоследствии изменяет значение давления.
Абсолютная температура.
Всегда для нас температура была характеристикой теплоты некоторого тела. На самом деле температура характеризуется скоростью движения молекул вещества, в том числе и идеального газа. Чем большую скорость имеет молекула, следовательно, она обладает большей энергией. И наоборот, чем больше кинетическая энергия молекул газа, тем выше температура всего вещества.
Измерять температуру можно с помощью специального проградуированного прибора. Впервые такое средство измерительной техники было предложено Фаренгейтом. За начало измерений была взята температура, при которой тает лед из воды и спирта, соединенные в равных количествах. Заканчивалась шкала температурой, при которой кипит вода. Ведь этот диапазон был разделен на 180 равных частей, каждая из которых отвечала изменению температуры на 1 градус.
В середине 18 столетия ученый Цельсий предложил новую шкалу, начинавшуюся с температуры таяния льда, и заканчивающуюся температурой кипения. Весь диапазон разделил на 100 частей. Данная шкала температур используется до сих пор.
Несмотря на популярность шкалы по Цельсию, за абсолютную шкалу температур во всем мире принимается шкала Кельвина, которая берет свое начало в абсолютном нуле. Абсолютный ноль - 273,15 градуса Цельсия. Так как температура характеризуется скоростью и энергией молекул, то при абсолютном нуле все молекулы прекращают свое движение. Абсолютная температура изменяется в Кельвинах: [Т] = 1К.
Чтобы перейти от температуры в Цельсиях к Кельвинам, следует воспользоваться простой формулой: 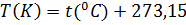 . Например:
. Например: 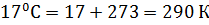 . Данная шкала температур удобна тем, что все величины получаются положительными. Абсолютная температура не может быть отрицательной.
. Данная шкала температур удобна тем, что все величины получаются положительными. Абсолютная температура не может быть отрицательной.
Изопроцессы.
Любое вещество характеризуют макро- и микропараметры. Если говорить о макропараметрах, то для перехода системы из одного состояния в другое обязательно должны изменяться минимум две величины. Это значит, что отдельно только давление, только объем или только температура не может изменяться. Они либо изменяются все согласно уравнению Клапейрона, либо изменяется две величины.
Уравнение Клапейрона : 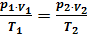
Изопроцессы - это процессы, во время которых масса газа и один макропараметр остаются неизменными. Существует три основных изопроцесса: изобарный, изохорный, изотермический.
Изобарный процесс. Изолированным, неизменным остается давление. Если в уравнении Клапейрона давление остается неизменным, то оно сокращается и можно получить новый закон - данному процессу соответствует закон Гей-Люссака: 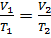 .
.
Можно заметить, что если некоторый газ нагреть, то он начнет расширяться, то есть увеличивать свой объем. То есть при увеличении одной величины должна увеличиваться и другая. Данный закон имеет прямую зависимость переменных величин.
Данному процессу соответствуют следующие графики (изобары):
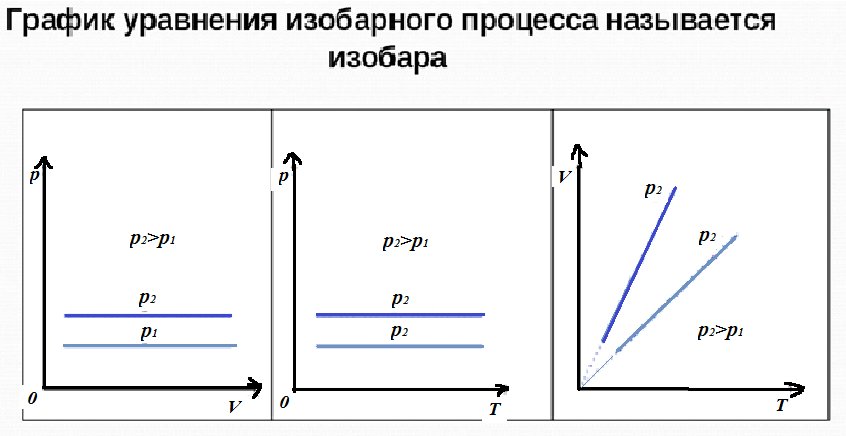
Расположение прямой на графике зависит от значения давления. Чем выше давление, тем выше график зависимости. Обратите внимание на то, что график в координатах VT не начинается с нуля - это говорит о том, что науке не известны еще случаи достижения абсолютного нуля. Если бы график начинался бы с нуля, это говорило бы о том, что объем равен нулю. Но если это так, то частиц газа нет, и значит, при отсутствии частиц просто не может идти речь о температуре. Более того, в законе Гей-Люссака температура находится в знаменателе, а, как мы знаем, знаменатель не может быть равен нулю.
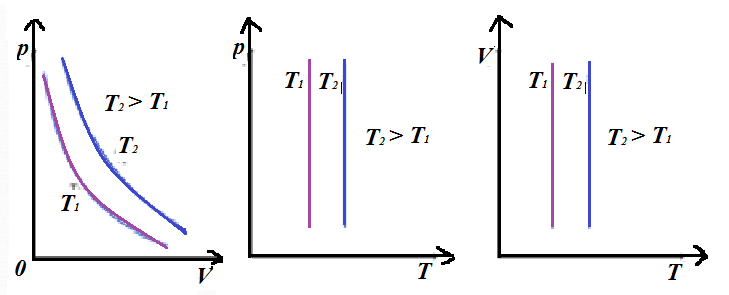
Изохорный процесс. Во время данного процесса изменяется только давление и температура, а объем остается неизменным. При данных условиях из уравнения Клапейрона получим закон Шарля: для газа данной массы отношение давления газа к его термодинамической температуре постоянно: 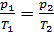 . Здесь прослеживается та же зависимость - при увеличении одного параметра должен увеличиваться и другой. Данному процессу соответствуют аналогичные графики (изохоры):
. Здесь прослеживается та же зависимость - при увеличении одного параметра должен увеличиваться и другой. Данному процессу соответствуют аналогичные графики (изохоры):
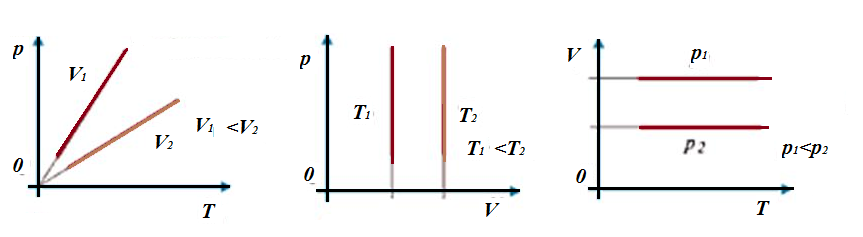
Изотермический процесс. При данном процессе изменяется давление и объем. Процесс описывает закон Бойля-Мариотта: 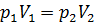 .
.
Обратим внимание, это единственный процесс, где наблюдается обратная зависимость - при увеличении одного параметра, второй должен падать. Графики данного процесса называются изотермами.
Влажность воздуха.
Физическая величина, показывающая количество содержания паров в воздухе, называют влажностью воздуха. Влажность бывает относительной и абсолютной. Основными величинами, по которым можно определить влажность, является плотность и давление.
Абсолютная влажность показывает плотность содержания водяного пара в некотором рассматриваемом объеме: 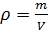 . В СИ единицей измерения абсолютной влажности измеряется в:
. В СИ единицей измерения абсолютной влажности измеряется в: 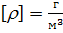 . Так как влажность есть в уравнения Менделеева-Клапейрона:
. Так как влажность есть в уравнения Менделеева-Клапейрона: 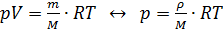 .
.
Все живые организмы воспринимают именно относительное содержание водяного пара, поэтому было введено величину, которая называется относительной влажностью. Данная величина показывает процент влажности в данный момент времени относительно насыщенного пара, то есть влажности, при которой выпадает роса: 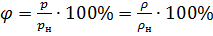 , где pн – давление насыщенного пара, rн – плотность насыщенного пара. Единицей измерения в СИ является [j]=% .
, где pн – давление насыщенного пара, rн – плотность насыщенного пара. Единицей измерения в СИ является [j]=% .
 Средством измерения относительной влажности является психрометр. Он состоит из двух термометров: влажного и сухого. Влажный термометр позволяет измерять температуру насыщенного пара, а сухой - окружающей среды. Также в психрометре есть таблица, по которой определяют влажность воздуха.
Средством измерения относительной влажности является психрометр. Он состоит из двух термометров: влажного и сухого. Влажный термометр позволяет измерять температуру насыщенного пара, а сухой - окружающей среды. Также в психрометре есть таблица, по которой определяют влажность воздуха.
Плавление и кристаллизация.
Все твердые тела делятся на кристаллические и аморфные. Аморфные тела имеют свойства жидкости и твердого тела. В отличие их от кристаллических тел, в них отсутствует определенная температура для плавления. Они переходят в жидкое состояние на протяжении всего времени, вне зависимости от условий. В основе кристаллических тел лежит кристаллическая решетка, в которой структурные элементы постоянно находятся в колебательном движении вокруг состояния равновесия.
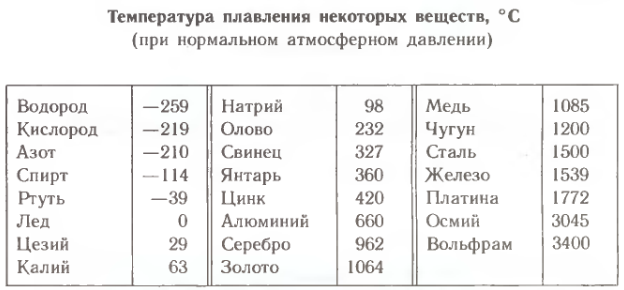
Процесс, при котором твердое тело переходит в жидкое состояние, называется плавлением. На плавление не влияет форма или размер тела, оно зависит только от температуры. Каждое кристаллическое тело имеет собственную температуру плавления, при которой происходит разрушение связей в узлах решетки. Когда тело нагревается, каждой структурной единице дается энергия, необходимая для разрыва связи, в результате чего тело становится жидким. Если данное тело прекратить нагревать, то оно снова переходит в твердое состояние. Температуру плавления для конкретного вещества можно найти в специальных таблицах.
Рассмотрим график плавления твердого тела.
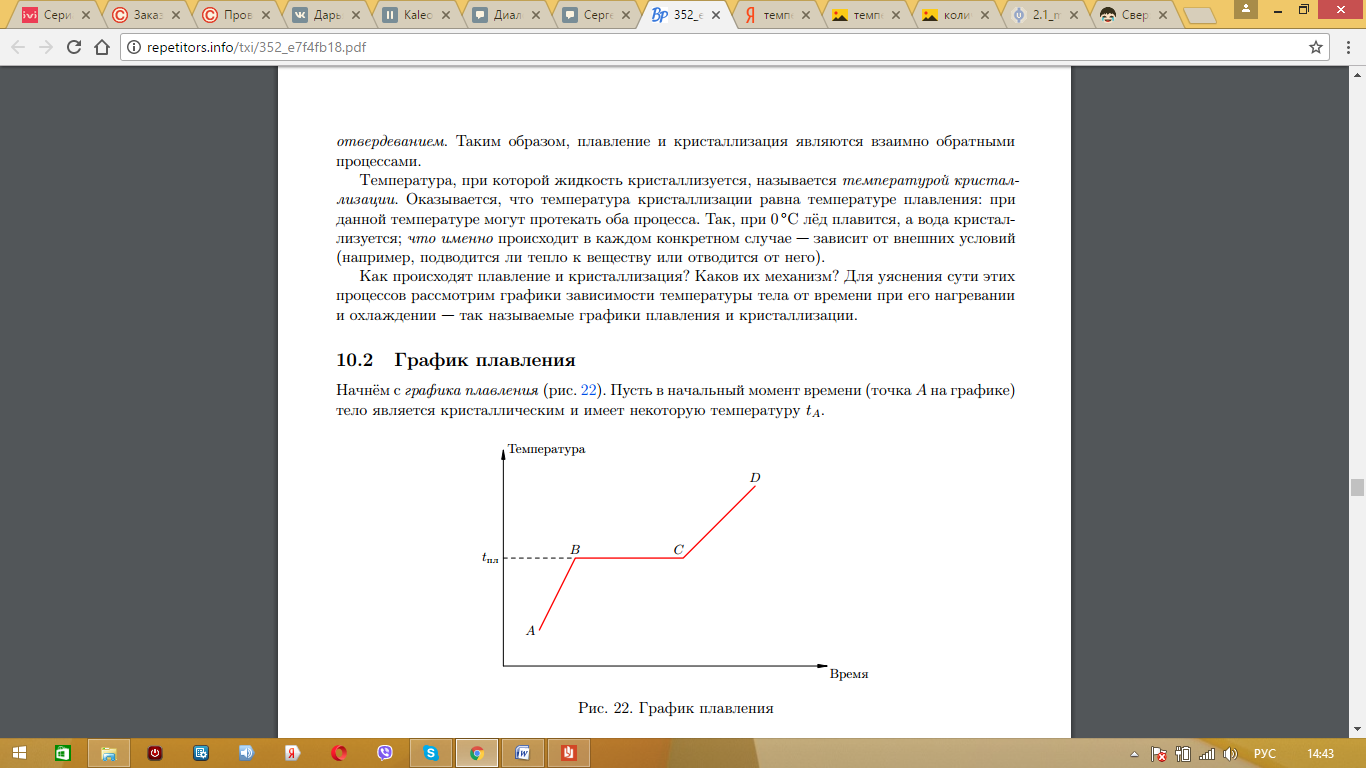
На участке АВ указан процесс нагревания твердого тела до некоторой температуры плавления. Чтобы определить количество теплоты, необходимое для нагревания, следует воспользоваться формулой:
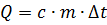 , где
, где
с –удельная теплоемкость вещества тела, ДЖ/(кг×0С),
m – масса тела, кг,
Dt – изменение температуры тела, 0С.
Когда тело нагрето до температуры плавления, оно начинает плавиться. Процесс плавления указан на участке ВС. Если поддерживать необходимую температуру, то можно расплавить всю массу твердого тела. Процесс плавления происходит без изменения температуры. Чтобы определить необходимое количество теплоты для плавления, следует воспользоваться формулой:
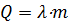 , где
, где
λ – удельная теплота плавления вещества тела, Дж/кг,
m- масса тела, кг.
На участке СД указано нагревание расплавленного твердого тела.
Процесс кристаллизации полностью обратный процессу плавления.
Фазовые переходы - это процессы, при которых тело меняет свое агрегатное состояние. Во время плавления для разрушения связей между структурными единицами необходима энергия. Поэтому, чтобы тело перешло в жидкое состояние, ему требуется энергия. Поэтому в результате подвода тепла внутренняя энергия тела увеличивается. Во время процесса кристаллизации происходит обратный процесс - молекулы становятся в узлы кристаллической решетки, для этого температуру тела уменьшают, поэтому внутренняя энергия также уменьшается. Когда жидкости передается достаточное количество энергии, она переходит в газообразное состояние. Это значит, что внутренняя энергия тела увеличивается. В момент конденсации жидкость наоборот отдает энергию, следовательно, внутренняя энергия тела уменьшается. Следовательно, можно сделать вывод, что во время процессов кристаллизации и конденсациивнутренняя энергия структурных единиц уменьшается, а при испарении и плавлении - увеличивается.
ЛЕКЦИЯ 2. Термодинамика.
Внутренняя энергия.
Все структурные единицы вещества находятся в постоянном движении. Так как они имеют определенную скорость, это значит, что каждая молекула обладает кинетической энергией. Более того, они постоянно взаимодействуют друг с другом, или же находятся на некотором расстоянии друг от друга, поэтому каждая структурная единица вещества имеет и потенциальную энергию. Сумма этих двух энергий порождают новую энергию - внутреннюю. Внутренняя энергия вещества - это сумма кинетической и потенциальной энергии его структурных единиц. Обобщив, скажем, что внутренняя энергия состоит из: кинетической энергии движения, потенциальной энергии частиц, энергии движения электронов по своим оболочкам, энергии, которую имеют структурные единицы ядра.
Напомним, что идеальный газ - это модель, в которой структурные единицы не взаимодействуют друг с другом. Поэтому можно сделать вывод, что внутренняя энергия идеального газа не имеет потенциальную составляющую, а состоит только из кинетической энергии молекул. Если умножить количество атомов идеального газа на кинетическую энергию каждого из них, то можно получить формулу для внутренней энергии одного моля одноатомного идеального газа:
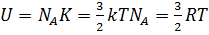 . Итак, внутренняя энергия зависит только от температуры. Внутренняя энергия является функцией состояния системы и не зависит от предыстории.
. Итак, внутренняя энергия зависит только от температуры. Внутренняя энергия является функцией состояния системы и не зависит от предыстории. 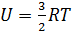 .
.
Чтобы получить внутреннюю энергию иного количества вещества, формулу следует умножить на количество моль. Так же эта формула изменится в случае, если газ не одноатомный: 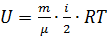 , где i – количество степеней свободы.
, где i – количество степеней свободы.
Законы термодинамики.
При рассмотрении предыдущих вопросов мы отметили, что для изменения внутренней энергии газа его можно нагреть или же совершить над ним работу. Эти два процесса могут происходить отдельно или же одновременно. Но, несмотря на это, они оба приводят к изменению энергии структурных единиц. В таком случае, можно сделать вывод, что изменение внутренней энергии газа равно сумме количеству переданной теплоты и совершенной над ним работой.
Первый закон термодинамики гласит: изменение внутренней энергии системы при переходе термодинамической системы из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе. 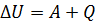 .
.
Замечание. Если же работу совершает сама термодинамическая система, а не внешние силы, то 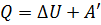 .
.
Вывод: количество теплоты, переданной термодинамической системе идет на изменение ее внутренней энергии и совершении работы.
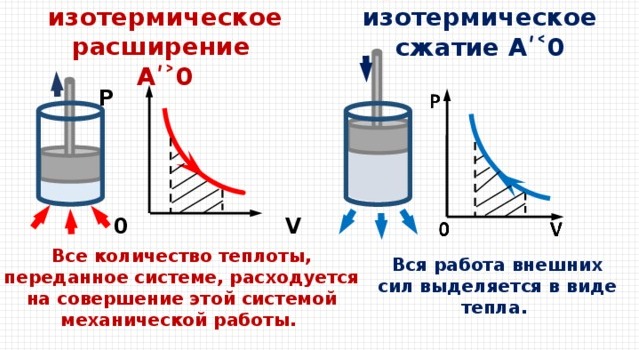
При изотермическом процессе температура остается неизменна, то все количество энергии, которое может быть передано газу, идет только на совершение работы над внешними телами, без изменения внутренней энергии, которая повлекла бы за собой изменение температуры: 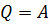 .
.
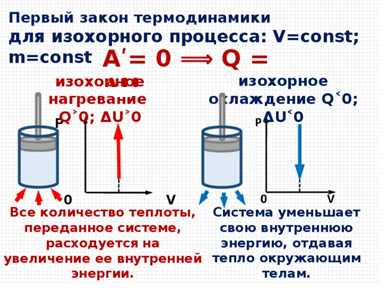
При изохорном процессе не происходит изменение объема. Значит, работа над газом не совершается, все полученное тепло идет на его нагревание. Изменяется внутренняя энергия : 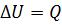 .
.
Во время изобарного нагревания для сохранения постоянного давления газ должен находиться под свободным поршнем, который способен перемещаться при нагревании. В результате этого происходит изменение его объема. А это значит, что внутренняя энергия газа изменяется во время совершения работы и при теплообмене.
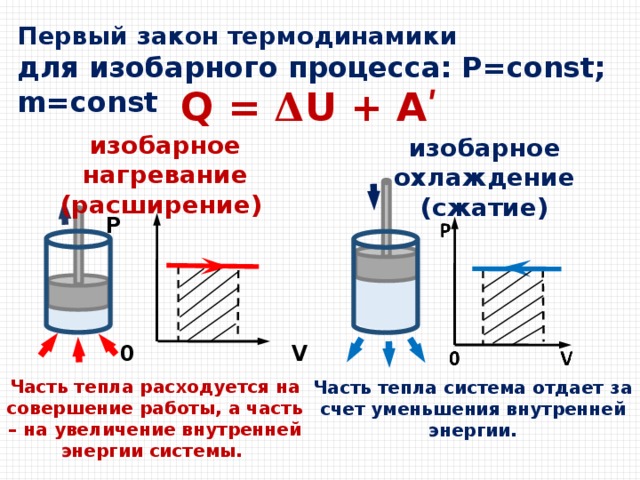
Когда газ изолирован от внешней среды, когда не происходит теплообмена с окружающей средой, все изменения с газом происходят настолько быстро, что он не успевает отдать или взять тепло. Такой процесс называют адиабатный процесс. Первый закон термодинамики имеет следующий вид: 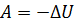 . Газ совершает работу за счет убыли его внутренней энергии. График адиабатного процесса можно получить с помощью двух изотерм:
. Газ совершает работу за счет убыли его внутренней энергии. График адиабатного процесса можно получить с помощью двух изотерм:
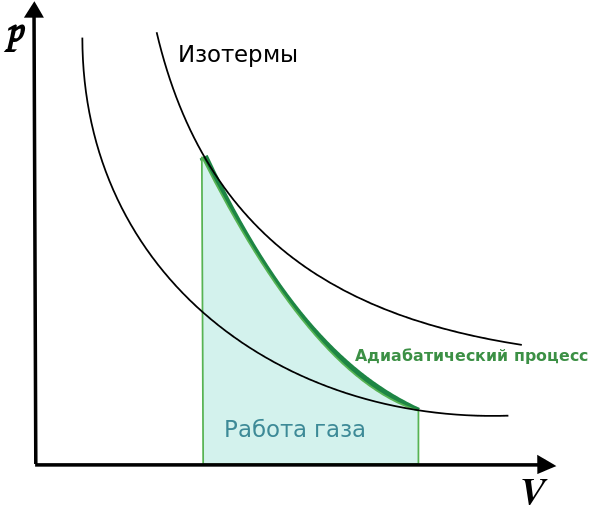
Сосуд, который не позволяет производить теплообмен, называется сосудом Дьюара, иначе говоря - термос.
Второй закон термодинамики говорит о том, что во время теплопередачи все тепло всегда передается от более нагретого тела к менее нагретому, а механическая энергия способствует изменению внутренней энергии.
Постулат Клаузиуса говорит о том, что холодное тело не может передавать холод более нагретому телу без дополнительных источников работы. То есть в холодильных машинах всегда есть дополнительное тело, которое способствует движению холодильного вещества без изменения его температуры за счет горячего тела. Именно поэтому фреон в бытовых холодильниках не нагревается из-за того, что в холодильник кладут пищу.
Литература
| 1. | Фоксфорд. Учебник. [электронный ресурс] www.foxford/wiki.ru |
| 2. | Г. Я. Мякишев, Физика. 10 класс. М. - Издательство: «Дрофа» , 2013. |
| 3. | Л. Ландау, Физика для всех. Книга 1. Физические тела / Л. Ландау, А.Китайгородский, - Издательство: «Главная редакция физико-математической литературы издательства "Наука"» , 1987. |
| 4. | Образовательный портал «Решу ЕГЭ» [электронный ресурс] https://phys-ege.sdamgia.ru/ |
Литература.
| 1. | ЕГЭ и ОГЭ – подготовка к экзаменам [электронный ресурс] www.ctege.info |
| 2. | ЕГЭ, ОГЭ, ВПР. [электронный ресурс] https://neznaika.pro/ |
| 3. | Федеральный институт педагогических измерений.[электронный ресурс] http://www.fipi.ru/ |
| 4. | Образовательный портал «Решу ЕГЭ» [электронный ресурс] https://phys-ege.sdamgia.ru/ |
Модуль 2.
Молекулярная физика
ЛЕКЦИЯ 1. Молекулярно-кинетическая теория.
Дата: 2019-07-31, просмотров: 372.