1827 год для физиков знаменовался новым открытием в области молекулярной физики. В это время ботаник Броун изучал пыльцу и споры растений под микроскопом. Данные частицы находились в воде. Он заметил, несмотря на то, что на данные споры никто не действует, они двигаются. Ученый зафиксировал данный факт в собственных биологических исследованиях. Однако он никоим образом не мог объяснить данное явление, которое назвали броуновским движением. Данное явление пытался объяснить Эйнштейн. Он предполагал, что споры подвергаются постоянному бомбардированию частицами воды, которые находятся в постоянном движении. Именно поэтому взвешенные в воде частицы двигались. Такой вид движения лучше всего подтверждает то, что все тела состоят из атомов.
В результате постоянного движения частицы могут передвигаться даже в другом веществе. Такое взаимное проникновение называется диффузией. Процесс перемешивания веществ лучше всего происходит в газах и хуже всего в твердых телах. Для увеличения скорости взаимного проникновения следует увеличить температуру вещества или увеличить давление. Изменения данных параметров приводит к изменению внутренней энергии, что способствует ускорению движения частиц.
Модель идеального газа в МКТ
Для изучения всех последующих тем необходимо знать основные положения МКТ:
1. Все тела состоят из структурных единиц (атомов, молекул). О существовании молекул можно судить, исходя из закона кратных отношений. Не существует веществ, в формулу, которых бы входил не целый атом. Например, Н2О - здесь ровное количество атомов водорода и кислорода. Точно также и в остальных элементах.
2. Они постоянно находятся в тепловом движении. То, что молекулы двигаются хаотически, можно подтвердить с помощью диффузии или осмоса. Так же нам известно, что все газы стремятся заполнить полный объем, что, в свою очередь, подтверждает постоянное движение молекул.
3. Между всеми структурными единицами существуют силы притяжения и отталкивания. То, что между всеми молекулами существуют силы притяжения, можно подтвердить с помощью силы упругости, способности твёрдых тел сохранять свою форму, а также поверхностного натяжения жидкостей.
4. Между всеми структурными единицами имеются промежутки. Стоит отметить, что объем смешанных различных жидкостей всегда меньше, чем сумма всех объемов жидкостей по отдельности.
Все знания, полученные при изучении данной теории можно применить в быту. МКТ объясняет питание растений из почвы, всасывание полезных веществ стенками кишечника, а также многое другое.
Для изучения явлений и процессов, протекающих в газах, принято рассматривать идеализированную модель, которая называется идеальным газом. Для идеально газа характерно:
– структурные единицы газа принимаются за материальные точки;
– они взаимодействуют друг с другом, как абсолютно упругие мячики;
– силами взаимодействиями между молекулами можно пренебречь.
В реальном мире к идеальному газу близок разжиженный кислород, гелий, азот, водород и другие. Для идеального газа свойственна большая длина свободного пробега, то есть между последовательными ударами структурная единица проходит большое расстояние.
Основное уравнение МКТ
Идеальный газ можно описать с помощью макро и микро параметров.
Микропараметры описывают характеристики структурных составляющих вещества. К ним можно отнести массу, скорость, энергию молекулы газа. Что касается макропараметров, то это физические величины, характеризующие общие характеристики вещества в целом, вызванные микропараметрами. К ним относится температура, связанная с энергией и скоростью молекул, объем, а также давление, которое производится всеми молекулами газа на стенки ёмкости, в которой находятся.
Уравнение, способное объединить макро и микропараметры идеального газа, называется основным уравнением МКТ: 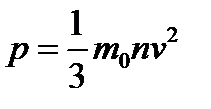 , где m0 - масса одной молекулы, n - концентрация молекул, v - среднеквадратическая скорость молекул газа. Из основного уравнения МКТ вытекает связь давления с кинетической энергией:
, где m0 - масса одной молекулы, n - концентрация молекул, v - среднеквадратическая скорость молекул газа. Из основного уравнения МКТ вытекает связь давления с кинетической энергией: 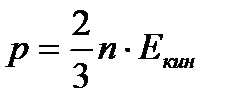
Эта формула показывает, что давление газа зависит от количества молекул в некотором объеме, от их массы, а также скоростей, с которыми они двигаются. Данное уравнение наиболее точно описывает характеристики разреженных газов. Воздух при нормальных условиях является приближенным к идеальному газу. Уравнения были выведены с некоторыми упрощениями:
1. Все молекулы взаимодействуют упруго. В реальных газах часть скорости и энергии теряется за счет передачи импульса стенкам сосуда, в котором находится газ.
2. Использовать уравнения можно только в случае, когда структурные единицы практически не взаимодействуют. Если достаточно увеличить давление и значительно уменьшить температуру, то молекулы будут постоянно взаимодействовать друг с другом.
3. Допустимы пренебрежения размерами и формами структурных единиц.
4. Справедливо для одного вида газа. В реальном воздухе имеется примесь газов, что влияет на массу молекул, которая впоследствии изменяет значение давления.
Абсолютная температура.
Всегда для нас температура была характеристикой теплоты некоторого тела. На самом деле температура характеризуется скоростью движения молекул вещества, в том числе и идеального газа. Чем большую скорость имеет молекула, следовательно, она обладает большей энергией. И наоборот, чем больше кинетическая энергия молекул газа, тем выше температура всего вещества.
Измерять температуру можно с помощью специального проградуированного прибора. Впервые такое средство измерительной техники было предложено Фаренгейтом. За начало измерений была взята температура, при которой тает лед из воды и спирта, соединенные в равных количествах. Заканчивалась шкала температурой, при которой кипит вода. Ведь этот диапазон был разделен на 180 равных частей, каждая из которых отвечала изменению температуры на 1 градус.
В середине 18 столетия ученый Цельсий предложил новую шкалу, начинавшуюся с температуры таяния льда, и заканчивающуюся температурой кипения. Весь диапазон разделил на 100 частей. Данная шкала температур используется до сих пор.
Несмотря на популярность шкалы по Цельсию, за абсолютную шкалу температур во всем мире принимается шкала Кельвина, которая берет свое начало в абсолютном нуле. Абсолютный ноль - 273,15 градуса Цельсия. Так как температура характеризуется скоростью и энергией молекул, то при абсолютном нуле все молекулы прекращают свое движение. Абсолютная температура изменяется в Кельвинах: [Т] = 1К.
Чтобы перейти от температуры в Цельсиях к Кельвинам, следует воспользоваться простой формулой: 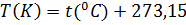 . Например:
. Например: 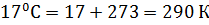 . Данная шкала температур удобна тем, что все величины получаются положительными. Абсолютная температура не может быть отрицательной.
. Данная шкала температур удобна тем, что все величины получаются положительными. Абсолютная температура не может быть отрицательной.
Дата: 2019-07-31, просмотров: 349.