Присоединение хлора по двойной и тройной связям, хлоргидринирование (присоединение НС1О) и гидрохлорирование (присоединение НС1) олефинов, а также замещение хлором водородов ароматического кольца относятся к ионно-каталитическому галогенированию.
Присоединение хлора, а также галогеноводородов к ненасыщенным углеводородам идет достаточно легко, ускоряют эти реакции апротонные катализаторы FeCl3, AICl3 и др. Механизм реакций является электрофильным, идет через образование промежуточных p- и s-комплексов:
 (2.22)
(2.22)
Роль FeCl3 сводится не только к ускорению стадии перехода p- в s-комплекс, но образованием комплекса С1 ® Cl: FeCl3 (присоединение хлора) и металлхлористоводородной кислоты НА1С14 или HFeCl4 (гидрохлорирование), имеющей активный протон.
В процессах присоединения хлора к олефинам побочными продуктами являются полихлориды, что предотвращают применением ингибиторов цепных реакций (кислород).
Реакционная активность олефинов зависит от стабильности промежуточного катиона и уменьшается в следующем ряду:
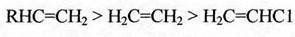 (2.23)
(2.23)
присоединение галогеноводородных кислот к ацетиленовым углеводородам идет последовательно в две стадии:
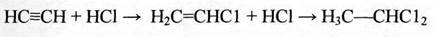 (2.24)
(2.24)
Поэтому гидрохлорирование ацетилена проводят в присутствии селективных катализаторов, ускоряющих только первую стадию. В основном применяют соли двухвалентной ртути (раньше) и одновалентной меди.
Каталитическое действие этих солей объясняют образованием координационных комплексов, в которых ацетилен активируется и взаимодействует с хлоранионами, при этом промежуточно получаются переходные состояния с металл - углеродной связью или металлорганические соединения, быстро разлагаемые кислотой:
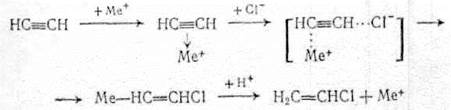 (2.25)
(2.25)
Присоединение галогеноводородных кислот к ненасыщенным углеводородам идет согласно правилу Марковникова, т. е. водород идет к наиболее гидрированному углероду, а хлор - к менее гидрированному.
В промышленности процесс хлорирования осуществляют как в газовой, так и в жидкой фазе.
Газофазное хлорирование
Хлорированием в газовой фазе получают сравнительно небольшое число соединений: хлорпроизводные метана, а также дихлорбутилены/
Газофазное хлорирование проводят при температуре 300-500°С в избытке углеводорода (в целях подавления образования полихлоридов) с рециркуляцией исходного сырья и обязательным предварительным смешением исходных реагентов в специальных смесителях (тангенциального типа), обеспечивающих интенсивное перемешивание смеси.
Особенностью реакторов-хлораторов, применяемых для хлорирования в газовой фазе, является наличие внутренней керамической футеровки, а также автотермичность протекающего в них процесса. Последнее достигается тем, что выделяющееся при реакции тепло расходуется на нагревание смеси до требуемой температуры и на потери в окружающую среду. При этом в зависимости от теплового баланса процесса реагенты в хлоратор подают холодными (например, при синтезе полихлоридов метана) или предварительно подогретыми (при получении аллилхлорида). Причем для сильно экзотермических синтезов полихлоридов метана регулирование температуры возможно за счет впрыскивания жидкого четыреххлористого углерода.
Технология хлорирования в газовой фазе состоит из следующих стадий: подготовки реагентов (испарение жидкого хлора), предварительного нагрева газообразного хлора, осушки реагентов (адсорбентами или H2SO4), смешения исходных реагентов друг с другом и с рециркулятом, хлорирования, очистки реакционной смеси от хлористого водорода, отделения рециркулирующих веществ и выделения целевого продукта.
Жидкофазное хлорирование
Методом радикально-цепного жидкофазного хлорирования получают: полихлорпроизводные метана (1,1,2- и 1,1,1-трихлорэтаны); хлорпарафины (жидкие и твердые); хлорированные полимеры (полиэтиленхлорид, полипропиленхлорид и поливинилхлорид, а также хлоркаучук); хлорпроизводные ароматических углеводородов: (бензилхлорид).
Жидкофазное радикально-цепное хлорирование проводится при температурах от 40 до 150°С в присутствии инициаторов или фотохимически. Обычно жидкофазным хлорированием получают моно- и хлорпроизводные, которые нестабильны при повышенных температурах и практически большинство полихлорпроизводных.
Процесс в жидкой фазе проводится в аппаратах колонного типа, имеющих внутреннее охлаждение, при барботировании хлора через массу исходных углеводородов или их раствор в растворителях (тетрахлоруглерод, о-дихлорбензол); некоторые полимеры хлорируют в водных и других суспензиях.
Подача реагентов осуществляется противотоком. Для повышения селективности процесса применяют секционирование реактора.
При хлорировании низкокипящих веществ внутреннее охлаждение отсутствует, так как теплосъем осуществляется за счет испарения этих веществ.
Существенное влияние на показатели процесса оказывают соотношение исходных реагентов, температура, концентрация инициатора и интенсивность облучения.
При фотохимическом хлорировании температура процесса не выше 40-60°С, применяется отвод тепла реакции циркулирующей водой.
При использовании химических инициаторов хлорирование проводится при температуре разложения инициатора.
Расход инициатора зависит от молекулярной массы исходного углеводорода, количества вводимого хлора и температуры реакции.
Расход инициатора можно уменьшить, вводя его отдельными порциями во времени (при периодическом процессе) или по длине реактора (при непрерывном процессе).
Технология жидкофазного радикально-цепного хлорирования состоит из тех же стадий, что и при газофазном хлорировании.
Дата: 2019-07-30, просмотров: 595.