Создание безотходных технологий производства хлорорганических продуктов - одно из главных требований, предъявляемых при разработке современных процессов. Проблема уменьшения отходов, как правило, решается в двух направлениях: за счет повышения селективности процесса, т. е. применения соответствующих каталитических систем и оптимальных условий проведения процесса; с другой стороны за счет рациональной переработки образующихся отходов.
Основные используемые методы переработки хлорорганических отходов - огневое обезвреживание, хлорирование при повышенных температурах и хлоролиз (хлорирование при повышенной температуре и давлении).
Самый распространенный метод - огневое обезвреживание, сущность которого заключается в высокотемпературном (1100-1800°С) окислении за счет теплоты сгорания отходов и тепла, выделяющегося при сгорании дополнительного количества топлива (в случае малой теплотворной способности отходов). В процессе работы отходы практически полностью превращаются в НС1, С12, СО2, Н2О. Достоинство метода - относительная простота, незначительные капитальные вложения. В установках можно обезвреживать практически все виды отходов. Недостатки метода - полная потеря углеродной части отходов (превращение в СО2); трудность использования НС1, выделяемого в виде загрязненной соляной кислоты. Ввиду этого часто проводят просто нейтрализацию кислоты; в этом случае теряется и хлор, содержащийся в отходах, а также образуется большое количество дополнительных солевых стоков; в случае нарушения режима возможно неполное сгорание отходов с образованием высокотоксичных соединений.
Исчерпывающее хлорирование как самостоятельный процесс или в сочетании с окислительным хлорированием является по сравнению с процессом сжигания более эффективным методом переработки, поскольку отходы превращаются в ценные хлорорганические продукты — четыреххлористый углерод, три- и тетрахлорэтены. Исчерпывающее хло рирование (или так называемый хлоролиз) алифатических углеводородов и их хлорпроизводных, осуществляемый при температуре 450-600°С и давлении 0,1-0,3 МПа, приводит к образованию перхлоруглеводородов: четыреххлористого углерода, тетрахлорэтена, гексахлорэтана, гексахлорбутадиена, гексахлорциклопентадиена и гексахлорбензола. Ароматические и жирноароматические соединения в этом случае превращаются в основном в гексахлорбензол, который далее разлагается в очень жестких условиях. В зависимости от вида отходов степень использования отходов составляет 90 %. В процессе хлоролиза одновременно протекает множество последовательно-параллельных реакций хлорирования, дехлорирования, дегидрохлорирования, разрыва углеродных связей, диспропорционирования. В условиях промышленного хлоролиза, осуществляемого при температуре 600°С в объеме или в псевдоожиженном слое (например, песка), в тетрахлорэтен и четыреххлористый углерод могут быть переработаны в основном хлорпроизводные, содержащие до четырех атомов углерода в молекуле. Суммарно процесс хлоролиза для хлоруглеводородов предельного ряда описывается следующими уравнениями:
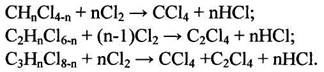 (1.12)
(1.12)
К недостаткам этого процесса можно отнести прежде всего ограниченность ассортимента перерабатываемых отходов, в основном C1-С4. При переходе к отходам, содержащим 4 и более атомов углерода, резко возрастает количество вторичных отходов, которые необходимо подвергать термическому обезвреживанию или захоронению. Переработка полихлоридов С6 этим методом практически невозможна.
Осуществление хлоролиза при высоких давлениях (до 20 МПа) и температурах (600 °С) позволяет перерабатывать в четыреххлористый углерод любые углеводороды и хлоруглеводороды, в том числе и ароматические. В процессе хлоролиза, разработанном фирмой "Hochst", образующийся хлорид водорода, выделяемый ректификацией под высоким давлением, имеет высокую степень чистоты и может быть направлен в процессы гидрохлорирования и оксихлорирования. Основные трудности при реализации и эксплуатации этого процесса связаны с довольно сложным аппаратурным оформлением технологической схемы и применением дорогостоящих конструкционных материалов. Все рассмотренные выше процессы переработки отходов связаны с образованием большого количества хлорида водорода, который можно использовать для процессов гидрохлорирования, оксихлорирования, а также для получения соляной кислоты. При переходе на метод окислительного хлорирования отходов сокращается потребление хлора и соответственно практически исключается образование хлорида водорода.
Наиболее интересна разработка сбалансированного процесса переработки отходов, включающего стадии прямого и окислительного хлорирования. На рис. 1.3 представлены варианты раздельного и совмещенного процессов прямого и окислительного хлорирования. Процесс прямого хлорирования ведут в объеме или псевдоожиженном слое кварцевого песка при температуре 500-600°С. Процесс оксихлорирования может осуществляться в псевдоожиженном или стационарном слое катализатора на основе хлорида меди при температуре 350-450°С. К достоинствам совмещенного процесса относится сокращение в 2-3 раза расхода хлора и отсутствие побочного НС1; к недостаткам - сгорание части отходов до оксидов углерода и более сложное аппаратурное оформление по сравнению с процессом прямого хлорирования. Предполагаемые расходные коэффициенты на 1 т отходов: хлора, т - 0,6-0,8 (в случае переработки отходов производства винилхлорида); электроэнергия, кДж - 6,47×105; пар, кДж - 2,1×106 - 8,37×106. В последнее время привлекают внимание технологов такие эффективные методы переработки отходов, как плазмохимический и электрокрекинг. Эти методы имеют степень превращения углеродного сырья в этилен и ацетилен и хлора в НС1, близкую к 100 %.
В плазмохимическом методе в качестве теплоносителя используется водород или его смесь с другими газами, нагретыми в электрической дуге до температуры, при которой молекулы и атомы ионизируются. В результате получается низкотемпературная плазма с температурой 3500-5000 К, которая смешивается с отходами. В процессе реакции происходит превращение углерода в непредельные соединения (этилен, ацетилен), метан, и технический углерод; хлора - в хлорид водорода, кислорода - в оксиды углерода, т. е. полученный газ является сырьем для синтеза хлорорганических продуктов. Варьируя состав сырья и режим пиролиза, можно изменять мольное отношение ацетилена и этилена в широких пределах: 0,5-4. Такой состав газов позволяет создавать технологию производства хлорорганических продуктов, сбалансированную по хлору без использования стадии оксихлорирования, и тем самым исключить образование побочного хлорида водорода и потери углеводорода и водорода.
Переработка хлорорганических отходов
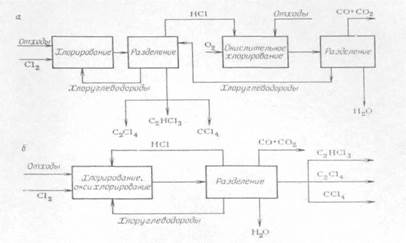
Рис. 1.3.
а) получение перхлоруглеводородов прямым и окислительным хлорированием;
б) получение перхлоруглеводородов совмещением прямого и окислительного хлорирования.
При электрокрекинге, т. е. в условиях электрического разряда, создаваемого в жидких диэлектриках, каковыми являются большинство органических, в том числе и хлорорганических соединений, жидкие продукты разлагаются с получением крекинг-газа, содержащего до 30 % ацетилена, 8-10 % этилена и других олефинов, предельные углеводорода и хлорид водорода. Применяя высоковольтные и низковольтные источники питания, в определенных условиях можно добиться высокой стабильности электрической дуги и, следовательно, непрерывного процесса в течение длительного времени. Несомненным преимуществом процесса электрокрекинга в жидкой среде является доступность конструкционных материалов для изготовления основного агрегата, так как высокая температура (тысячи и десятки тысяч градусов) развивается в межэлектродном пространстве, а температура стенки равна температуре окружающей среды вне реактора.
Примером утилизации отходов методом электрокрекинга может быть процесс получения винилхлорида из легкой бензиновой фракции, сопровождающийся образованием органических отходов на стадии крекинга и хлорорганических на стадиях производства винилхлорида (из ацетилена и этилена через дихлорэтан). В этом случае может быть создано безотходное производство, полностью сбалансированное по углеродному и хлорному сырью. Главным недостатком плазмохимического метода переработки отходов и электрокрекинга по сравнению с более традиционными методами является высокий расход электроэнергии.
Приведенные выше примеры переработки отходов в товарные продукты или исходное углеводородное и хлорное сырье могут входить в состав разрабатываемых сбалансированных схем производств хлорорганических продуктов в самых различных вариантах, в зависимости от конкретных требований и специфики данного процесса.
Хлорирование метана
Первые работы по хлорированию метана в псевдоожиженном слое катализатора относятся к середине шестидесятых годов. Было показано, что в кипящем слое различных катализаторов (активный уголь, пемза, кварцевый песок и т. д.) в интервале температур 250-500°С и стехиометрическом соотношении Сl2:СН4 равном 4, идет преимущественное образование четыреххлористого углерода СС14. В результате изучения влияния температуры, соотношения реагентов и природы катализатора на состав реакционного продукта были выбраны условия (температура 350-360°С, мольное соотношение С12:СН4 = 3,6:1, катализатор - активный уголь), обеспечивающие выход СС14 не менее 90 %.
В лаборатории и на опытно-промышленной установке в реакторе диаметрам 400 мм отработан процесс получения ССl4 в псевдоожиженном слое пемзы и кварцевого песка. Проверка в опытно-промышленном реакторе показала, что пемза из-за быстрого обуглероживания поверхности и комкования частиц имеет ограниченный срок службы: уже через 20 часов наблюдается заметное падение активности катализатора. Использование в качестве катализатора кварцевого песка более предпочтительно, так как за период испытаний в течение 1500 часов падения активности не наблюдалось. В результате проведенных работ было показано, что при температуре 360-370°С и соотношении Cl2:CH4 = 3,7±0,1:1 достигается практически полное связывание хлора, а выход ССl4 не менее 70 %.
На основании комплекса лабораторных и опытных исследований выполнено математическое моделирование процесса хлорирования метана в псевдоожиженном слое катализатора. Расчет процесса по двухфазной модели и сравнение с экспериментальными данными, полученными в опытном реакторе диаметром 600 мм, показали, что при температуре 360-390 °С и соотношении С12:СН4 = 3,7-3,8 :1 имеет место полное связывание хлора; содержание ССl4 в реакционном продукте составляет не менее 90 % (масс).
Помимо проведения реакции исчерпывающего хлорирования метана до ССl4 представляло интерес выявить возможность преимущественного получения метиленхлорида и хлороформа. С этой целью был выполнен большой объем исследований по изучению реакции хлорирования метана и его хлорпроизводных в псевдоожиженном слое силикагеля, активного угля и кварцевого песка. В температурной области 250-450°С были изучены основные кинетические закономерности реакции, получены уравнения скорости хлорирования метана и его хлорпроизводных и определены параметры уравнений. Это позволило оценить реакционную способность метана и хлорметанов. В зависимости от вида катализатора она имеет вид:
на кварцевом песке СН3С1 > СН2С17 >СН4>СНС13,
на активном угле СН3С12 > СНС13 >СН3С1>СН4.
На основании полученных значений констант скоростей хлорирования было показано, что для исчерпывающего хлорирования метана до ССl4 целесообразно в качестве катализатора использовать активный уголь, а для ограниченного хлорирования - песок и силикагель. Следует отметить, что кинетические данные, полученные разными авторами, достаточно противоречивы. Это можно видеть на примере соотношения констант скоростей хлорирования метана и хлорметанов, полученных при хлорировании на песке: k1:k2:k3:k4 - 1,0:2,5:1,4:0,6 и 1,0:2,0:1,0:0,5. С целью уточнения кинетики и механизма реакции хлорирования выполнено исследование этой реакции в проточно-циркуляционной установке. Реакцию хлорирования изучали при температурах 275-400°С в присутствии большой группы контактов, различающихся макроструктурой и химической природой: кварц, перлит, кокс, силикагели и др. Для сравнения были проведены исследования реакции термического хлорирования и фотохлорирования. Выполненные исследования для реакции термического хлорирования подтвердили литературные данные, а для фотохлорирования и каталитического получены одинаковые закономерности: дробный порядок по метану (0,5-0,6) и близкий к первому порядок по хлору (0,8-1,0). Энергия активации в зависимости от природы контакта изменяется от 100 до 117 кДж/моль.
Установлено, что реакция хлорирования в присутствии пористых контактов протекает по гетерогенно-гомогенному механизму с генерацией атомарного хлора поверхностью контакта.
Хлорирование метана возможно и в присутствии хлоридов металлов, нанесенных на пористый носитель. Как правило, используют хлориды металлов переменной валентности. Использование таких катализаторов снижает энергию активации процесса, повышает его скорость и выход продуктов глубокого хлорирования. Каталитические свойства таких систем связывают с их способностью к генерированию атомарного хлора.
Большое внимание было уделено изучению зависимости процесса хлорирования от фактора масштабного перехода, что особо важно для процессов в псевдоожиженном слое. Так, при увеличении диаметра аппарата наблюдалась неудовлетворительная воспроизводимость лабораторных данных по конверсии реагентов и составу хлорметанов, а также по увеличению выхода побочных продуктов и сажеобразования. Сопоставление данных, полученных в реакторах различного диаметра (от 50 до 600 мм), изучение плотной и пузырьковой фазы псевдоожиженного слоя позволило авторам предположить наличие локальных перегревов не в пузырях, а в плотной фазе, так называемых «сгущениях» частиц, и в связи с этим предложить трехфазную модель псевдоожиженного слоя.
Дата: 2019-07-30, просмотров: 326.