К этому методу относятся следующие реакции: дехлорирование:
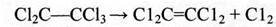 (2.8)
(2.8)
дегидрохлорирование:
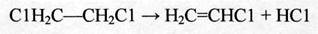 (2.9)
(2.9)
расщепление связи С-С под влиянием хлора (хлоролиз):
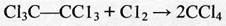 (2.10)
(2.10)
и высокой температуры (пиролиз):
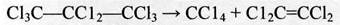 (2.11)
(2.11)
Все процессы галогенирования по механизму делятся на две группы: радикально-цепные и ионно-каталитические.
Парафиновые углеводороды независимо от молекулярной массы хлорируются путем последовательного замещения атомов водорода на хлор. Низшие олефиновые углеводороды хлорируются радикально-цепным путем преимущественно в газовой фазе.
При этом конкурируют две реакции: присоединение хлора по двойной связи и замещение атомов водорода:
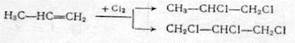 (2.12)
(2.12)
С увеличением длины углеводородной цепи и повышением температуры роль реакций присоединения уменьшается. Заместительное хлорирование с повышением температуры предпочтительно протекает в наиболее реакционноспособное аллильное положение. Ароматические углеводороды хлорируются радикально-цепными путями даже в отсутствие катализаторов ионных реакций FeCl3, A1C13, а также соответствующих металлов, что ограничивает выбор материала аппаратуры. При этом конкурируют три вида реакций: замещение в боковую цепь, замещение в кольцо и присоединение по С-С связи кольца.
Для алкилароматических углеводородов замещение предпочтительно идет в а-положение с последовательным замещением атомов водорода.
При пониженных температурах наблюдается присоединение хлора по С-С связи кольца, а при повышенных идет замещение в кольцо.
Все рассматриваемые процессы относятся к неразветвленным цепным реакциям, протекающим через промежуточное образование радикалов и свободных атомов.
В соответствии с применяемым способом инициирования реакции существует термическое, фотохимическое, инициированное и каталитическое хлорирование.
Первым актом зарождения цепи является гемолитическая диссоциация молекулы хлора на атомы.
Термическое хлорирование
Осуществляется в газовой фазе под действием тепла. Для этого требуется нагревание до 250°С; при такой температуре становится заметной диссоциация молекул хлора на атомы с участием стенки или насадки:
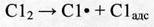 (2.13)
(2.13)
При сравнительно низких температурах образование свободных атомов происходит в основном за счет взаимодействия хлора с углеводородом:
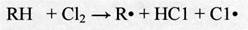 (2.14)
(2.14)
Чем менее реакционноспособны углеводороды, тем выше должна быть температура, так как образование свободных органических радикалов связано с разрывом связи С-Н в молекуле углеводорода. Например, температура хлорирования бутана составляет около 250°С, а для термического хлорирования метана требуется 400°С. Энергия активации термического хлорирования равна 125 кДж/моль.
Термическое хлорирование при высоких температурах может сопровождаться побочными реакциями, деструкцией молекул, дегидрохлорированием и циклизацией.
Фотохимическое хлорирование
При этом способе реакция инициируется светом, действие которого наиболее эффективно в коротковолновой части спектра. В этом случае молекулы хлора диссоциируют под влиянием фотонов или квантов энергии /6/:
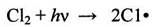 (2.15)
(2.15)
в качестве источника которых применяются ртутные лампы, излучающие свет длиной волны 1650-5500 А. Если реакционные устройства сделаны из плавленого кварца, можно использовать лучи с длиной волны 1650 А, если же реактор выполнен из стекла пирекс или из обычного стекла, можно использовать лишь лучи с длинами волны более, 3000-3500 А. Для многих реакций фотохимического хлорирования достаточно уже видимого света с длиной волны 4000-5000 А, для чего применяются обычные мощные лампы. Эффективность действия излучения характеризуется квантовым выходом, т. е. числом прореагировавших молекул на один квант поглощенной энергии.
Цепная реакция фотохимического хлорирования протекает с большой скоростью при невысоких температурах в жидкой или паровой фазе, а направление реакции часто бывает иным, чем при термическом хлорировании. Энергия активации при фотохимическом хлорировании равна 42 кДж/моль, т. е. примерно в 2,5-3 раза ниже, чем при термическом хлорировании.
Реакция фотохимического хлорирования ингибируется (замедляется) некоторыми примесями, которые связывают атомы хлора и обрывают цепь. К таким ингибиторам относится, например, кислород, который с атомами хлора образует оксид хлора:
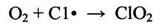 (2.16)
(2.16)
Однако кислород тормозит реакцию лишь при низких температурах, а при 350-400°С он уже не оказывает заметного действия, что связано с переходом к другому механизму /6/.
Дата: 2019-07-30, просмотров: 329.