Факультет инженерно-экономический
Кафедра технологии нефтехимического синтеза и переработки полимерных материалов
РАСЧЕТНО-ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
к курсовому проекту
по курсу: «Технология и оборудование основного органического и нефтехимического синтеза»
на тему:«Производство тетрахлорметана и тетрахлорэтилена мощностью 40000 т/год»
Разработал:
студент 3 курса 1 гр.
Жиренков М.В.
Проверил:
ст. преп. Юсевич А.И.
Минск 2006 г.
РЕФЕРАТ
Пояснительная записка содержит 45 стр., 7 рис., 6 табл., 8 литературных источников, 1 лист графического материала формата А1.
Тетрахлорметан, Тетрахлорэтилен, хлорирование, хлоратор, хлороводород, перхлоруглеводород.
Цель работы – изучить производство тетрахлорметана и тетрахлорэтилена.
Объект проектирования – технология производства тетрахлорметана и тетрахлорэтилена.
В работе приведено описание основных методов получения тетрахлорметана и тетрахлорэтилена, химизма и физико-химических основ производства, приведено подробное описание технологической схемы производства тетрахлорэтана и тетрахлорэтилена, выполнен расчет материального и теплового балансов.
СОДЕРЖАНИЕ
Введение
1.Аналитический обзор
1.1 Получение тетрахлорметана
1.2 Получение тетрахлорэтилена
1.3 Переработка хлорорганических отходов. Производство перхлоруглеводородов
1.4 Хлорирование метана
1.5 Условия процесса и типы реакторов
1.6 Рекомендуемые материалы для оборудования процессов получения хлорорганических соединний
1.7 Современный патентный обзор
2. Технологическая часть
2.1 Химизм процесса
2.1.1 Методы замещения (субститутивное галогенирование)
2.1.2 Методы присоединения (аддитивное галогенирование), галогенирующие агенты
2.1.3 Метод расщепления галогенпроизводных
2.1.4 Термическое хлорирование
2.1.5 Фотохимическое хлорирование
2.1.6 Хлорирование в присутствии свободных радикалов
2.1.7 Ионно-каталитическое хлорирование
2.1.8 Газофазное хлорирование
2.1.9 Жидкофазное хлорирование
2.2 Описание технологической схемы
2.3 Технико-технологические расчеты
2.3.1 Расчет материального баланса
2.3.2 Расчет закалочной колонны КЛ1
2.3.3 Тепловой расчет хлоратора
Заключение
Список использованной литературы
ВВЕДЕНИЕ
Производство органических веществ зародилось давно, но первоначально оно базировалось на переработке растительного или животного сырья – выделение ценных веществ (сахар, масла) или их расщепление (мыло, спирт и др.). Органический синтез, т. е. получение более сложных веществ из сравнительно простых, зародился в середине XIX века на основе побочных продуктов коксования каменного угля, содержавших ароматические соединения. Затем, уже в XX веке как источники органического сырья все большую роль стали играть нефть и природный газ, добыча, транспорт и переработка которых более экономичны, чем для каменного угля. На этих трех видах ископаемого сырья главным образом и базируется промышленность органического синтеза /1/.
Промышленный хлорорганический синтез, развивающийся значительными темпами, позволяет получать широкий ассортимент хлорсодержащих органических продуктов, которые находят применение во всех отраслях народного хозяйства. Среди хлорорганических продуктов большое значение имеют тетрахлорметан (четыреххлористый углерод) и тетрахлорэтилен (перхлорэтилен).
Тетрахлорметан является промежуточным продуктом при получении хладона-11 и хладона-12, вспенивателей в производстве пластмасс; используется для извлечения металлов из пирита, протравливания семян и других целей. перхлорэтилен применяется в текстильной промышленности, для обезжиривания металлов, химической очистки одежды, в производстве хладона-113.
Поэтому тема данной курсовой работы «Производство тетрахлорметана и тетрахлорэтилена мощностью 40000 т/год» является весьма актуальной.
Аналитический обзор
Получение тетрахлорметана
Наиболее старым методом получения ССl4 является «сероуглеродный», в основе которого лежит следующая последовательность реакций /1, 2/:
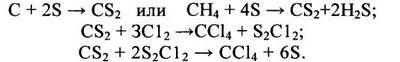 (1.1)
(1.1)
Сероуглерод образуется при взаимодействии серы (900°С) с кипящим слоем углерода или с метаном (600°С) в присутствии SiО2 и Al2O3 в качестве катализаторов с выходом до 95%. Хлорирование сероуглерода хлором ведут при 60°С в присутствии катализатора сурьмы, а хлорирование монохлоридом серы – на железных опилках. Высокая селективность процесса и чистота целевого продукта, отсутствие затрат на ректификацию для выделения ССl4 выгодно отличают этот метод от других методов получения четыреххлористого углерода. Однако из-за многостадийности, больших энергетических затрат, а также повышенной пожаро- и взрывоопасности и тяжелых санитарно-гигиенических условий труда в настоящее время метод не представляет промышленного интереса.
|
|
но промышленной ценности он не представляет. Исчерпывающее прямое хлорирование метана в одну стадию /1/
Принципиально возможен синтез CCl4 из фосгена /2/:
|
|
на практике осложняется, что связано с взрывоопасностью смесей метан – хлор, взятых в стехиометрическом соотношении, а также с необходимостью отвода большого количества тепла. При температуре 400°С, мольном отношении С12:СН4, равном 1:2, и рециклизации низкохлорированных производных метана СС14 является одним из основных продуктов процесса. Возможно получение ССl4 хлорированием метана в кипящем слое катализатора.
Имеются сведения о получении СС14 окислительным хлорированием метана при 375-455°С под давлением с использованием расплава катализатора СuО-СuС12 /2/:
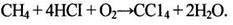 (1.4)
(1.4)
Для уменьшения коррозии внутренняя поверхность реактора и его насадка выполнены из керамики. Четыреххлористый углерод образуется с высоким выходом. Эксплуатационные расходы процесса «Transcat»/3-6/ на 1 т СС14: метан – 0,14 т; хлороводород – 0,95 т; электроэнергия – 260 кВт×ч; топливо – 280 ГДж; водяной пар – 2,6 т; охлаждающая вода – 242 м.
СС14 можно получить окислительным хлорированием хлорпроизводных пропана смесью хлора и кислородсодержащего газа при 250-450°С в присутствии катализатора цеолита в Са2+-форме с окклюдированным хлорид-ионом.
Четыреххлористый углерод получают совместно с тетрахлорэтиленом термическим хлорированием пропан-пропиленовой фракции хлорпропанов, а также хлорорганических отходов при 400-550°С /5, 6/:
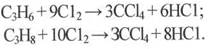 (1.5)
(1.5)
Полученный по такому способу СС14 отличается высокой чистотой. Расход сырья на 1 т СС14: хлор – 1,56 т; С3-фракция – 0,102 т. Побочно образуется 0,585 т НС1, из которого получают товарную хлороводородную (соляную) кислоту.
Принципиальная схема получения СС14 при высоких температурах и давлениях приведена на рис. 1.1.
Принципиальная схема получения СС14 при высоких температурах и давлениях
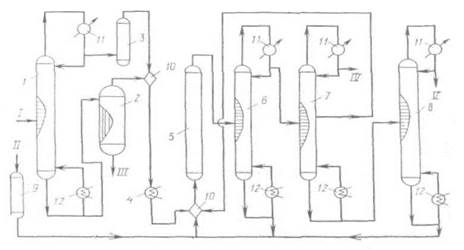
Рис. 1.1.
1, 6, 7, 8 - ректификационные колонны; 2 - испаритель; 3, 9 -осушители; 4- подогреватель; 5 - реактор; 10 - смеситель; 11 -холодильник; 12 - кипятильник. I - хлорированные углеводороды; II - хлор; III - сажа, смола; IV - хлороводород; V-CC14.
При усовершенствовании процесса хлоролиза для получения СС14 рекомендован ввод сырья в реактор через сопло с трубкой, которая всасывает реакционную смесь. При этом достигается высокая производительность при относительно небольшом избытке хлора (10-50%).
Перед входом в реактор хлоролиза 5 (рис. 1.1) хлорсодержащие соединения делят предварительно на легкие и тяжелые фракции в колонне ректификации 1. Легкие фракции сушат (3) над алюмогелем или силикагелем, а тяжелые отделяют от сажи и смол в пленочном испарителе 2. После осветления указанные фракции объединяют, подогревают (4) и подают в смеситель 10, где смешивают с высушенным в аппарате 9 хлором. Хлоролиз при 550-600°С и 18-20 МПа приводит к образованию, в основном, ССl4. С верха колонны 7 отводят НСl, из средней части колонны 7 отводят смесь CCl4 и НС1 и направляют на рециркуляцию, как и кубовый остаток колонны 5.
Товарный ССl4 выделяют сверху колонны 5. Удельный расход сырья (хлорпроизводные С3) и энергоресурсов на 1 т целевого продукта (ССl4:С2Сl4 = 1:1): хлоруглеводороды - 0,6 т; хлор - 1,8 т; электроэнергия 150 кВт×ч; водяной пар – 17 ГДж. Установка производит 0,5 т хлороводородной кислоты на 1 т четыреххлористого углерода.
Для получения смеси хлорметанов большой интерес представляет процесс окислительного хлорирования метана, осуществляемый в «кипящем» или неподвижном слое катализатора /6/. Реакцию проводят при 380-450°С; при более высокой температуре происходят побочные реакции глубокого окисления и, кроме того, усиливается коррозия оборудования. Оптимальная температура процесса окислительного хлорирования метана равна 360-380°С при времени контакта 5-15 с. Суммарный выход хлорметанов в расчете на прореагировавший метан при температуре 380°С, времени контакта 5 с и мольном соотношении СН4:НС1:О2 = 1:1:1 составляет 62-85%. а выход продуктов глубокого окисления - от 15 до 5%.
Поскольку окислительное хлорирование метана сопровождается сильноэкзотермичной побочной реакцией глубокого окисления, особую трудность при технологическом оформлении составляет эффективный теплосъем. При работе в неподвижном слое катализатора возникают труднорегулируемые «горячие» точки, для устранения которых рекомендуется помещать катализатор в порядке повышения содержания активной массы по ходу движения реакционного потока. К недостаткам «кипящего» слоя следует отнести большой унос активной массы, слипание частиц катализатора, повышенный выход продуктов глубокого окисления хлорметанов.
При проведении процесса в расплаве солей конверсия метана составляет лишь 15—20%, а в реакционной смеси преобладает метилхлорид. Процесс отличается большой сложностью, в связи с чем, по-видимому, никогда не будет реализован в промышленности.
Технико-экономическое сравнение методов получения хлорметанов показывает, что перспективными схемами их производства являются следующие /7/: 1) из метанола и хлора через стадию получения метилхлорида; 2) комбинация прямого и окислительного хлорирования метана.
Мощность технологической линии составляет до 80 тыс. т хлорметанов в год. Единичная мощность агрегатов: прямого хлорирования – 12-14 тыс. т; окислительного хлорирования – 5-15 тыс. т; получения метилхлорида – 10-20 тыс. т. Удельный расход сырья по «метанольному» способу: метанола – 0,383 т/т; хлора – 0,847 т/т (СН2С12 - 11,8%; СНС13 - 58,8%; СН4 - 28,4%); по метановому способу («сбалансированная» по хлору схема): метана – 1,17 т/т; хлора – 0,89 т/т, что более чем вдвое меньше по сравнению с прямым хлорированием метана. Расход электроэнергии 0,113 т×кВт×ч и 0,280 т×кВт×ч соответственно.
Четыреххлористый углерод – наиболее крупнотоннажный продукт из хлорпроизводных метана.
Мощности по четыреххлористому углероду в 1981 г. составили в Западной Европе, США и Японии соответственно 250, 380 и 70 тыс. т. Производство в США в 1987 г. было на уровне 305,9 тыс. т, а в 1988 - 344,7 тыс. т. Потребность в четыреххлористом углероде в 1983 г. составила для Западной Европы 250 тыс. т, для США - 250 тыс. т и для Японии - 75 тыс. т (табл. 1.1).
Таблица 1.1.
Структура потребления галогенпроизводных в 1983 г.
| Западная Европа | США | Япония | |
| Фреоны 11 и 12, % | 94 | 92 | 90 |
| Растворитель для химических реакций, % | 6 | 8 | 10 |
Как видно из этих данных, основным потребителем CCl4, определяющим темпы развития производства этого продукта, является промышленность фторхлоруглеродов (F-11 и F-12), которые используются в качестве пропеллентов в аэрозольных упаковках и хладоагентов:
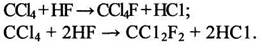 (1.6)
(1.6)
Сейчас наблюдается уменьшение спроса на СС14, что объясняется в основном введением строгих ограничений на использование фторхлоруглеродов в аэрозольных упаковках, поскольку показано, что эти соединения, как и сам СС14, разрушают озоновый слой.
Используется СС14 также как средство для тушения пожаров, для обезжиривания металлов, получения фумигантов, извлечения металлов из руд.
Определенный интерес представляет синтез w-аминокарбоновых кислот на основе реакции теломеризации:
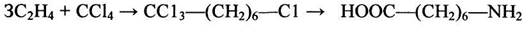 (1.7)
(1.7)
Процесс проводят при 100°С под давлением в присутствии химических инициаторов; w-аминоэнантовая кислота при поликонденсации образует полиамидную смолу, из которой получают волокно «энант», превосходящее по многим эксплуатационным показателям капроновую нить.
Получение тетрахлорэтилена
Тетрахлорэтилен образуется при высокотемпературном хлорировании дихлорэтана или хлорорганических отходов С3:
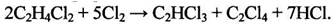 (1.8)
(1.8)
Оксихлорирование полихлоридов С2-С3 также приводит к получению и тетрахлорэтиленов:
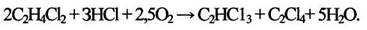 (1.9)
(1.9)
Современное производство хлорорганических растворителей, таких как тетрахлорэтилен, базируется на этилене, пропан-пропиленовой фракции и, в меньшей степени, этане. Методы, основанные на использовании ацетилена, в значительной мере устарели, однако до настоящего времени они осуществляются в промышленности. Совмещение процессов гидро- и дегидрохлорирования позволяет создать сбалансированную по хлороводороду технологическую схему, поэтому при наличии дешевого ацетилена данный способ может конкурировать с другими. Существенную роль в структуре сырьевой базы играют хлорорганические отходы производства винилхлорида, дихлорэтана, аллилхлорида, эпихлоргидрина и ряда других хлорорганических производств.
В целом процесс получения тетрахлорэтилена включает стадии высокотемпературного хлорирования (хлоролиз), дегидрохлорирования соответствующих хлорэтанов. Поскольку на каждой стадии образуется хлороводород, для создания сбалансированной по НС1 схемы последний целесообразно комбинировать со стадией гидрохлорирования или оксихлорирования.
Высокотемпературному хлорированию обычно подвергаются хлорорганические отходы C1-С4. Процесс протекает при 500-650°С в полом реакторе или в реакторе с псевдоожиженным слоем катализатора.
Перхлорэтилен получают также одновременно с четыреххлористым углеродом хлоролизом хлорорганических отходов С3, например отходов производства аллилхлорида. Процесс хлоролиза осуществляется при 500°С в избытке хлора. Основными недостатками процесса хлоролиза являются образование побочных хлористого водорода, гексахлорбензола и сажи. При хлоролизе протекает реакция:
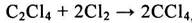 , (1.10)
, (1.10)
которая позволяет регулировать отношение между четыреххлористым углеродом и тетрахлорэтиленом.
Процессы получения тетрахлорэтилена на базе этилена осуществляются двумя способами. Первый способ - двухстадийный, на первой стадии которого прямым хлорированием этилена при температуре 136°С получают смесь тетра- и пентахлорэтанов, на второй - их подвергают высокотемпературному пиролизу с образованием тетрахлорэтилена. Расход тепловой энергии при термическом дегидрохлорировании сопоставим с расходом тепловой энергии дегидрохлорирования по известковому методу.
Стадия дегидрохлорирования хлорэтанов осуществляется в присутствии инициатора или катализатора. Ряд авторов, с целью создания сбалансированной по хлороводороду схемы, предлагают проводить процесс дегидрохлорирования в присутствии кислорода, условно называя этот процесс «окислительным дегидрированием» /7/:
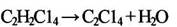 (1.11)
(1.11)
Реакция протекает в присутствии традиционного катализатора СuС12×КС1/носитель или МnО2 Предлагаемый способ дегидрохлорирования является весьма перспективным. Недостатком способа получения тетрахлорэтилена на основе этилена является потеря хлора в виде неутилизируемого хлороводорода. Поэтому более целесообразно проводить двухстадийный процесс следующим образом: на первой стадии методом окислительного хлорирования этилена при 200-230°С в кипящем или стационарном слое катализатора получать 1,2-дихлорэтан, а затем на второй стадии подвергнуть его высокотемпературному хлорированию. Таким образом удается утилизировать часть хлороводорода. Большой интерес представляет другой способ получения тетрахлорэтилена - одностадийное окислительное хлорирование углеводородов С2. Для производства тетрахлорэтилена часто применяют не сам этилен, а его хлорпроизводные, например 1,2-дихлорэтан. По разработке фирмы «PPG, Industries Inc.» /7/ процесс окислительного хлорирования 1,2-дихлорэтана проводят в трубчатом реакторе с псевдоожиженным слоем катализатора. Температура процесса поддерживается за счет кипящей в межтрубном пространстве жидкости. Тепло реакции используется для получения пара, необходимого для самого процесса.
В настоящее время ведутся интенсивные работы по повышению селективности данного процесса. Введение хлоридов редкоземельных элементов позволяет снизить выход продуктов глубокого окисления в 3 раза. Для повышения селективности процесса окислительного хлорирования 1,2-дихлорэтана применяют непрерывную подачу в реакционную зону 1,1,2-трихлорэтана. Образованию продуктов глубокого окисления способствуют местные перегревы, для устранения которых в работе процесс проводят в присутствии катализатора, содержащего хлорид меди с добавлением фосфата щелочного металла. В работах снижение выхода продуктов глубокого окисления достигается секционированной подачей кислорода, благодаря чему по мере прохождения кислорода по слою катализатора в реакцию вступают все более хлорированные углеводороды. Выявлению причин образования продуктов глубокого окисления в научно-технической литературе посвящено лишь небольшое число публикаций.
Окислительному хлорированию с целью получения четырех-хлористого углерода и тетрахлорэтилена подвергается смесь углеводородов C1-C4, хлоруглеводородов С3 и хлоруглеводородов С4-С6. В отличие от хлоролиза хлоруглеводородов С3, приводящего к образованию эквимольной смеси СС14 и C2HCl3, состав продуктов окислительного хлорирования существенно зависит от используемого катализатора.
Перечисленные способы окислительного хлорирования основаны на использовании в качестве хлорирующего агента смеси HCl-газа и кислорода. Ввиду неполной конверсии НС1, а также его образования при окислении и дегидрохлорировании хлоруглеводородов этот газ содержится в конечных продуктах, что создает проблему утилизации абгазного НС1 или загрязненной хлоруглеводородами HCl-кислоты. Вовлечение этой кислоты в процесс окислительного хлорирования несомненно представляет практический интерес, поскольку до настоящего времени она не находит сбыта и загрязняет окружающую среду. В процессе окислительного хлорирования с получением три- и тетрахлорэтилена могут быть использованы хлоруглеводороды C1-С3. При использовании 1,2-дихлорэтана катализатором процесса является цеолит с содержанием 4% (мас.) Сu2+ и 2,5% К+. Процесс протекает при температуре 400 °С, мольном отношении реагентов C2H4Cl2:O2:HCl:H2O = = 1:1,4:1,2:5,6 и времени контакта 10-25 с. Процесс характеризуется ровным температурным профилем по длине реактора и достаточно высокой селективностью.
Оксихлорированне полихлоридов С3 с образованием четыреххлористого углерода и тетрахлорэтилена сопровождается процессами глубокого окисления, а распределение продуктов, а именно хлорметанов и хлорэтиленов, зависит от используемой каталитической системы. Перераспределение между хлорметанами и хлорэтиленами, очевидно, связано с возможностью превращения хлорпроизводных C1 в хлорпроизводные С2 или их различной реакционной способностью в реакции окисления. Изучался процесс окисления в железной, цинковой и медной трубках хлорпроизводных углеводородов, реакционная способность которых в реакции окисления оценивалась по количеству образовавшегося фосгена; установлено, что наибольшей способностью превращаться в фосген обладает четыреххлористый углерод: СС14>СНС13>С2НС13>С2С14.
Таким образом, основным недостатком процессов окислительного хлорирования хлорпроизводных углеводородов является образование продуктов окисления и высокая экзотермичность процесса, что делает этот процесс труднорегулируемым. Наибольшее распространение получили трубчатые реакторы со съемом тепла циркулирующим в межтрубном пространстве теплоносителем. Поэтому для обеспечения хорошей теплопроводности процессов и снижения износа катализатора выбор носителя имеет существенное значение. Для увеличения срока службы катализатора и поддержания его первоначальной активности предлагаются различные меры, например периодическая замена части загрузки катализатора, размещение по высоте реактора катализатора с различным содержанием активной массы, постепенное повышение температуры реакции; регулирование суммарного теплового эффекта реакции путем изменения состава и соотношения в подаче сырья, состоящего из смеси 1,2-дихлорэтана и других хлоруглеводородов С2 с различной степенью замещения хлором. Добавление полихлорэтанов к дихлорэтану позволяет вести процесс без избыточного выделения тепла, что устраняет местные перегревы и увеличивает срок службы катализатора.
Однако из-за высокой экзотермичности процесса окислительного хлорирования с участием медьсодержащего солевого трегерного катализатора возникают трудности, связанные со съемом тепла реакции, недостаточностью контакта с сырьем, что отрицательно сказывается на полноте хлорирования и на селективности процесса. Для улучшения теплопередачи, увеличения выхода и повышения селективности, сохранения активности катализатора фирмы «Du Pont» и «Lummus» разработали процессы оксихлорирования хлорпроизводных углеводородов Сг с при менением катализатора в виде расплава. В состав катализатора фирмы «Lummus» входят хлориды и оксиды Mn, Fe, Си, Со, Сг, а также хлориды К и Li. Указанный катализатор позволяет снизить температуру начала плавления до 260 °С. Процесс протекает при температуре 359-650°С, давлении 0,1-2 МПа и времени контакта 1-60 с. Описан процесс, в котором наряду с тетрахлорэтиленом образуется четыреххлористый углерод. Исходная реакционная смесь состоит из четыреххлористого углерода, хлоруглеводорода, хлороводорода и кислорода. Катализаторы состоят из хлоридов меди, щелочного и щелочноземельного металла, а также хлорида Fe, Zn, Mn, Cr, Ni, Pd и хлорида редкоземельного металла. Применение ка тализатора в виде расплава связано с повышенными энергозатратами и сильной коррозией оборудования.
Наиболее перспективным способом получения три- и тетра-хлорэтиленов в настоящее время является окислительное хлорирование хлорорганических отходов, позволяющее улучшить баланс процессов хлорирования по хлористому водороду.
Технологическая схема (рис. 1.2) процесса включает окислительное хлорирование полихлоридов С3, закалку реакционных газов, конденсацию и стабилизацию продуктов реакции /7/.
Окислительное хлорирование полихлоридов С3 осуществляется в трубчатом реакторе со стационарным слоем нанесенного медьсодержащего катализатора. Тепло реакции снимается циркулирующим в межтрубном пространстве теплоносителем, в качестве которого используется дифенильная смесь. Полихлориды С3, представляющие собой отходы производства глицерина и пропиленоксида, и НС1 (кислота) после предварительного нагрева в испарителях 2 и 1 соответственно перед поступлением в реактор-оксихлоратор 3 смешиваются. Соотношение исходных реагентов определяет состав конечных продуктов. Оксихлорирование осуществляется при температуре 400°С и времени контакта 5-8 с. Контактный газ после предварительного охлаждения в закалочном сопле 4 до 300°С за счет впрыска HCl-кислоты направляется в низ закалочной колонны 5. В закалочной колонне происходит охлаждение реакционных газов до 100°С, конденсация основной части хлоруглеродов и воды, отгонка хлоруглеводородов в виде азеотропной смеси с водой, а также абсорбция хлороводорода с получением 20%-й HCl-кислоты в кубе колонны. Хлоруглеводороды и HCl-кислота из куба закалочной колонны направляются в разделительный сосуд 7, откуда 20%-я кислота, после смешения ее со свежей кислотой, возвращается в процесс. Часть HCl-кислоты направляется для орошения в закалочную колонну и в закалочное сопло.
Принципиальная схема процесса окислительного хлорирования полихлоридов С3
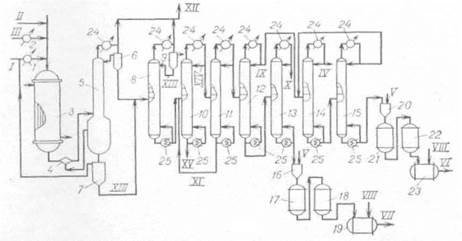
Рис. 1.2.
1,2 - испарители; 3 - реактор; 4 - закалочное сопло; 5 - закалочная колонна; 6, 7, 9, 16, 20 - разделительные сосуды; 8 - колонна осушки; 10 - 15 -ректификационные колонны; 17, 18, 21, 22 - осушители; 19, 23 - сборные емкости; 24 - конденсаторы-холодильники; 25 - кипятильники.
I - НС1; II - воздух; III - полихлориды С3; IV - ССl4; V - NaOH; VI - C2HC13; VII -C2C14; VIII - стабилизатор; IX – ССl4, С2НС13; X - 1,2-дихлорпропан; XI - тяжелая фракция; XII - НС1, СО2; XIII - хлоруглеводороды; XIV - легкая фракция; XV - полихлорпропаны.
Реакционные газы с верха закалочной колонны, пройдя последовательно систему холодильников (водного и рассольного) поступают в разделительный сосуд 6. Водный слой направляется на орошение в закалочную колонну, а хлоруглеводороды из обоих разделительных сосудов 6 и 7 направляются в колонну азеотропной осушки 8. Хлоруглеводороды, содержащие небольшое количество воды, хлороводорода, хлора, диоксида углерода, поступают в колонну 8, где нейтрализуются за счет отгонки растворенных кислых газов и подвергаются азеотропной осушке. В сосуде 9 происходит разделение хлоруглеводородов и воды. Вода направляется на очистку сточных вод, а хлоруглеводороды - на орошение колонны осушки 8. С низа колонны азеотропной осушки хлоруглеводороды направляются на ректификацию (колонны 10-15). Кубовая жидкость колонны 10 представляет собой высококипящие хлоруглеводороды, такие как полихлорпропаны и пентахлорэтан, которые возвращаются в процесс оксихлорирования. В колонне 11 происходит отделение хлоруглеводородов с температурой кипения не выше 130°С, т. е. CCl4, C2HCl3, C2Cl4 и непрореагировавший дихлорпропан.
С верха колонны 12 уходит смесь четыреххлористого углерода и трихлорэтилена, а с низа - смесь тетрахлорэтилена и дихлорпропана. В колонне 13 с верха отгоняется непрореагировавший дихлорпропан, который возвращается в процесс, а с низа - тетрахлорэтилен-ректификат, который после обработки 10%-м раствором NaOH направляется на расслаивание в разделительный сосуд 16. Продукт, пройдя последовательно осушители 17 и 18, заполненные твердым гидроксидом натрия и хлоридом кальция, направляется в емкость 19, где происходит его стабилизация N-метилморфолином.
Для разделения четыреххлористого углерода и трихлорэтилена используются две ректификационные колонны 14 и 15. Четыреххлористый углерод отгоняется с верха колонны 14, а трихлорэтилен - с низа колонны 15. Трихлорэтилен-ректификат также подвергается обработке щелочью (20), сушке (21, 22) и стабилизации триэтиламином (23).
Отходящие газы оксихлорирования, содержащие кислород, диоксид углерода, незначительное количество хлороводорода, хлора и легких хлоруглеводородов, возвращаются в процесс. Часть отходящих газов постоянно выводится из системы и направляется в колонну 14, орошаемую захоложенным 1,2-дихлор-пропаном, где происходит абсорбция почти всех легких углеводородов, хлора, хлороводорода и диоксида углерода. Абсорбированные хлоруглеводороды после десорбции хлороводорода, хлора и диоксида углерода возвращаются в процесс оксихлорирования.
Удельный расход сырья и энергоресурсов при получении перхлоруглеродов окислительным хлорированием отходов хлорорганических производств: хлорорганические отходы - 0,73 т; НС1 - 0,35 т; кислород - 0,33 т; катализатор - 0,3 кг; энергия - 0,40 т. у. т.
Тетрахлорэтилен - универсальный негорючий растворитель, обладающий высокой растворяющей способностью по отношению к жирам, маслам, парафинам, различным смазкам, полимерам, что позволяет применять его для холодного и парового обезжиривания металлов, обработки текстиля, чистки одежды, сольвентной экстракции, в качестве полупродуктов в органическом синтезе, в производстве фреонов, клеев, аэрозольных упаковок, покрытий. Важным преимуществом тетрахлорэтилена является возможность его регенерации.
Мощности по тетрахлорэтилену в 1985 г. составляли в США /7/ - 380 тыс. т, в Европе - 450 тыс. т. Общая мощность для США и стран Западной Европы 1 млн. т/год. Производство в 1985 г. было на уровне 220 тыс. т в США, 100 тыс. т в ФРГ и 600-700 тыс. т в США и Западной Европе.
Производство тетрахлорэтилена в США в 1988 г. составило 224,8 тыс. т, а мощности установок на начало 1989 г. были на уровне 326,9 тыс. т. Спрос в США в 1988 г., в 1989 и 1993 гг. (оценка) находится на уровне 224,7 тыс. т.
Хлорирование метана
Первые работы по хлорированию метана в псевдоожиженном слое катализатора относятся к середине шестидесятых годов. Было показано, что в кипящем слое различных катализаторов (активный уголь, пемза, кварцевый песок и т. д.) в интервале температур 250-500°С и стехиометрическом соотношении Сl2:СН4 равном 4, идет преимущественное образование четыреххлористого углерода СС14. В результате изучения влияния температуры, соотношения реагентов и природы катализатора на состав реакционного продукта были выбраны условия (температура 350-360°С, мольное соотношение С12:СН4 = 3,6:1, катализатор - активный уголь), обеспечивающие выход СС14 не менее 90 %.
В лаборатории и на опытно-промышленной установке в реакторе диаметрам 400 мм отработан процесс получения ССl4 в псевдоожиженном слое пемзы и кварцевого песка. Проверка в опытно-промышленном реакторе показала, что пемза из-за быстрого обуглероживания поверхности и комкования частиц имеет ограниченный срок службы: уже через 20 часов наблюдается заметное падение активности катализатора. Использование в качестве катализатора кварцевого песка более предпочтительно, так как за период испытаний в течение 1500 часов падения активности не наблюдалось. В результате проведенных работ было показано, что при температуре 360-370°С и соотношении Cl2:CH4 = 3,7±0,1:1 достигается практически полное связывание хлора, а выход ССl4 не менее 70 %.
На основании комплекса лабораторных и опытных исследований выполнено математическое моделирование процесса хлорирования метана в псевдоожиженном слое катализатора. Расчет процесса по двухфазной модели и сравнение с экспериментальными данными, полученными в опытном реакторе диаметром 600 мм, показали, что при температуре 360-390 °С и соотношении С12:СН4 = 3,7-3,8 :1 имеет место полное связывание хлора; содержание ССl4 в реакционном продукте составляет не менее 90 % (масс).
Помимо проведения реакции исчерпывающего хлорирования метана до ССl4 представляло интерес выявить возможность преимущественного получения метиленхлорида и хлороформа. С этой целью был выполнен большой объем исследований по изучению реакции хлорирования метана и его хлорпроизводных в псевдоожиженном слое силикагеля, активного угля и кварцевого песка. В температурной области 250-450°С были изучены основные кинетические закономерности реакции, получены уравнения скорости хлорирования метана и его хлорпроизводных и определены параметры уравнений. Это позволило оценить реакционную способность метана и хлорметанов. В зависимости от вида катализатора она имеет вид:
на кварцевом песке СН3С1 > СН2С17 >СН4>СНС13,
на активном угле СН3С12 > СНС13 >СН3С1>СН4.
На основании полученных значений констант скоростей хлорирования было показано, что для исчерпывающего хлорирования метана до ССl4 целесообразно в качестве катализатора использовать активный уголь, а для ограниченного хлорирования - песок и силикагель. Следует отметить, что кинетические данные, полученные разными авторами, достаточно противоречивы. Это можно видеть на примере соотношения констант скоростей хлорирования метана и хлорметанов, полученных при хлорировании на песке: k1:k2:k3:k4 - 1,0:2,5:1,4:0,6 и 1,0:2,0:1,0:0,5. С целью уточнения кинетики и механизма реакции хлорирования выполнено исследование этой реакции в проточно-циркуляционной установке. Реакцию хлорирования изучали при температурах 275-400°С в присутствии большой группы контактов, различающихся макроструктурой и химической природой: кварц, перлит, кокс, силикагели и др. Для сравнения были проведены исследования реакции термического хлорирования и фотохлорирования. Выполненные исследования для реакции термического хлорирования подтвердили литературные данные, а для фотохлорирования и каталитического получены одинаковые закономерности: дробный порядок по метану (0,5-0,6) и близкий к первому порядок по хлору (0,8-1,0). Энергия активации в зависимости от природы контакта изменяется от 100 до 117 кДж/моль.
Установлено, что реакция хлорирования в присутствии пористых контактов протекает по гетерогенно-гомогенному механизму с генерацией атомарного хлора поверхностью контакта.
Хлорирование метана возможно и в присутствии хлоридов металлов, нанесенных на пористый носитель. Как правило, используют хлориды металлов переменной валентности. Использование таких катализаторов снижает энергию активации процесса, повышает его скорость и выход продуктов глубокого хлорирования. Каталитические свойства таких систем связывают с их способностью к генерированию атомарного хлора.
Большое внимание было уделено изучению зависимости процесса хлорирования от фактора масштабного перехода, что особо важно для процессов в псевдоожиженном слое. Так, при увеличении диаметра аппарата наблюдалась неудовлетворительная воспроизводимость лабораторных данных по конверсии реагентов и составу хлорметанов, а также по увеличению выхода побочных продуктов и сажеобразования. Сопоставление данных, полученных в реакторах различного диаметра (от 50 до 600 мм), изучение плотной и пузырьковой фазы псевдоожиженного слоя позволило авторам предположить наличие локальных перегревов не в пузырях, а в плотной фазе, так называемых «сгущениях» частиц, и в связи с этим предложить трехфазную модель псевдоожиженного слоя.
Технологическая часть
Химизм процесса
Галогенирование углеводородов может осуществляться методом замещения (субститутивное) различных атомов или функциональных групп на атомы галогена или присоединением (аддитивное) галогенирующих агентов по ненасыщенным связям органических соединений или по атомам, находящимся в низшем валентном состоянии, а также методом расщепления /1/.
Термическое хлорирование
Осуществляется в газовой фазе под действием тепла. Для этого требуется нагревание до 250°С; при такой температуре становится заметной диссоциация молекул хлора на атомы с участием стенки или насадки:
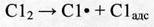 (2.13)
(2.13)
При сравнительно низких температурах образование свободных атомов происходит в основном за счет взаимодействия хлора с углеводородом:
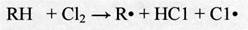 (2.14)
(2.14)
Чем менее реакционноспособны углеводороды, тем выше должна быть температура, так как образование свободных органических радикалов связано с разрывом связи С-Н в молекуле углеводорода. Например, температура хлорирования бутана составляет около 250°С, а для термического хлорирования метана требуется 400°С. Энергия активации термического хлорирования равна 125 кДж/моль.
Термическое хлорирование при высоких температурах может сопровождаться побочными реакциями, деструкцией молекул, дегидрохлорированием и циклизацией.
Фотохимическое хлорирование
При этом способе реакция инициируется светом, действие которого наиболее эффективно в коротковолновой части спектра. В этом случае молекулы хлора диссоциируют под влиянием фотонов или квантов энергии /6/:
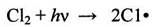 (2.15)
(2.15)
в качестве источника которых применяются ртутные лампы, излучающие свет длиной волны 1650-5500 А. Если реакционные устройства сделаны из плавленого кварца, можно использовать лучи с длиной волны 1650 А, если же реактор выполнен из стекла пирекс или из обычного стекла, можно использовать лишь лучи с длинами волны более, 3000-3500 А. Для многих реакций фотохимического хлорирования достаточно уже видимого света с длиной волны 4000-5000 А, для чего применяются обычные мощные лампы. Эффективность действия излучения характеризуется квантовым выходом, т. е. числом прореагировавших молекул на один квант поглощенной энергии.
Цепная реакция фотохимического хлорирования протекает с большой скоростью при невысоких температурах в жидкой или паровой фазе, а направление реакции часто бывает иным, чем при термическом хлорировании. Энергия активации при фотохимическом хлорировании равна 42 кДж/моль, т. е. примерно в 2,5-3 раза ниже, чем при термическом хлорировании.
Реакция фотохимического хлорирования ингибируется (замедляется) некоторыми примесями, которые связывают атомы хлора и обрывают цепь. К таким ингибиторам относится, например, кислород, который с атомами хлора образует оксид хлора:
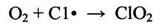 (2.16)
(2.16)
Однако кислород тормозит реакцию лишь при низких температурах, а при 350-400°С он уже не оказывает заметного действия, что связано с переходом к другому механизму /6/.
Газофазное хлорирование
Хлорированием в газовой фазе получают сравнительно небольшое число соединений: хлорпроизводные метана, а также дихлорбутилены/
Газофазное хлорирование проводят при температуре 300-500°С в избытке углеводорода (в целях подавления образования полихлоридов) с рециркуляцией исходного сырья и обязательным предварительным смешением исходных реагентов в специальных смесителях (тангенциального типа), обеспечивающих интенсивное перемешивание смеси.
Особенностью реакторов-хлораторов, применяемых для хлорирования в газовой фазе, является наличие внутренней керамической футеровки, а также автотермичность протекающего в них процесса. Последнее достигается тем, что выделяющееся при реакции тепло расходуется на нагревание смеси до требуемой температуры и на потери в окружающую среду. При этом в зависимости от теплового баланса процесса реагенты в хлоратор подают холодными (например, при синтезе полихлоридов метана) или предварительно подогретыми (при получении аллилхлорида). Причем для сильно экзотермических синтезов полихлоридов метана регулирование температуры возможно за счет впрыскивания жидкого четыреххлористого углерода.
Технология хлорирования в газовой фазе состоит из следующих стадий: подготовки реагентов (испарение жидкого хлора), предварительного нагрева газообразного хлора, осушки реагентов (адсорбентами или H2SO4), смешения исходных реагентов друг с другом и с рециркулятом, хлорирования, очистки реакционной смеси от хлористого водорода, отделения рециркулирующих веществ и выделения целевого продукта.
Жидкофазное хлорирование
Методом радикально-цепного жидкофазного хлорирования получают: полихлорпроизводные метана (1,1,2- и 1,1,1-трихлорэтаны); хлорпарафины (жидкие и твердые); хлорированные полимеры (полиэтиленхлорид, полипропиленхлорид и поливинилхлорид, а также хлоркаучук); хлорпроизводные ароматических углеводородов: (бензилхлорид).
Жидкофазное радикально-цепное хлорирование проводится при температурах от 40 до 150°С в присутствии инициаторов или фотохимически. Обычно жидкофазным хлорированием получают моно- и хлорпроизводные, которые нестабильны при повышенных температурах и практически большинство полихлорпроизводных.
Процесс в жидкой фазе проводится в аппаратах колонного типа, имеющих внутреннее охлаждение, при барботировании хлора через массу исходных углеводородов или их раствор в растворителях (тетрахлоруглерод, о-дихлорбензол); некоторые полимеры хлорируют в водных и других суспензиях.
Подача реагентов осуществляется противотоком. Для повышения селективности процесса применяют секционирование реактора.
При хлорировании низкокипящих веществ внутреннее охлаждение отсутствует, так как теплосъем осуществляется за счет испарения этих веществ.
Существенное влияние на показатели процесса оказывают соотношение исходных реагентов, температура, концентрация инициатора и интенсивность облучения.
При фотохимическом хлорировании температура процесса не выше 40-60°С, применяется отвод тепла реакции циркулирующей водой.
При использовании химических инициаторов хлорирование проводится при температуре разложения инициатора.
Расход инициатора зависит от молекулярной массы исходного углеводорода, количества вводимого хлора и температуры реакции.
Расход инициатора можно уменьшить, вводя его отдельными порциями во времени (при периодическом процессе) или по длине реактора (при непрерывном процессе).
Технология жидкофазного радикально-цепного хлорирования состоит из тех же стадий, что и при газофазном хлорировании.
Тепловой расчет хлоратора
Исходные данные:
материальные потоки (см. состав потоков 2-7): хлор – 128,61/(2×3600) = = 0,0179 кмоль/с; природный газ – 4,72/(2×3600) = 0,0007 кмоль/с; технический этилен - 9,38/(2×3600) = 0,0013 кмоль/с; жидкие хлоруглеводороды - 386,21/(2×3600) = = 0,0536 кг/с; жидкие рециркулирующие перхлорутлеводороды из емкостей сырого продукта – 3613,64/(2×3600) = 0,502 кг/с; продукты отпарки сырца перхлоруглеводородов - 4,93/(2×3600) = 0,0007 кмоль/с; жидкий 1,2-дихлорэтан 1489,59/(2×3600) = = 0,2069 кг/с; температура потоков, °С: хлор, природный газ, технический этилен - 25; хлоруглеводороды и рецикл (сырой продукт) - 20; продукты отпаркп сырца перхлоругдеводородов - 30; продукты реакции - 585.
Цель расчета - определение количества теплоты, отводимой охлаждающей водой.
Уравнение теплового баланса хлоратора в общем виде:
Ф1 + Ф2 + Ф3 + Ф4 + Ф5 + Ф6 = Ф7 + Ф8 + Ф9 + Фпот, (2.38)
где Ф1, Ф2, Ф3, Ф4, Ф8 – тепловые потоки газообразного сырья (хлор, природный газ, технический этилен), жидких хлоруглеводородов, жидких рециркулирующих перхлоруглеводородов, жидкого техническго 1,2-дихлорэтана и продуктов реакции соответственно, кВт;
Ф6 – теплота экзотемической реакции, кВт;
Ф7 – теплота, расходуемая на испарение жидких компонентов сырьевой смеси, кВт;
Ф9 – теплота, отводимая охлаждающей водой, кВт;
Фпот – теплопотери в окружающую среду, кВт.
Определяем тепловые потоки сырья и продуктов. Значения теплоемкостей находим по /7/ (Приложения, табл. 2-4).
Тепловой поток газообразного сырья (потоки 1-3):
Ф1 =(0,0179×33,93 + 0,0007×35,71 + 0,0013×43,56)×25 = 17,22 кВт.
Тепловой поток жидких хлоруглеводородов (поток 4):
Ф2 = (0,0536/100)×(1,289×7,0 + 0,962×4,2 + 0,858×6,0 + 0,950×5,5 + 0,862×77,3)×20 = = 0,97 кВт.
Тепловой поток жидких рециркулирующих перхлоруглеводородов (поток 5):
Ф3 = (0,502/100)×(0,858×70,8 + 0,862×29,2)×20 = 8,63 кВт.
Тепловой поток продуктов отпарки сырца перхлоруглеводородов (поток 6):
Ф4 = (0,0007/100)×(0,545×154×6,75 + 34,13×55,75 + 29,11×37,5)×30 = 0,75 кВт.
где 0,545 – удельная теплоемкость паров тетрахлорметана, кДж/(кг×К);
154 – молярная масса тетрахлорметана, г/моль.
Для упрощения расчета все компоненты, присутствующие в потоке 7, объединены в поток «дихлорэтан». Тепловой поток жидкого 1,2-дихлорэтана (поток 7):
Ф5 = 0,2069×1,289×20 = 5,334 кВт.
Рассчитываем теплоты реакций (в кДж/моль):
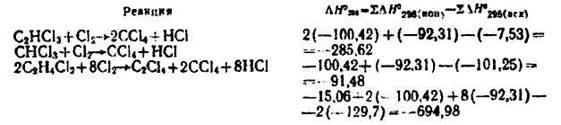

Теплота экзотермических реакций (теплота реакции образования гексахлорбутадиена принята равной теплоте реакции образования гексахлорбензола):
Ф6 = [1000/(2×3600)]×[285,62×0,12 + 91,48×0,18 + 694,98×7,19 + 394,81×3,11 + + 1996,3×(0,14 + 0,09) + 730,2×0,079 + 484,25×0,2375 + 436,6×9,19] = = [1000/(2×3600)]×10919,69 = 1516,52 кВт.
Общий приход теплоты:
Фприх = 17,22 + 0,97 + 8,63 + 0,75 + 5,334 + 1516,52 = 1549,424 кВт.
Количество веществ испаряющихся в хлораторе (кг/ч): тетрахлорметан - 298,54 + 1055,18 + 74,48 = 1428,2; тетрахлорэтилен – 23,17 + 1971,24 = 1994,41; гексахлорэтан – 346,91; гексахлорбуталдиен – 169,84; гексахлорбензол – 66,85; трихлорэтилен – 16,23; трихлорметан – 21,24; 1,2-дихлорэтан – 27,03 + 1397,23 = 1424,26.
Определяем теплоту, расходуемую на испарение жидких компонентов. Значения теплот испарения компонентов по /7/ (Приложения, табл. 9) теплоты испарения гексахлорбутадиена и гексахлорбензола приняты равными теплоте испарения гексахлорэтана:
Ф7 = [1/(2×3600)]×[1428,2×194,7 + 1994,41×209,2 + (346,91 + 169,84 + 66,85)×215,5 + + 16,23×239,3 + 21,24×248,3 + 1424×323,4] = 1164980,4/(2×3600) = 161,8 кВт
Тепловой поток продуктов реакций (поток 9; с целью упрощения расчета в поток «тетрахлорэтилен» включены гексахлорбензол, гексахлорбутадиен, гексахлорэтан, а в поток «хлор» - азот, диоксид углерода и хлороводород):
Ф8 = [1/(2×3600)]×[(4752,58 + 105,45 + 193,14 + 364,74)×0,693 + 4236,54×0,656 + + (1369,59 + 3,57 + 2,53)×(37,21/71) + 4244,84/(30,63/36,5)]×585 = [10815,55/(2×3600)]× ×585 = 878,76 кВт.
Принимаем, что теплопотери в окружающую среду составляют 5% от общего прихода теплоты:
Фпот = 0,05×1549,424 = 77,47кВт.
Количество теплоты, отводимое охлаждающей водой, находят из уравнения теплового баланса хлоратора:
Ф9 = Фприх – Ф7 – Ф8 – Фпот = 1549,424 – 161,8 – 878,76 – 77,47 = 431,394 кВт
или 431394 Вт.
Рассчитывают расход воды на охлаждение наружной стенки хлоратора. Принимают начальную температуру воды tH = 20°С и считают, что в процессе теплообмена температура повысилась на 20°С, тогда расход воды составит:
mB = Ф9/(сВ×Δt×η) = 431394/(4187×20×0,9) = 5,7239 кг/с.
ЗАКЛЮЧЕНИЕ
1. Изучены способы и технологии получения тетрахлорметана и тетрахлорэтилена, области их применении, используемая реакционная аппаратура и рассмотрены материалы, которые целесообразно использовать в процессах хлорирования.
2. Рассмотрен химизм получения тетрахлорметана и тетрахлорэтилена.
3. Разработана и описана технологическая схема процесса совместного получения тетрахлорметана и тетрахлорэтилена.
4. Выполнены материальные расчеты стадии получения тетрахлорметана и тетрахлорэтилена и Теловой расчет хлоратора.
Расходные коэффициенты на годовую производительность по перхлоруглеводородам составляют:
по хлору: 9131,31/5517,24 = 1,655 т/т;
по техническому этилену: 832,261×1000/5517,24 = 150,85 кг/т;
по природному газу: 79,42×1000/5517,24 = 14,39 кг/т.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1981.
2. Адельсон С.В., Вишнякова Т.П., Паушкин Я.М. Технология нефтехимического синтеза. – М.: Химия, 1985.
3. Справочник нефтехимия / Под ред. С.К. Огородникова. В 2-х т. – Л.: Химия, 1978.
4. Капкин В.Д., Савинецкая Г.А., Чапурин В.И. Технология органического синтеза. – М.: Химия, 1988.
5. Трегер Ю.А., Гужновская Т.Д. Интенсификация хлорорганических производств. Высокоэффективные каталитические системы. – М.: Химия, 1989.
6. Муганлинский Ф.Ф., Трегер Ю.А., Люшин М.М. Химия и технология галогенорганических соединений. – М.: Химия, 1993.
7. Гутник С.П., Сосонко В.Е., Гутман В.Д. Расчеты по технологии органического синтеза. – М.: Химия, 1988.
8. СТП 001-2002 Стандарты предприятия. Проекты (работы) дипломные. Требования и порядок подготовки, представления к защите и защиты. – Мн.: БГТУ, 2002.
Факультет инженерно-экономический
Кафедра технологии нефтехимического синтеза и переработки полимерных материалов
РАСЧЕТНО-ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
к курсовому проекту
по курсу: «Технология и оборудование основного органического и нефтехимического синтеза»
на тему:«Производство тетрахлорметана и тетрахлорэтилена мощностью 40000 т/год»
Разработал:
студент 3 курса 1 гр.
Жиренков М.В.
Проверил:
ст. преп. Юсевич А.И.
Минск 2006 г.
РЕФЕРАТ
Пояснительная записка содержит 45 стр., 7 рис., 6 табл., 8 литературных источников, 1 лист графического материала формата А1.
Тетрахлорметан, Тетрахлорэтилен, хлорирование, хлоратор, хлороводород, перхлоруглеводород.
Цель работы – изучить производство тетрахлорметана и тетрахлорэтилена.
Объект проектирования – технология производства тетрахлорметана и тетрахлорэтилена.
В работе приведено описание основных методов получения тетрахлорметана и тетрахлорэтилена, химизма и физико-химических основ производства, приведено подробное описание технологической схемы производства тетрахлорэтана и тетрахлорэтилена, выполнен расчет материального и теплового балансов.
СОДЕРЖАНИЕ
Введение
1.Аналитический обзор
1.1 Получение тетрахлорметана
1.2 Получение тетрахлорэтилена
1.3 Переработка хлорорганических отходов. Производство перхлоруглеводородов
1.4 Хлорирование метана
1.5 Условия процесса и типы реакторов
1.6 Рекомендуемые материалы для оборудования процессов получения хлорорганических соединний
1.7 Современный патентный обзор
2. Технологическая часть
2.1 Химизм процесса
2.1.1 Методы замещения (субститутивное галогенирование)
2.1.2 Методы присоединения (аддитивное галогенирование), галогенирующие агенты
2.1.3 Метод расщепления галогенпроизводных
2.1.4 Термическое хлорирование
2.1.5 Фотохимическое хлорирование
2.1.6 Хлорирование в присутствии свободных радикалов
2.1.7 Ионно-каталитическое хлорирование
2.1.8 Газофазное хлорирование
2.1.9 Жидкофазное хлорирование
2.2 Описание технологической схемы
2.3 Технико-технологические расчеты
2.3.1 Расчет материального баланса
2.3.2 Расчет закалочной колонны КЛ1
2.3.3 Тепловой расчет хлоратора
Заключение
Список использованной литературы
ВВЕДЕНИЕ
Производство органических веществ зародилось давно, но первоначально оно базировалось на переработке растительного или животного сырья – выделение ценных веществ (сахар, масла) или их расщепление (мыло, спирт и др.). Органический синтез, т. е. получение более сложных веществ из сравнительно простых, зародился в середине XIX века на основе побочных продуктов коксования каменного угля, содержавших ароматические соединения. Затем, уже в XX веке как источники органического сырья все большую роль стали играть нефть и природный газ, добыча, транспорт и переработка которых более экономичны, чем для каменного угля. На этих трех видах ископаемого сырья главным образом и базируется промышленность органического синтеза /1/.
Промышленный хлорорганический синтез, развивающийся значительными темпами, позволяет получать широкий ассортимент хлорсодержащих органических продуктов, которые находят применение во всех отраслях народного хозяйства. Среди хлорорганических продуктов большое значение имеют тетрахлорметан (четыреххлористый углерод) и тетрахлорэтилен (перхлорэтилен).
Тетрахлорметан является промежуточным продуктом при получении хладона-11 и хладона-12, вспенивателей в производстве пластмасс; используется для извлечения металлов из пирита, протравливания семян и других целей. перхлорэтилен применяется в текстильной промышленности, для обезжиривания металлов, химической очистки одежды, в производстве хладона-113.
Поэтому тема данной курсовой работы «Производство тетрахлорметана и тетрахлорэтилена мощностью 40000 т/год» является весьма актуальной.
Аналитический обзор
Получение тетрахлорметана
Наиболее старым методом получения ССl4 является «сероуглеродный», в основе которого лежит следующая последовательность реакций /1, 2/:
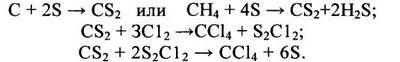 (1.1)
(1.1)
Сероуглерод образуется при взаимодействии серы (900°С) с кипящим слоем углерода или с метаном (600°С) в присутствии SiО2 и Al2O3 в качестве катализаторов с выходом до 95%. Хлорирование сероуглерода хлором ведут при 60°С в присутствии катализатора сурьмы, а хлорирование монохлоридом серы – на железных опилках. Высокая селективность процесса и чистота целевого продукта, отсутствие затрат на ректификацию для выделения ССl4 выгодно отличают этот метод от других методов получения четыреххлористого углерода. Однако из-за многостадийности, больших энергетических затрат, а также повышенной пожаро- и взрывоопасности и тяжелых санитарно-гигиенических условий труда в настоящее время метод не представляет промышленного интереса.
|
|
но промышленной ценности он не представляет. Исчерпывающее прямое хлорирование метана в одну стадию /1/
Принципиально возможен синтез CCl4 из фосгена /2/:
|
|
на практике осложняется, что связано с взрывоопасностью смесей метан – хлор, взятых в стехиометрическом соотношении, а также с необходимостью отвода большого количества тепла. При температуре 400°С, мольном отношении С12:СН4, равном 1:2, и рециклизации низкохлорированных производных метана СС14 является одним из основных продуктов процесса. Возможно получение ССl4 хлорированием метана в кипящем слое катализатора.
Имеются сведения о получении СС14 окислительным хлорированием метана при 375-455°С под давлением с использованием расплава катализатора СuО-СuС12 /2/:
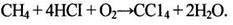 (1.4)
(1.4)
Для уменьшения коррозии внутренняя поверхность реактора и его насадка выполнены из керамики. Четыреххлористый углерод образуется с высоким выходом. Эксплуатационные расходы процесса «Transcat»/3-6/ на 1 т СС14: метан – 0,14 т; хлороводород – 0,95 т; электроэнергия – 260 кВт×ч; топливо – 280 ГДж; водяной пар – 2,6 т; охлаждающая вода – 242 м.
СС14 можно получить окислительным хлорированием хлорпроизводных пропана смесью хлора и кислородсодержащего газа при 250-450°С в присутствии катализатора цеолита в Са2+-форме с окклюдированным хлорид-ионом.
Четыреххлористый углерод получают совместно с тетрахлорэтиленом термическим хлорированием пропан-пропиленовой фракции хлорпропанов, а также хлорорганических отходов при 400-550°С /5, 6/:
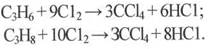 (1.5)
(1.5)
Полученный по такому способу СС14 отличается высокой чистотой. Расход сырья на 1 т СС14: хлор – 1,56 т; С3-фракция – 0,102 т. Побочно образуется 0,585 т НС1, из которого получают товарную хлороводородную (соляную) кислоту.
Принципиальная схема получения СС14 при высоких температурах и давлениях приведена на рис. 1.1.
Принципиальная схема получения СС14 при высоких температурах и давлениях

Рис. 1.1.
1, 6, 7, 8 - ректификационные колонны; 2 - испаритель; 3, 9 -осушители; 4- подогреватель; 5 - реактор; 10 - смеситель; 11 -холодильник; 12 - кипятильник. I - хлорированные углеводороды; II - хлор; III - сажа, смола; IV - хлороводород; V-CC14.
При усовершенствовании процесса хлоролиза для получения СС14 рекомендован ввод сырья в реактор через сопло с трубкой, которая всасывает реакционную смесь. При этом достигается высокая производительность при относительно небольшом избытке хлора (10-50%).
Перед входом в реактор хлоролиза 5 (рис. 1.1) хлорсодержащие соединения делят предварительно на легкие и тяжелые фракции в колонне ректификации 1. Легкие фракции сушат (3) над алюмогелем или силикагелем, а тяжелые отделяют от сажи и смол в пленочном испарителе 2. После осветления указанные фракции объединяют, подогревают (4) и подают в смеситель 10, где смешивают с высушенным в аппарате 9 хлором. Хлоролиз при 550-600°С и 18-20 МПа приводит к образованию, в основном, ССl4. С верха колонны 7 отводят НСl, из средней части колонны 7 отводят смесь CCl4 и НС1 и направляют на рециркуляцию, как и кубовый остаток колонны 5.
Товарный ССl4 выделяют сверху колонны 5. Удельный расход сырья (хлорпроизводные С3) и энергоресурсов на 1 т целевого продукта (ССl4:С2Сl4 = 1:1): хлоруглеводороды - 0,6 т; хлор - 1,8 т; электроэнергия 150 кВт×ч; водяной пар – 17 ГДж. Установка производит 0,5 т хлороводородной кислоты на 1 т четыреххлористого углерода.
Для получения смеси хлорметанов большой интерес представляет процесс окислительного хлорирования метана, осуществляемый в «кипящем» или неподвижном слое катализатора /6/. Реакцию проводят при 380-450°С; при более высокой температуре происходят побочные реакции глубокого окисления и, кроме того, усиливается коррозия оборудования. Оптимальная температура процесса окислительного хлорирования метана равна 360-380°С при времени контакта 5-15 с. Суммарный выход хлорметанов в расчете на прореагировавший метан при температуре 380°С, времени контакта 5 с и мольном соотношении СН4:НС1:О2 = 1:1:1 составляет 62-85%. а выход продуктов глубокого окисления - от 15 до 5%.
Поскольку окислительное хлорирование метана сопровождается сильноэкзотермичной побочной реакцией глубокого окисления, особую трудность при технологическом оформлении составляет эффективный теплосъем. При работе в неподвижном слое катализатора возникают труднорегулируемые «горячие» точки, для устранения которых рекомендуется помещать катализатор в порядке повышения содержания активной массы по ходу движения реакционного потока. К недостаткам «кипящего» слоя следует отнести большой унос активной массы, слипание частиц катализатора, повышенный выход продуктов глубокого окисления хлорметанов.
При проведении процесса в расплаве солей конверсия метана составляет лишь 15—20%, а в реакционной смеси преобладает метилхлорид. Процесс отличается большой сложностью, в связи с чем, по-видимому, никогда не будет реализован в промышленности.
Технико-экономическое сравнение методов получения хлорметанов показывает, что перспективными схемами их производства являются следующие /7/: 1) из метанола и хлора через стадию получения метилхлорида; 2) комбинация прямого и окислительного хлорирования метана.
Мощность технологической линии составляет до 80 тыс. т хлорметанов в год. Единичная мощность агрегатов: прямого хлорирования – 12-14 тыс. т; окислительного хлорирования – 5-15 тыс. т; получения метилхлорида – 10-20 тыс. т. Удельный расход сырья по «метанольному» способу: метанола – 0,383 т/т; хлора – 0,847 т/т (СН2С12 - 11,8%; СНС13 - 58,8%; СН4 - 28,4%); по метановому способу («сбалансированная» по хлору схема): метана – 1,17 т/т; хлора – 0,89 т/т, что более чем вдвое меньше по сравнению с прямым хлорированием метана. Расход электроэнергии 0,113 т×кВт×ч и 0,280 т×кВт×ч соответственно.
Четыреххлористый углерод – наиболее крупнотоннажный продукт из хлорпроизводных метана.
Мощности по четыреххлористому углероду в 1981 г. составили в Западной Европе, США и Японии соответственно 250, 380 и 70 тыс. т. Производство в США в 1987 г. было на уровне 305,9 тыс. т, а в 1988 - 344,7 тыс. т. Потребность в четыреххлористом углероде в 1983 г. составила для Западной Европы 250 тыс. т, для США - 250 тыс. т и для Японии - 75 тыс. т (табл. 1.1).
Таблица 1.1.
Структура потребления галогенпроизводных в 1983 г.
| Западная Европа | США | Япония | |
| Фреоны 11 и 12, % | 94 | 92 | 90 |
| Растворитель для химических реакций, % | 6 | 8 | 10 |
Как видно из этих данных, основным потребителем CCl4, определяющим темпы развития производства этого продукта, является промышленность фторхлоруглеродов (F-11 и F-12), которые используются в качестве пропеллентов в аэрозольных упаковках и хладоагентов:
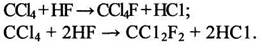 (1.6)
(1.6)
Сейчас наблюдается уменьшение спроса на СС14, что объясняется в основном введением строгих ограничений на использование фторхлоруглеродов в аэрозольных упаковках, поскольку показано, что эти соединения, как и сам СС14, разрушают озоновый слой.
Используется СС14 также как средство для тушения пожаров, для обезжиривания металлов, получения фумигантов, извлечения металлов из руд.
Определенный интерес представляет синтез w-аминокарбоновых кислот на основе реакции теломеризации:
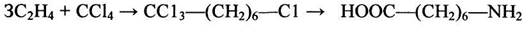 (1.7)
(1.7)
Процесс проводят при 100°С под давлением в присутствии химических инициаторов; w-аминоэнантовая кислота при поликонденсации образует полиамидную смолу, из которой получают волокно «энант», превосходящее по многим эксплуатационным показателям капроновую нить.
Получение тетрахлорэтилена
Тетрахлорэтилен образуется при высокотемпературном хлорировании дихлорэтана или хлорорганических отходов С3:
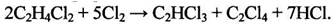 (1.8)
(1.8)
Оксихлорирование полихлоридов С2-С3 также приводит к получению и тетрахлорэтиленов:
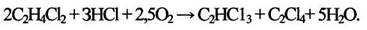 (1.9)
(1.9)
Современное производство хлорорганических растворителей, таких как тетрахлорэтилен, базируется на этилене, пропан-пропиленовой фракции и, в меньшей степени, этане. Методы, основанные на использовании ацетилена, в значительной мере устарели, однако до настоящего времени они осуществляются в промышленности. Совмещение процессов гидро- и дегидрохлорирования позволяет создать сбалансированную по хлороводороду технологическую схему, поэтому при наличии дешевого ацетилена данный способ может конкурировать с другими. Существенную роль в структуре сырьевой базы играют хлорорганические отходы производства винилхлорида, дихлорэтана, аллилхлорида, эпихлоргидрина и ряда других хлорорганических производств.
В целом процесс получения тетрахлорэтилена включает стадии высокотемпературного хлорирования (хлоролиз), дегидрохлорирования соответствующих хлорэтанов. Поскольку на каждой стадии образуется хлороводород, для создания сбалансированной по НС1 схемы последний целесообразно комбинировать со стадией гидрохлорирования или оксихлорирования.
Высокотемпературному хлорированию обычно подвергаются хлорорганические отходы C1-С4. Процесс протекает при 500-650°С в полом реакторе или в реакторе с псевдоожиженным слоем катализатора.
Перхлорэтилен получают также одновременно с четыреххлористым углеродом хлоролизом хлорорганических отходов С3, например отходов производства аллилхлорида. Процесс хлоролиза осуществляется при 500°С в избытке хлора. Основными недостатками процесса хлоролиза являются образование побочных хлористого водорода, гексахлорбензола и сажи. При хлоролизе протекает реакция:
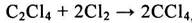 , (1.10)
, (1.10)
которая позволяет регулировать отношение между четыреххлористым углеродом и тетрахлорэтиленом.
Процессы получения тетрахлорэтилена на базе этилена осуществляются двумя способами. Первый способ - двухстадийный, на первой стадии которого прямым хлорированием этилена при температуре 136°С получают смесь тетра- и пентахлорэтанов, на второй - их подвергают высокотемпературному пиролизу с образованием тетрахлорэтилена. Расход тепловой энергии при термическом дегидрохлорировании сопоставим с расходом тепловой энергии дегидрохлорирования по известковому методу.
Стадия дегидрохлорирования хлорэтанов осуществляется в присутствии инициатора или катализатора. Ряд авторов, с целью создания сбалансированной по хлороводороду схемы, предлагают проводить процесс дегидрохлорирования в присутствии кислорода, условно называя этот процесс «окислительным дегидрированием» /7/:
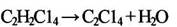 (1.11)
(1.11)
Реакция протекает в присутствии традиционного катализатора СuС12×КС1/носитель или МnО2 Предлагаемый способ дегидрохлорирования является весьма перспективным. Недостатком способа получения тетрахлорэтилена на основе этилена является потеря хлора в виде неутилизируемого хлороводорода. Поэтому более целесообразно проводить двухстадийный процесс следующим образом: на первой стадии методом окислительного хлорирования этилена при 200-230°С в кипящем или стационарном слое катализатора получать 1,2-дихлорэтан, а затем на второй стадии подвергнуть его высокотемпературному хлорированию. Таким образом удается утилизировать часть хлороводорода. Большой интерес представляет другой способ получения тетрахлорэтилена - одностадийное окислительное хлорирование углеводородов С2. Для производства тетрахлорэтилена часто применяют не сам этилен, а его хлорпроизводные, например 1,2-дихлорэтан. По разработке фирмы «PPG, Industries Inc.» /7/ процесс окислительного хлорирования 1,2-дихлорэтана проводят в трубчатом реакторе с псевдоожиженным слоем катализатора. Температура процесса поддерживается за счет кипящей в межтрубном пространстве жидкости. Тепло реакции используется для получения пара, необходимого для самого процесса.
В настоящее время ведутся интенсивные работы по повышению селективности данного процесса. Введение хлоридов редкоземельных элементов позволяет снизить выход продуктов глубокого окисления в 3 раза. Для повышения селективности процесса окислительного хлорирования 1,2-дихлорэтана применяют непрерывную подачу в реакционную зону 1,1,2-трихлорэтана. Образованию продуктов глубокого окисления способствуют местные перегревы, для устранения которых в работе процесс проводят в присутствии катализатора, содержащего хлорид меди с добавлением фосфата щелочного металла. В работах снижение выхода продуктов глубокого окисления достигается секционированной подачей кислорода, благодаря чему по мере прохождения кислорода по слою катализатора в реакцию вступают все более хлорированные углеводороды. Выявлению причин образования продуктов глубокого окисления в научно-технической литературе посвящено лишь небольшое число публикаций.
Окислительному хлорированию с целью получения четырех-хлористого углерода и тетрахлорэтилена подвергается смесь углеводородов C1-C4, хлоруглеводородов С3 и хлоруглеводородов С4-С6. В отличие от хлоролиза хлоруглеводородов С3, приводящего к образованию эквимольной смеси СС14 и C2HCl3, состав продуктов окислительного хлорирования существенно зависит от используемого катализатора.
Перечисленные способы окислительного хлорирования основаны на использовании в качестве хлорирующего агента смеси HCl-газа и кислорода. Ввиду неполной конверсии НС1, а также его образования при окислении и дегидрохлорировании хлоруглеводородов этот газ содержится в конечных продуктах, что создает проблему утилизации абгазного НС1 или загрязненной хлоруглеводородами HCl-кислоты. Вовлечение этой кислоты в процесс окислительного хлорирования несомненно представляет практический интерес, поскольку до настоящего времени она не находит сбыта и загрязняет окружающую среду. В процессе окислительного хлорирования с получением три- и тетрахлорэтилена могут быть использованы хлоруглеводороды C1-С3. При использовании 1,2-дихлорэтана катализатором процесса является цеолит с содержанием 4% (мас.) Сu2+ и 2,5% К+. Процесс протекает при температуре 400 °С, мольном отношении реагентов C2H4Cl2:O2:HCl:H2O = = 1:1,4:1,2:5,6 и времени контакта 10-25 с. Процесс характеризуется ровным температурным профилем по длине реактора и достаточно высокой селективностью.
Оксихлорированне полихлоридов С3 с образованием четыреххлористого углерода и тетрахлорэтилена сопровождается процессами глубокого окисления, а распределение продуктов, а именно хлорметанов и хлорэтиленов, зависит от используемой каталитической системы. Перераспределение между хлорметанами и хлорэтиленами, очевидно, связано с возможностью превращения хлорпроизводных C1 в хлорпроизводные С2 или их различной реакционной способностью в реакции окисления. Изучался процесс окисления в железной, цинковой и медной трубках хлорпроизводных углеводородов, реакционная способность которых в реакции окисления оценивалась по количеству образовавшегося фосгена; установлено, что наибольшей способностью превращаться в фосген обладает четыреххлористый углерод: СС14>СНС13>С2НС13>С2С14.
Таким образом, основным недостатком процессов окислительного хлорирования хлорпроизводных углеводородов является образование продуктов окисления и высокая экзотермичность процесса, что делает этот процесс труднорегулируемым. Наибольшее распространение получили трубчатые реакторы со съемом тепла циркулирующим в межтрубном пространстве теплоносителем. Поэтому для обеспечения хорошей теплопроводности процессов и снижения износа катализатора выбор носителя имеет существенное значение. Для увеличения срока службы катализатора и поддержания его первоначальной активности предлагаются различные меры, например периодическая замена части загрузки катализатора, размещение по высоте реактора катализатора с различным содержанием активной массы, постепенное повышение температуры реакции; регулирование суммарного теплового эффекта реакции путем изменения состава и соотношения в подаче сырья, состоящего из смеси 1,2-дихлорэтана и других хлоруглеводородов С2 с различной степенью замещения хлором. Добавление полихлорэтанов к дихлорэтану позволяет вести процесс без избыточного выделения тепла, что устраняет местные перегревы и увеличивает срок службы катализатора.
Однако из-за высокой экзотермичности процесса окислительного хлорирования с участием медьсодержащего солевого трегерного катализатора возникают трудности, связанные со съемом тепла реакции, недостаточностью контакта с сырьем, что отрицательно сказывается на полноте хлорирования и на селективности процесса. Для улучшения теплопередачи, увеличения выхода и повышения селективности, сохранения активности катализатора фирмы «Du Pont» и «Lummus» разработали процессы оксихлорирования хлорпроизводных углеводородов Сг с при менением катализатора в виде расплава. В состав катализатора фирмы «Lummus» входят хлориды и оксиды Mn, Fe, Си, Со, Сг, а также хлориды К и Li. Указанный катализатор позволяет снизить температуру начала плавления до 260 °С. Процесс протекает при температуре 359-650°С, давлении 0,1-2 МПа и времени контакта 1-60 с. Описан процесс, в котором наряду с тетрахлорэтиленом образуется четыреххлористый углерод. Исходная реакционная смесь состоит из четыреххлористого углерода, хлоруглеводорода, хлороводорода и кислорода. Катализаторы состоят из хлоридов меди, щелочного и щелочноземельного металла, а также хлорида Fe, Zn, Mn, Cr, Ni, Pd и хлорида редкоземельного металла. Применение ка тализатора в виде расплава связано с повышенными энергозатратами и сильной коррозией оборудования.
Наиболее перспективным способом получения три- и тетра-хлорэтиленов в настоящее время является окислительное хлорирование хлорорганических отходов, позволяющее улучшить баланс процессов хлорирования по хлористому водороду.
Технологическая схема (рис. 1.2) процесса включает окислительное хлорирование полихлоридов С3, закалку реакционных газов, конденсацию и стабилизацию продуктов реакции /7/.
Окислительное хлорирование полихлоридов С3 осуществляется в трубчатом реакторе со стационарным слоем нанесенного медьсодержащего катализатора. Тепло реакции снимается циркулирующим в межтрубном пространстве теплоносителем, в качестве которого используется дифенильная смесь. Полихлориды С3, представляющие собой отходы производства глицерина и пропиленоксида, и НС1 (кислота) после предварительного нагрева в испарителях 2 и 1 соответственно перед поступлением в реактор-оксихлоратор 3 смешиваются. Соотношение исходных реагентов определяет состав конечных продуктов. Оксихлорирование осуществляется при температуре 400°С и времени контакта 5-8 с. Контактный газ после предварительного охлаждения в закалочном сопле 4 до 300°С за счет впрыска HCl-кислоты направляется в низ закалочной колонны 5. В закалочной колонне происходит охлаждение реакционных газов до 100°С, конденсация основной части хлоруглеродов и воды, отгонка хлоруглеводородов в виде азеотропной смеси с водой, а также абсорбция хлороводорода с получением 20%-й HCl-кислоты в кубе колонны. Хлоруглеводороды и HCl-кислота из куба закалочной колонны направляются в разделительный сосуд 7, откуда 20%-я кислота, после смешения ее со свежей кислотой, возвращается в процесс. Часть HCl-кислоты направляется для орошения в закалочную колонну и в закалочное сопло.
Принципиальная схема процесса окислительного хлорирования полихлоридов С3

Рис. 1.2.
1,2 - испарители; 3 - реактор; 4 - закалочное сопло; 5 - закалочная колонна; 6, 7, 9, 16, 20 - разделительные сосуды; 8 - колонна осушки; 10 - 15 -ректификационные колонны; 17, 18, 21, 22 - осушители; 19, 23 - сборные емкости; 24 - конденсаторы-холодильники; 25 - кипятильники.
I - НС1; II - воздух; III - полихлориды С3; IV - ССl4; V - NaOH; VI - C2HC13; VII -C2C14; VIII - стабилизатор; IX – ССl4, С2НС13; X - 1,2-дихлорпропан; XI - тяжелая фракция; XII - НС1, СО2; XIII - хлоруглеводороды; XIV - легкая фракция; XV - полихлорпропаны.
Реакционные газы с верха закалочной колонны, пройдя последовательно систему холодильников (водного и рассольного) поступают в разделительный сосуд 6. Водный слой направляется на орошение в закалочную колонну, а хлоруглеводороды из обоих разделительных сосудов 6 и 7 направляются в колонну азеотропной осушки 8. Хлоруглеводороды, содержащие небольшое количество воды, хлороводорода, хлора, диоксида углерода, поступают в колонну 8, где нейтрализуются за счет отгонки растворенных кислых газов и подвергаются азеотропной осушке. В сосуде 9 происходит разделение хлоруглеводородов и воды. Вода направляется на очистку сточных вод, а хлоруглеводороды - на орошение колонны осушки 8. С низа колонны азеотропной осушки хлоруглеводороды направляются на ректификацию (колонны 10-15). Кубовая жидкость колонны 10 представляет собой высококипящие хлоруглеводороды, такие как полихлорпропаны и пентахлорэтан, которые возвращаются в процесс оксихлорирования. В колонне 11 происходит отделение хлоруглеводородов с температурой кипения не выше 130°С, т. е. CCl4, C2HCl3, C2Cl4 и непрореагировавший дихлорпропан.
С верха колонны 12 уходит смесь четыреххлористого углерода и трихлорэтилена, а с низа - смесь тетрахлорэтилена и дихлорпропана. В колонне 13 с верха отгоняется непрореагировавший дихлорпропан, который возвращается в процесс, а с низа - тетрахлорэтилен-ректификат, который после обработки 10%-м раствором NaOH направляется на расслаивание в разделительный сосуд 16. Продукт, пройдя последовательно осушители 17 и 18, заполненные твердым гидроксидом натрия и хлоридом кальция, направляется в емкость 19, где происходит его стабилизация N-метилморфолином.
Для разделения четыреххлористого углерода и трихлорэтилена используются две ректификационные колонны 14 и 15. Четыреххлористый углерод отгоняется с верха колонны 14, а трихлорэтилен - с низа колонны 15. Трихлорэтилен-ректификат также подвергается обработке щелочью (20), сушке (21, 22) и стабилизации триэтиламином (23).
Отходящие газы оксихлорирования, содержащие кислород, диоксид углерода, незначительное количество хлороводорода, хлора и легких хлоруглеводородов, возвращаются в процесс. Часть отходящих газов постоянно выводится из системы и направляется в колонну 14, орошаемую захоложенным 1,2-дихлор-пропаном, где происходит абсорбция почти всех легких углеводородов, хлора, хлороводорода и диоксида углерода. Абсорбированные хлоруглеводороды после десорбции хлороводорода, хлора и диоксида углерода возвращаются в процесс оксихлорирования.
Удельный расход сырья и энергоресурсов при получении перхлоруглеродов окислительным хлорированием отходов хлорорганических производств: хлорорганические отходы - 0,73 т; НС1 - 0,35 т; кислород - 0,33 т; катализатор - 0,3 кг; энергия - 0,40 т. у. т.
Тетрахлорэтилен - универсальный негорючий растворитель, обладающий высокой растворяющей способностью по отношению к жирам, маслам, парафинам, различным смазкам, полимерам, что позволяет применять его для холодного и парового обезжиривания металлов, обработки текстиля, чистки одежды, сольвентной экстракции, в качестве полупродуктов в органическом синтезе, в производстве фреонов, клеев, аэрозольных упаковок, покрытий. Важным преимуществом тетрахлорэтилена является возможность его регенерации.
Мощности по тетрахлорэтилену в 1985 г. составляли в США /7/ - 380 тыс. т, в Европе - 450 тыс. т. Общая мощность для США и стран Западной Европы 1 млн. т/год. Производство в 1985 г. было на уровне 220 тыс. т в США, 100 тыс. т в ФРГ и 600-700 тыс. т в США и Западной Европе.
Производство тетрахлорэтилена в США в 1988 г. составило 224,8 тыс. т, а мощности установок на начало 1989 г. были на уровне 326,9 тыс. т. Спрос в США в 1988 г., в 1989 и 1993 гг. (оценка) находится на уровне 224,7 тыс. т.
Дата: 2019-07-30, просмотров: 356.
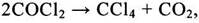 (1.2)
(1.2)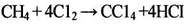 (1.3)
(1.3)