При выборе оптимальной температуры процесса необходимо выбрать наиболее низкую температуру и при этом обеспечить высокую кинетику реакции.
Для расчета кинетики особенностей процесса не было найдено в литературе необходимых данных.
Для интенсификации процесса обычно материал максимально измельчают, что увеличивает площадь контакта реагентов и увеличивается поверхностная энергия частиц. Повышение температуры значительно увеличивают скорость взаимодействия реагентов.
При крупности частиц (0,5 – 1) мм процесс хлорирования нельзя будет проводить в шахтном хлораторе и хлораторе кипящего слоя, без специальной подготовки сырья – грануляции. Хлорирование мелкодисперсного твёрдого сплава можно будет провести в эвтектическом расплаве хлоридов, температура плавления которых около 600 °С.
Лимитирующей температурой является температура начала процесса хлорирования вторсырья, которая была найдена экспериментально и составляет около 280 оС. При температуре 300 оС образовавшиеся соединения вольфрама возгоняется в возгоны более 95%. Хорошие результаты были получены при температуре хлорирования выше 360 оС, при этом извлечение ценного компонента составляет 98 – 99%.
4.2.2. Выбор стабильного сечения тройной системы, продукты реакций
Частичная триангуляция тройной системы W – O – Cl (рис.4.2.2) позволяет в каждом случае определить стабильные сечения, продукты реакций, соответствующие нестабильным сечениям, выделить частные тройные системы и на этой основе выбрать (с учетом данных табл.4.2.2) контролируемые методы синтеза индивидуальных фаз [3].
Таблица 4.2.2.1. Характеристики процессов сублимации, испарения и термического разложения высших (VI и V) галогенидов и оксогалогенидов вольфрама [3]
| Равновесие | Коэффициенты уравнения, Р - [Па] lgP = − А/Т + В | Интервал температур [°C] | Энтальпия парообразования [кДж/моль] | Температура [°С] | ||
| А | В | Tплав. | Tкип. | |||
| α-WCl6(т) → WCl6(п) β-WCl6(т) → WCl6(п) WCl6(ж) → WCl6(п) | 4400 3640 3220 | 12,48 10,98 10,22 | 180 – 231 231 – 291 291 – 300 | 84,4 70,2 62,1 | 270 - 281 | ~ 310 |
| WOCl4(т) → WOCl4(п) WOCl4(ж) → WOCl4(п) | 4789 2250 | 14,95 9,56 | 120 – 211 211 – 250 | 91,7 46,05 | 212 | ~ 300 |
| WO2Cl2(т) → WO2Cl2(п) 2WO2Cl2(т) → WO3(п) + WOCl4(п) | 5043 6514 | 11,67 15,175 | 230 – 290 250 – 350 | 96,6 131,9 | ~ 350 | ~ 350 |
2WOCl3(т)  WOCl2(п) +WOCl4(п) WOCl2(п) +WOCl4(п)
| 6660 | 16,95 | 230 – 280 | 136,0 | ~ 400 | |

Рис.4.2.2.1. Частичная триангуляция системы вольфрам – кислород – хлор [3]
Хлорирование твердосплавного сырья экономически выгодно провести при использовании анодного хлор-газа (содержание хлора ~ < 85%). Основные компоненты анодного хлор-газа это хлор и кислород. Как было показано в предыдущих разделах работы (4.1) наиболее удобным целевым продуктом при выбранных режимам является WOCl4. При помощи программы TERRA изучим свойства данной системы в приближении локального термодинамического равновесия. Данные для расчёта взяты из таблицы 4.2. Компоненты твердого сплава, количество которых меньше 0,1% не учитывались в расчетах.
При выборе количества кислорода необходимо избежать его избытка, во избежание образования WO2Cl2. Избыток хлора не влияет на показатели процесса.
Кислород расходуется на образование WOCl4 и СО2 (см. стр. № 35 реакции 1 и 3), следовательно, необходимая масса кислорода равна:
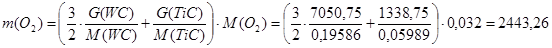 кг
кг
Хлор входит во все продукты реакций, и для изучения процесса хлорирования возмём хлор с избытком на 5%. Необходимая стехиометричеческая масса хлора равна:
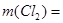
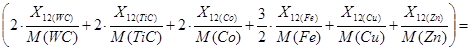
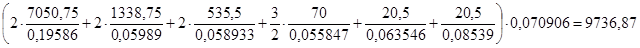 кг
кг
Для моделирования процесса хлорирования твердого сплава возьмем данные из таблицы 4.2.1, 10000 кг хлора и 2443 кг кислорода.
Таблица 4.2.2.2. Результат моделирования процесса хлорирования при помощи прграммы TERRA, при температуре 700°C и давлении 0,1 МПа.
| Химическая формула | Масса [кг] |
| WOCl4 | 12291,53 |
| WO2Cl2 | 5,9 |
| WCl4 | 0,3 |
| WCl6 | 0,6 |
| TiCl4 | 4239,3 |
| CoCl2(c) | 1179,9 |
| FeCl3 | 203,3 |
| CuCl2(c) | 43,2 |
| ZnCl2(c) | 28,4 |
| ZnCl2 | 14,4 |
| CO2 | 2567,6 |
| Cl2 | 904,57 |
| Всего: | 21479 |
4.2.2.1. Основные реакции протикающие при хлорировании твердосплавного лома
При рассмотрении таблицы 4.2.2.2 можно определить основные реакции.
1. 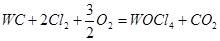
2. 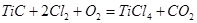
3. 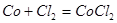
4. 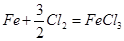
5. 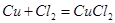
6. 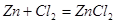
4.2.2.2 Краткая характеристика продуктов реакций
Таблица 4.2.2.2.1. Краткая характеристика продуктов реакций [11].
| Соединение | Температура плавления [°С] | Температура кипения [°С] | Плотность [г/см3] |
| WOCl4 – Оксодихлорид вольфкама (VI) | 212 | ~ 300 | н. д. |
| TiCl4 – Хлорид титана (IV) | -24,1 | +136,4 | 2,33(20°С) |
| CoCl2 – Хлорид кобальта (II) | 740 | 1049 | 3,367 |
| FeCl3 – Хлорид железа (III) | 307,5 | 316 | 2,898 |
| CuCl2 – Хлорид меди (II) | 596 | 993 | 3,386 |
| ZnCl2 – Хлорид цинка (II) | 293 | 733 | 2,907 |
Дата: 2019-05-29, просмотров: 378.