ОГЛАВЛЕНИЕ
1. Введение.. 5
2. Литературный обзор. 6
2.1. Твёрдые сплавы. 6
2.2. Классификация твёрдых сплавов. 7
2.3. Свойства твердых сплавов и области их применения. 8
2.4. Основные российские производители твёрдых сплавов. 12
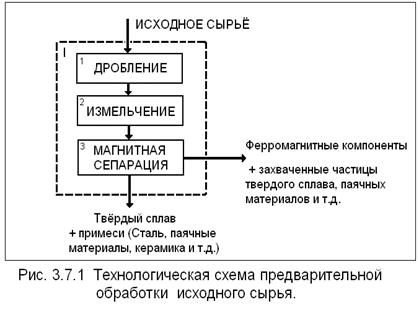
3. Предварительная обработка твёрдых сплавов. 17
3.1. Источники лома твёрдых сплавов. 17
3.2. Основные способы переработки твёрдых сплавов. 17
3.2.1. Хлорирование. 17
3.2.2. Методы регенерации твёрдого сплава. 18
3.2.3. Окислительные методы. 18
3.3. Основные этапы подготовки лома твёрдых сплавов. 19
3.4. Исходные данные: 21
3.5. Свойства компонентов вторичного сырья, которые могут быть использованы при разработке принципиальной технологической схемы процесса переработки сырья [6]. 22
3.6 Обоснование выбора стадий предварительной обработки сырья. 23
3.7. Выбор оборудования для предварительной обработки сырья. 25
3.7.1. Одновальцовая дробилка CEB 16/40. 25
3.7.2. Молотковая мельница CHM 23/20. 27
3.7.3. Магнитный сепаратор ПБС-63/50. 28
4. Хлорирование подготовленного сырья. 30
4.1. Хлориды и оксохлориды вольфрама. 30
4.1.2. Оксохлориды вольфрама. 32
4.2. Разработка способа хлорирования сырья. 33
4.2.1. Выбор параметров процесса хлорирования. 34
4.2.2. Выбор стабильного сечения тройной системы, продукты реакций. 34
4.3. Разработка принципиальной схемы.. 37
4.4. Разработка аппаратурно-технологической схемы.. 38
4.4.1. Аппаратурное оформление. 40
4.4.1. Аппаратурное оформление. 41
4.4.2.Описание схемы переработки твердого сплава. 41
5. Расчет материального баланса. 48
5.1 Уравнения материального баланса. 49
5.1.1. Расчет блока №1. 49
5.1.2. Расчет блока № 2. 50
5.1.3. Расчет блока № 3. 51
5.1.4. Расчет блока № 4. 51
5.1.5. Расчет блока № 5. 52
5.1.6. Расчет блока № 6. 52
5.2 Расчет технологической схемы в целом. 53
5.1. Уравнения материального баланса. 59
5.1.1. Расчет потоков: 60
5.1.2. Расчет циклонной пыли. 60
5.1.4. Количество связующих веществ в исходной шихте. 62
5.2 Окисление карбидов. 62
5.2.1. Окисление WC: 62
5.2.2. Окисление TiC: 63
5.2.3. Окисление Со: 64
5.2.4. Окисление Zn: 66
5.2.5. Окисление Си: 67
5.2.6. Окисление Ге: 68
5.2.7. Теоретическое количество воздуха. 70
5.5 Блок 5 Прокалка и сушка. 79
8. Вывод.. 85
9. Список литературы... 87
Введение
В настоящее время для производства режущих инструментов широко используются твердые сплавы. Они состоят из карбидов вольфрама, титана, тантала, сцементированных небольшим количеством кобальта. Карбиды вольфрама, титана и тантала обладают высокой твердостью, износостойкостью. Скорости резания инструментами, оснащенными твердыми сплавами, в 3-4 раза превосходят скорости резания инструментами из быстрорежущей стали.
В 2000 г. исключая Китай, было произведено около 30000 т твердых сплавов. Около 67% от всего количества твердых сплавов используется в мире в режущем инструменте.
Динамика развития производства твердых сплавов может быть проиллюстрирована следующим фактом: в период 1979-1991 гг., т.е. за 12 лет, спрос в мире на режущий инструмент удвоился.
Пропорционально использованию твердых сплавов растет количество амортизационного лома, брака при изготовлении инструментов, пылевидных отходов, образующиеся при заточке инструмента и т.д.
Данные виды отходов, возможно повторно переработать, что экономически более целесообразно чем производство металла из руды. Использование вторичного сырья позволяет решить ряд важнейших проблем: сохранение невосполнимых природных ресурсов; улучшение экологической обстановки; снижение капитальных и энергетических затрат; повышение производства редких металлов.
Цель данной работы состоит: в разработке схемы переработки лома твердых сплавов способом хлорирования, при заданных производительности, температуре обжига и способе подготовки сырья.
Подборе необходимого технологического оборудования.
Оценке экономической эффективности переработки.
Оценке данного процесса с точки зрения безопасности.
Литературный обзор
Твёрдые сплавы.
Твердые сплавы представляют собой композиционные материалы. Композиционный материал представляет собой высокопрочный или высокомодульный материал, называемый армирующим компонентом, соединенный со вторым материалом, называемым матрицей. Композиционные материалы обычно сочетают в себе свойства той и другой составляющих, однако модифицированные условиями их сосуществования.
Размеры частиц твердой карбидной и более мягкой цементирующей фаз обычно весьма малы и для большинства технических сплавов составляет 0,5-10,0 мкм.
Наиболее широкое развитие в области производства и применения получили инструментальные твердые сплавы, которые изготавливаются на основе карбида вольфрама, карбида титана, карбида тантала или сочетаний этих карбидов, иногда с карбидом ниобия, ванадия, хрома в качестве небольших добавок. "Цементирующим" металлом в сплавах служит кобальт, а иногда - никель, железо, молибден.
Сплавы отличаются высокой твердостью (HRA 82-92), сочетающейся с сопротивлением изнашиванию при трении о металлы и о неметаллические материалы, эти свойства сохраняются в значительной степени и при повышенных температурах.
Сплавы не подвергаются заметной пластической деформации при низких температурах и почти не подвержены упругой деформации: величина модуля упругости у твердых сплавов выше, чем у всех известных в технике материалов. Твердые сплавы отличаются также весьма высоким пределом прочности при сжатии. Значение предела прочности при изгибе и ударной вязкости этих сплавов невелики. Сплавы обладают относительно высокой теплопроводностью и электропроводностью, приближающейся к электропроводности железа и его сплавов. В химическом отношении твердые сплавы являются весьма устойчивыми против воздействия кислот и щелочей, некоторые сплавы заметно не окисляются на воздухе даже при 600-800°С. Изделия из твердых сплавов производятся методами порошковой металлургии, позволяющими создать сплавы из компонентов, значительно различающихся по температуре плавления. Наиболее тугоплавкие компоненты не должны подвергаться плавлению в целях придания сплаву нужных свойств.
Карбиды тугоплавких металлов групп IVА-VIA при повышенных температурах приобретают особые свойства. Для них характерны высокие значения модуля Юнга 2,8 • 105-6,5 • 106 МПа, в то время как для большинства переходных металлов эта величина равна 1,4 • 105-3 • 106 МПа. При комнатной температуре карбиды - хрупкие материалы, но при высоких температурах (около 1300 К) они переходят в пластичное состояние, а при температурах выше 1300 К пластически деформируются и известны как самые прочные материалы. Поскольку эти карбиды обладают такой исключительной термопрочностью и хорошей коррозионной стойкостью, их все более широко начинают применять как высокотемпературные конструкционные материалы в ядерной энергетике, ракетной и космической технике, в авиации и других областях. Карбиды используются там, где обычные сплавы не могут работать длительное время из-за слишком высоких рабочих температур. Например, карбид вольфрама (с никелем в качестве связующего) используют для изготовления колец, сопел и других деталей ракетных двигателей. [1]
Предварительная обработка твёрдых сплавов
Хлорирование.
1) Подготовленные отходы хлорируют смесью хлора с диоксидом углерода при 850-900°С. Образовавшиеся хлориды вольфрама (WC16), титана (TiCl4) и кобальта (СоС12) конденсируют раздельно и направляют на получение порошков металлов (водородное восстановление) или оксидов.
При хороших технологических показателях следует отметить громоздкость оборудования для хлорных схем, а также трудности, связанные с полнотой использования, агрессивностью и токсичностью хлора и хлоридов, необходимостью специальных коррозионностойких материалов для аппаратуры и значительными затратами на реагенты [4].
2) Отходы твердых сплавов перед хлорированием окисляются кислородом или кислородосодержащими газами (воздух, СО2, водяной пар), в результате чего выгорает углерод, а вольфрам и кобальт превращает в оксиды с образованием рыхлой, легко размалываемой массы, которая восстанавливается водородом или аммиаком, а затем активно хлорируется газообразным хлором. Извлечение вольфрама и кобальта составляет 97% и более [9].
Окислительные методы.
1) Cпекания с NaNO3
Распространенным способом переработки кусковых отходов твердых сплавов является их сплавление с NaNO3. Процесс ведут при 800-900°С. Плав измельчают и выщелачивают водой. Затем раствор вольфрамата натрия отделяют фильтрацией от нерастворимого осадка, содержащего оксид кобальта, и перерабатывают по известной технологии с получением паравольфрамата аммония.
Недостатком способа является значительный расход реагентов, большое количество циркулирующих растворов, разнообразие специальной аппаратуры, выделение агрессивных газов (NO, NO2) - ограничивают его применение. Этот метод целесообразно применять на предприятиях, перерабатывающих вольфрамовые концентраты. [4]
2) Окисление кислородом.
Возможна также переработка кусковых отходов твёрдых сплавов по схеме, предусматривающей окисление кислородом при 900-1000°С с последующим выщелачиванием WO3 из продукта обжига растворами соды или щелочи; можно перерабатывать и кусковые отходы твердых сплавов, содержащих вольфрам [3].
3) СВС-процесс
Для переработки отходов твердосплавного инструмента на основе карбидов тугоплавких металлов, содержащих Та, Nb, W, V, предложено использовать процесс самораспространяющегося высокотемпературного синтеза (СВС-процесс), который значительно интенсифицирует вскрытие отходов [4].
3.3. Основные этапы подготовки лома твёрдых сплавов.
Для правильной организации сбора, хранения, обезвреживания, обогащения и переработки вторичного сырья необходимо знать его состав, количество и свойства.
Перед выбором способа переработки вторичного сырья следует учитывать, что его состав в большинстве случаев существенно отличается от первичного. Поскольку в процессе эксплуатации может существенно изменяться вещественный и фазовый состав вторичного сырья (испарение, взаимная диффузия металлов и др.), возможно накопление токсичных и взрывоопасных соединений, загрязнение продуктами смазки и окисления. Это требует дополнительных операций, особенно на стадии обогащения.
Основные этапы подготовки лома твёрдых отходов включает:
Контроль радиоактивности, взрывоопасности и токсичности сырья. Особенно это касается лома изделий военной техники, в которых могут содержаться взрывчатые вещества, остатки твердого и жидкого топлива. Такое вторичное сырьё обязательно подвергается входному контролю на взрывобезопасность и присутствие токсичных и радиоактивных веществ.
Удаление и обезвреживание химических, взрыво - и радиационноопасных составляющих поступившего вторичного сырья;
Сортировка и выбор способа обогащения вторичного сырья, обычно это ручная сортировка.
Обезжиривание. Отсортированные грязные отходы загружают в установку для обезжиривания, где циркулируют пары перхлорэтилена. Этот растворитель удаляет смазку и масло. Смесь паров затем конденсируется для извлечения растворителя. Вредно воздействие перхлорэтилена.
Обдувка. Для удаления грязи, оксидов и ржавчины, обезжиренные отходы обдуваются дробью или металлическим порошком.
Травление и химическая обработка. Отходы от обдувки обрабатываются кислотами, чтобы устранить остаточную коррозию и окисные загрязнители.
Перед переработкой вторичное сырье нужно, пакетировать или (если это крупногабаритные детали) разрезать на куски, удобные для шихтовки или для дальнейшей переработки. В современной практике далеко не всегда имеются эффективные способы осуществления этих операций
Особо следует учитывать при разработке технологической схемы экологические проблемы. Выбранная схема должна характеризоваться минимальными объемами твердых отходов и сбросных растворов, предусматривать улавливание и утилизацию газообразных продуктов; по возможности не должны использоваться ядовитые вещества (ртуть, кадмий и др.).
Для переработки многокомпонентного вторичного сырья, разрабатывается, как правило, несколько альтернативных схем. Они подвергаются опытно-промышленной проверке, а затем выбирается схема, оптимальная по технико-экономическим, экологическим и другим показателям [6].
Исходные данные:
Сырье (вторичное): Лом твердых сплавов - режущие части металлорежущих инструментов (резцы, фрезы, сверла и т.п.), брак при изготовлении инструментов, фильеры, стеклорежущий инструмент, шары из мельниц барабанного типа, жаропрочные покрытия частей реактивных двигателей, футеровки химических реакторов и т.п.
Фазовый состав: Гетерогенный материал, представляющий собой смесь карбидной фазы (карбидов вольфрама и титана), связующий материал - металлический кобальт, металлические сплавы основы инструмента (чаще всего сталь марки СТ3, инструментальные и нержавеющие стали), паечные и сварные материалы (медь, цинк, олово, свинец), возможно присутствие керамических материалов.
Химический состав: Вольфрам, титан, кобальт, углерод, железо, хром, никель, медь и др.
Гранулометрический состав: Куски размером до 150-200 мм неправильной формы, обломки 5-50 мм, порошки 0,1-1,5 мм, пылевидный частицы до 30 мкм.
Свойства: а) механические - исключительно твердые и хрупкие карбиды, более мягкие металлические сплавы, мягкие паечные материалы (привести данные по шкале твердости Нб);
б) химические - растворимость в различных реагентах, действие газообразного хлора на твердую фазу, действие хлора на тот же материал, находящийся в расплаве хлоридов (натрия, калия или др. элементов) окисляемость при нагревании и обжиге и т.д.
Объем переработки: 10 тонн в год.
Способ переработки: Хлорирование лома твердых сплавов с получением TiCl4, WОСl4 и последующей переработкой на товарный TiO2 и WO3
Задание:
Выбрать способ хлорирования и составить схему переработки вторичного сырья (лома твердых сплавов)
Рассчитать материальный и тепловой баланс (химический состав сырья рассчитать, исходя из тв. сплава марки Т15К6 (15% карбида титана 6% металлического кобальта, остальное – карбида вольфрама), количество твердосплавной фазы принять 90%, Остальные 10% составляют примеси:
(железо - 7%, медь - 0,3%, цинк - 0,3%, хром - 0,7%, никель - 0,7%, марганец - 0,9%, кремний - 0,1%).
Подобрать необходимое технологическое оборудование.
Оценить данный процесс с точки зрения безопасности.
3.5. Свойства компонентов вторичного сырья, которые могут быть использованы при разработке принципиальной технологической схемы процесса переработки сырья [6].
Таблица 3.5.1
| Компонент | Состав компонента% | Содержание во вторичном сырье% | Плотность, кг/м3 | Температура плавления, oC | Электрическое сопротивление, Ом·м | Тип магнетика | Краткие химические свойства компонента |
| Твёрдый сплав Т15К6 | TiC ~ 15,0 Co ~ 6,0 Остальное WC | 90 | 11100–11600 | - | ~ 10 · 10-8 | Парамагнетик | Устойчив против воздействия кислот и щелочей, не окисляются на воздухе до температуры 600-800°С. |
| Сталь СТ3 | C ~ 0,1 – 0,22 Si ~ 0,15 – 0,3 Mn ~ 0,4 – 0,65 Ni до 0,3 Cr до 0,3 Cu до 0,3 Остальное Fe | 9,4 | 7700-7800 | 1300-1400 | ~ 9,0 · 10-8 | Ферромагнетики |
Медленно окисляется во влажном воздухе. Не реагирует с водой, гидратом аммиака; пассивируется в концентрированных серной и азотной кислотах, разбавленных щелочах. Реагирует с разбавленными кислотами, концентрированными щелочами, неметаллами, монооксидом углерода. Вытесняет благородные металлы из их солей в растворе. |
| Инструмен-тальная сталь | C ~ 0.8 - 1.0 Si ~ 0.25 Mn ~ 0.25 - 0.30 Cr ~ 0.15 Остальное Fe | ||||||
| Нержавеющая сталь | C < 0,12 Si ~ 1.0 Mn ~ 1,5 Ni ~ 5.0 Cr ~ 15 Остальное Fe | Не реагируют с водой, щелочами, гидратом аммиака; пассивируется в концентрированных серной и азотной кислотах, разбавленных щелочах. Медленно реагирует с разбавленными HCl и H2SO4 кислотами. | |||||
| Паечные материалы | 55% Cu, остальное Zn | 0,6 | 8400 | 1343 - 1143 | 40 · 10-8 | Диамагнетик | Не реагируют с водой, разбавленной хлороводородной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии О2, цианидом калия. Окисляется концентрированными серной и азотной кислотами, "царской водкой", кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами. |
3.6 Обоснование выбора стадий предварительной обработки сырья.
Первые стадии переработки лома связаны с операциями измельчения и обогащения.
Измельчение обычно проводят в молотковых дробилках с классификацией и возвратом крупной фракции на начальную стадию.
Для разделения сложного многокомпонентного вторичного сырья применяют различные методы обогащения: воздушную сепарацию, гидродинамическое обогащение, электростатическую сепарацию, магнитную сепарацию, флотацию и др.
Электромагнитная сепарация
Метод основан на различии в магнитных свойствах компонентов вторичного сырья.
При разработке схемы переработки сырья можно использовать электромагнитную сепарацию. Данный метод позволит нам легко отделить сильномагнитные частицы − ферромагнетики.
Таблица.3.6.1 Магнитная восприимчивость материалов.
| Вид материала | Магнитная восприимчивость материалов − χ | Рекомендуемая напряженность магнитного поля, кА/м |
| Ферромагнетики (Сталь) | χ>>1 | 100 − 150 |
Электростатическая сепарация
Метод основан на различии в электропроводности, электроёмкости и диэлектрических свойствах сырья.
При разработке схемы переработки сырья невозможно использовать электростатическую сепарацию т. к. в исходном сырье нет диэлектриков.
Гравитационное обогащение
Метод основан на различии в плотностях и скоростях падения частиц разделяемого сырья в воздухе (пневматический метод) или в жидких средах (гидродинамический метод).
Таблица 3.6.2. Плотность компонентов. [кг/м3]
При разработке схемы переработки сырья можно использовать гравитационное обогащение. Этот метод обогащения не даст хороших результатов по причине небольшой разности плотностей и небольшого количества примесей [6].
3.7. Выбор оборудования для предварительной обработки сырья.
Исходя из заданного состава компонентов, гранулометрического состава вторичного сырья и выбранного способа переработки, сырьё необходимо измельчить до размера до 1,0 мм, что обеспечит высокую скорость хлорирования. Для этого нужно провести дробление и измельчение на соответствующем оборудовании. Так же желательно провести обогащение исходного сырья. Обогащение позволит избежать ненужных отходов, сэкономит реактивы, энергию и упростит очистку продуктов.
Степень обогащения при использовании магнитной сепарации зависит от крупности частиц, для улучшения показателей обогащения, магнитную сепарацию нужно провести после измельчения исходного сырья.
Основной проблемой схемы предварительной обработки сырья является измельчение.
Оксохлориды вольфрама
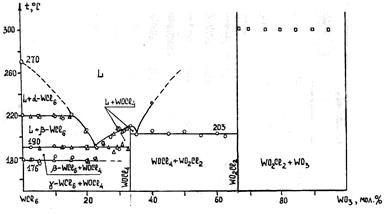 |
Рис.4.2.1. Диаграмма конденсированного состояния системы WCl6 – WO3
Высшие оксохлориды вольфрама WOC14 и WO2C12 кристаллические вещества, гидролизующиеся во влажном воздухе. Диоксодихлориды менее склонны к гидролизу. WOC14 образует темно-красные игольчатые кристаллы тетрагональной сингонии. WO2C12 - светло-желтое кристаллическое вещество. WOC14 плавится и испаряется без заметного разложения; расплавить WO2C12 под обычным давлением не удается, так как он разлагается на WO3 и паровую фазу, содержащую молекулы WOC14 и WC16. WOC14 не образует прочных комплексов с хлоридами щелочных металлов.
Вольфрам в степени окисления (V) образуют оксотрихлорид WOCl3. WOCl3 термически не устойчив, диспропорционирует на WOCl2 и WOCl4
Оксодихлорид WОС12 - химия этого вещества изучена недостаточно. Температура кипения намного выше WOCl4 [3].
Расчет блока №1
G01=10000 кг
Производительность по поступающему сырью можно рассчитать по производительности самого меленого аппарата (см.3.7.1). При работе аппарата 7 часов в сутки производительность равна: 230 кг/ч · 7 ч = 1610 кг
В дробилке и мельнице твердосплавный лом измельчается до крупности частиц 0,5 – 1 мм.
Магнитная сепарация разделяет данное сырье на две части – твердосплавный концентрат и ферромагнитный концентрат.
Данный поток был рассмотрен в таблице 3.7.3, и расчитан в таблице 4.2.1. Следовательно:
G10 = 940 кг
G12 = G01 − G10
G12 = 10000 – 940 = 9060 кг
Потоки компонентов G12 и G10 равны:
| G12 – твердосплавный концентрат | G10 – ферромагнитный концентрат |
| X12(WC) = 7050,75 X12(TiC) = 1338,75 X12(Co) = 535,5 X12(Fe) = 70 X12(Cu) = 20,5 X12(Zn) = 20,5 | X10(WC) = 59,3 X10(TiC) = 11,2 X10(Co) = 4,5 X10(Fe) = 835 X10(Cu) = 9,5 X10(Zn) = 9,5 |
Расчет блока № 2
В блок 2 поступает измельченное и обогащенное сырье не более 1 мм.
Продуктами хлорирования являются WOCl4, TiCl4, CoCl2, FeCl3, CuCl2, ZnCl2, не прохлорировавший твёрдый сплав ~ 2%.
Летучие WOCl4, TiCl4 и FeCl3 возгоняются и направляются на солевую очистку и конденсацию. Не летучие CoCl2, CuCl2, ZnCl2 остаются в расплаве NaCl – KCl, также в расплаве остается некоторое количество FeCl3, доля FeCl3 задержаного в расплаве примем ~ 40%. Не прореагировавший карбид также остается в расплаве.
Для расчета материального баланса нам необходимо знать состав тведосплавного концентрата, идущего на хлорирование и протекающие реакции. Химический состав сырья идущий на хлорирование представлен в таблице 4.2.1, основные протекающие реакции представлены в разделе 4.2.2.1.
Поток G021: Данный поток был расчитан в пункте 4.2.2.
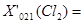
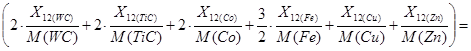
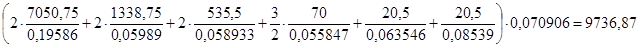 [кг/год]
[кг/год]
При избытке Cl2 на 5%
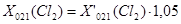 =10223
=10223
X021(Cl2) = 10223 [кг/год]
X021(O2) = 2443 [кг/год]
G021 = X12(Cl2) + X12(O2) = 12043 [кг/год]
Поток G022: Данный поток рассчитывается из сходя из того, что при содержании CoCl2 ~ 10% в расплаве, расплав сливают на переработку.
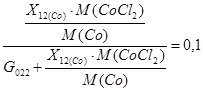
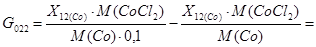
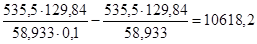 [кг/год]
[кг/год]
Т. к. NaCl − 50% и KCl − 50% следовательно
X022(NaCl) = 5309,1 [кг/год]
X022(KCl) = 5309,1 [кг/год]
Поток G23:
G23 = G12 + G021 + G022 + G32 − G24
Поток G24: В поток G24 переходят летучие WOCl4, TiCl4 и 60% FeCl3.
Расчет блока № 3
Поток G32: Данный поток рассчитывается из сходя из того, что отстаивание обеспечивает очистку от не прохлорировавшего твердого сплава примерно на 80%, который возращают на дохлорирование, остальные 20% переходят в поток G30. С не прохлорировавшим твердвм сплавом в поток G32 переходит 10% расплава.
Поток G30:
G30 = G23 − G32
Расчет блока № 4
Поток G04: Данный поток рассчитывается из сходя из того, что при содержании FeCl3 ~ 10% в расплаве, расплав сливают на переработку.
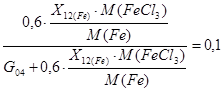
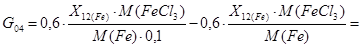
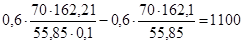 [кг/год]
[кг/год]
Т. к. NaCl − 50% и KCl − 50% следовательно
X022(NaCl) =550 [кг/год]
X022(KCl) = 550 [кг/год]
Поток G40:
G40 = G24 + G04 − G45
G40 = G04 + X24(FeCl3) = G04 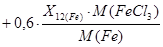 =1100 +
=1100 + 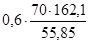 =1222 [кг/год]
=1222 [кг/год]
Поток G45: В поток G24 переходят летучие WOCl4, TiCl4
Расчет блока № 5
Поток G501: Конденсированный WOCl4(т)
Поток G502: Неконденсируемые газы Cl2, СO2.
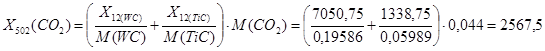 [кг/год]
[кг/год]
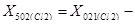
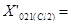 10223,7−
10223,7− 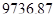 =486,8 [кг/год]
=486,8 [кг/год]
G502 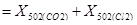 = 2567,5 + 486,8 = 3054,3 [кг/год]
= 2567,5 + 486,8 = 3054,3 [кг/год]
Поток G56: Конденсированный TiCl4(ж) и WOCl4(т) − 10%
Расчет блока № 6
Поток G65: Пульпа WOCl4(т) − 90%, TiCl4(ж) − 10%
Поток G60: TiCl4(ж) − 100%
Расчет потоков:
Поток Хк2ц равен:
Хи„=3, 202
Найдем количества веществ в этом потоке:
Xk2ii(WC): 0,2*0,78*0,1*172,18=2,686
ХииСТЮ): 0,2*0,15*0,1*172,18=0,516
Поток X2i равен:
Х2] =2,082
Найдем количества веществ в этом потоке:
X2i(WC): 0,65*0,02*0,78*172,18=1,746 X2i(TiC): 0,65*0,02*0,15*172,18=0,336
Поток X22i равен:
X22i(WC): 0,15*0,01*0,78*172,18=0, 201
X22i(TiC): 0,15*0,01*0,15*172,18=0,039
Расчет циклонной пыли.
Количество карбида окисляемого в циклоне в виде металлов (Со, Zn, Cu, Fe), (кг/ч): 3, 202*(0,06+0,006+0,003+0,001) /(0,78+0,15) = 0,241
Количество оксидов в циклоне без учета оксидов поступающих из шихты:
X'o22i = 0,2 *0,9*Xi=30,992
Количества оксидов, (кг/ч):
По реакции (1) WO3: 0,78*30,992*231,82/195,86=28,612
По реакции (2) ТЮ2: 0,15*30,992*79,88/59,84=6, 206
По реакции (3) СоО: (0,06*(30,992+0,241)) *74,93/58,93=2,383
По реакции (4) ZnO: (0,06*(30,992+0,241)) *81,39/65,39=0,233
По реакции (5) Си2О: (0,06*(30,992+0,241)) *143,1/2*63,55=0,105
По реакции (6) Fe2O3: (0,06*(30,992+0,241)) *231,55/2*55,85=0,065
Суммарное количество оксидов, (кг/ч): 37,604
Таблица 6. Количество оксидов в циклоне без учета оксидов поступающих из шихты.
| W03 | ТЮ2 | СоО | ZnO | Cu2O | Fe203 | всего | |
| кг/ч | 28,612 | 6, 206 | 2,383 | 0,233 | 0,105 | 0,065 | 37,604 |
| % | 76,088 | 16,504 | 6,337 | 0,620 | 0,279 | 0,173 | 100 |
Итоговое количество оксида в шихте:
Хо2ц=37,604+0,2*Хо2ц
0,8*Х211=37,604
Xo2i 1=47,005 кг/ч
Количество оксида приходящее из шихты в циклон:
0,2*Xo2i 1=9,401 кг/ч
Состав и количество приходящих в циклон оксидов их шихты, (кг/ч):
WO3: 9,401*0,761=7,154
ТЮ2: 9,401*0,165=1,551
СоО: 9,401*0,063=0,592
ZnO: 9,401*0,006=0,056
Cu20: 9,401*0,003=0,028
Fe2O3: 9,401*0,003=0,019
Итоговое суммарное состав и количество оксидов, (кг/ч):
WO3: 7,154 + 28,612=35,766
ТЮ2: 1,551+6, 206=7,757
СоО: 0,592+2,383=2,975
Си20: 0,028+0,105=0,133
ZnO: 0,056+0,233=0,289
Fe2O3: 0,019+0,065=0,084
Окисление карбидов.
Окисление WC:
Распределение компонента, (кг/ч):
огарок: 134,636*0,65=87,513
пыль циклона: 134,636*0, 20=26,927
пыль рукавного фильтра: 134,636*0,15=20, 195
Основная реакция: WC + 2.5О? = WCb + ССЬ
М=195,86 М=16 М=231,82 М=44,01 (г/моль)
1) в огарке окислится: 26,927*0,9= 85,763 кг/ч Расходуется кислорода, (кг/ч):
02: 85,763*2,5*2*16/195,86=17,515
Образуется веществ, (кг/ч):
С02: 85,763*44,01/195,86=19,272
WO3: 85,763*231,82/195,86=101,509
Оксида WO3 в исходной шихте, (кг/ч): 47,005*0,65*0,761=23,251
Суммарное количество WOs, (кг/ч): 124,76
2) в циклоне окислится: 26,927*0,9=24,234 кг/ч Расходуется кислорода, (кг/ч):
О2: 24,334 * 2,5*2*1,6/195,86 = 4,949 Образуется веществ, (кг/ч): СО2: 24,334*44,01/195,86=5,445
WO3: 28,612
Оксида WO3 в исходной шихте, (кг/ч): 47,005*0,2*0,761=7,154
Суммарное количество WO3, (кг/ч): 35,76
3) в рукаве окислится: 20, 195*0,99=19,993 кг/ч
Расходуется кислорода, (кг/ч):
О2: 19,993*2,5*2*16/195,86=4,083
Образуется веществ, (кг/ч):
СО2: 19,993*44,01/195,86=4,492
W03: 19,993*231,82/195,86=23,664
Оксида WO3 в исходной шихте, (кг/ч): 47,005*0,15*0,761=5,366
Суммарное количество WO3, (кг/ч): 29,03
Окисление TiC:
Распределение компонента, (кг/ч):
огарок: 25,531*0,65=16,595
пыль циклона: 25,531*0, 20=5,106
пыль рукавного фильтра: 25,531*0,15=3,830
Основная реакция: TiC + 2OZ = TIP? + СО?
M=59,84 M=16 М=79,88 М=44,01 (г/моль)
1) в огарке окислится: 16,595* 0,98=10,787 кг/ч Расходуется кислорода, (кг/ч):
02: 10,787*2*2* 16/59,84=5,768 кг/ч
Образуется веществ, (кг/ч):
ТЮ2: 10,787*79,88/59,84=14,399
СО2: 10,787*44,01/59,84=7,933
Оксида ТЮ2 в исходной шихте, (кг/ч): 47,005*0,65*0,165=5,042
Суммарное количество ТЮ2, (кг/ч): 12,975
2) в циклоне окислится: 5,106*0,9 =3,319 кг/ч Расходуется кислорода, (кг/ч):
О2: 3,319*2*2*16/59,84=1,331
Образуется веществ, (кг/ч):
СО2: 3,319*44,01/59,84=2,441
ТЮ2: 6, 206
Оксида ТЮ2 в исходной шихте, (кг/ч): 47,005*0, 20*0,165=1,551
Суммарное количество ТЮ2, (кг/ч): 12,975
3) в рукаве окислится: 3,830*0,99=2,498 кг/ч Расходуется кислорода, (кг/ч):
02: 2,489*2*2*16/59,84=1,331
Образуется веществ, (кг/ч):
ТЮ2: 2,489*79,88/59,84=3,322
С02: 2,489*44,01/59,84=1,831
Оксида ТЮ2 в исходной шихте, (кг/ч): 47,005*0,15*0,165=1,163
Суммарное количество ТЮ2, (кг/ч): 4,485
Окисление Со:
Распределение компонента, (кг/ч):
огарок: 10*0,65=6,5
пыль циклона: 10*0,2=2,0
пыль рукавного фильтра: 10*0,15=1,5
Реакции: а) Со + 0.5От= СоО
М=58,93 М=16 М=74,93 (г/моль)
б) 2СоО + 0.5О7 = CozCb М=74,93 М=16 М=165,86 (г/моль)
Весь СоО оседает в циклоне, а Со2Оз образуется в огарке и пыли рукавного фильтра. СоО приходящий с исходной шихтой (оборотный) окисляется до Со2Оз нацело.
1) в огарке окислится: 6,5кг/ч По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 6,5* 16/58,93=1,765 Образуется веществ, (кг/ч):
Считаем, что СоО из шихты образуется 100% -98%=2%: 6,5* 2%=0,13
Из этого СоО по реакции (б) не будет доокисляться: 0,13*74,94/58,93=0,165
СоО: 6,5*74,93/58,93=8,265
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 8,965*16/165,86=0,865 Образуется веществ, (кг/ч):
СогО3: (8,265-0,165) * 165; 86/2*7,493=8; 965
Оксида СоО в исходной шихте, (кг/ч): 47,005*0,65*0,063=1,934 Со203: 1,934*165,86/2*7,493=2,140 Суммарное количество Со2Оз, (кг/ч): 11,105
2) в огарке окислится: 2,0 кг/ч
В циклоне окисление идет до СоО.
Расходуется кислорода, (кг/ч):
О2: 2,0*16/58,93=0,543
Образуется веществ, (кг/ч):
СоО: 2,383
Оксида СоО в исходной шихте, (кг/ч): 47,005*0, 20*0,0,063=0,592
Суммарное количество СоО, (кг/ч): 2,975
3) в рукаве окислится: 1,5 кг/ч По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 1,5*16/58,93=0,407 Образуется веществ, (кг/ч):
Считаем, что СоО из шихты образуется 100% -99%=1%: 1,5* 1%=0,015
Из этого СоО по реакции (б) не будет доокисляться: 0,015*74,94/58,93=0,019
СоО: 1,5*74,93/58,93=1,907
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: (1,907 - 0,019) * 16/165,86=0,182
Образуется веществ, (кг/ч):
Со2О3: (1,907-0,019) * 165,86/2*74,93=2,091
Оксида СоО в исходной шихте, (кг/ч): 47,005*0,15*0,063=0,444
Со203: 0,444*165,86/2*74,93=0,492
Суммарное количество Со2Оз, (кг/ч): 2,583
Окисление Zn:
Распределение компонента, (кг/ч):
огарок: 1,0*0,65=0,65
пыль циклона: 1,0*0, 20=0, 20
пыль рукавного фильтра: 1,0*0,15=0,15
Основная реакция: Zn + 0,50? = ZnO
М=65,39 М=16 М=81,39 (г/моль)
1) в огарке окислится: 0,65 кг/ч Расходуется кислорода, (кг/ч):
О2: 0,65*16/65,39=0,159 Образуется веществ, (кг/ч):
ZnO: 0,65*81,39/65,39=0,809
Оксида ZnO в исходной шихте, (кг/ч): 47,005*0,65*0,006=0,188 Суммарное количество ZnO, (кг/ч): 0,997
2) в циклоне окислится: 0,2 кг/ч Расходуется кислорода, (кг/ч):
02: 0,2*16/65,39=0,049 Образуется веществ, (кг/ч):
ZnO: 0,233
Оксида ZnO в исходной шихте, (кг/ч): 47,005*0, 20*0,006=0,056 Суммарное количество ZnO, (кг/ч): 0,289
3) в рукаве окислится: 0,15кг/ч Расходуется кислорода, (кг/ч):
02: 0,15*16/65,39=0,037 Образуется веществ, (кг/ч):
ZnO: 0,15*81,39/65,39=0,187
Оксида ZnO в исходной шихте, (кг/ч): 47,005*0,15*0,006=0,043 Суммарное количество ZnO, (кг/ч): 0,230
Окисление Си:
Распределение компонента, (кг/ч):
огарок: 0,5*0,65=0,325
пыль циклона: 0,5 *0, 20=0,1
пыль рукавного фильтра: 0,5*0,15=0,075
Реакции: а) 2Си + 0.5О2 = СшО
М=63,552 М=16 М=143,1 (г/моль)
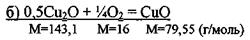
По реакции (а): Расходуется кислорода, (кг/ч): О2: 0,325*16/63,552*2=0,041 Образуется веществ, (кг/ч): Си2О: 0,325*143,1/63,55*2=0,366
Оксида Си2О в исходной шихте, (кг/ч): 47,005*0,65*0,003=0,086
Из исходной шихты Си2О окисляется до СиО нацело. Из окислившегося Си2О по реакциям не будет окисляться до СиО 100% -98%=2%: 0,366*2%=0,007кг/ч Отношение распределения образования оксидов: Cu20/CuO = 2/1 0,366*0,98=0,359 кг/ч следовательно образуется: Си2О=0,244 кг/ч и 0,122 кг/ч идет на доокисление до СиО Суммарное количество Си2О, (кг/ч): 0,007+0,244=0,251
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 0,232*1/4*32/79,56=0,023
Образуется веществ, (кг/ч):
СиО: (0,122+0,086) *79,55/143,1* 1/2=0,232
2) в циклоне окислится: 0,1 кг/ч
Будем считать, что реакция идет до образования Си2О.
Расходуется кислорода, (кг/ч):
02: 0,1*16/2*63,55=0,013
Образуется веществ, (кг/ч):
Си20: =0,105
Оксида Си2О в исходной шихте, (кг/ч): 47,005*0, 20*0,003=0,028
Суммарное количество Си2О, (кг/ч): 0,133
3) в рукаве окислится: 0,075кг/ч По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 0,075*169/2*63,55=0,009 Образуется веществ, (кг/ч):
Си2О: 0,075*143,1/63,55*2=0,084
Оксида Си2О в исходной шихте, (кг/ч): 47,005*0,15*0,003=0,002
Из исходной шихты Си2О окисляется до СиО нацело. Из окислившегося Си2О по реакциям
не будет окисляться до СиО 100% -99%=2%: 0,084*1%=0,001кг/ч
Отношение распределения образования оксидов: Cu20/CuO = 2/1
0,084*0,99=0,083 кг/ч следовательно образуется:
Си2О=0,056 кг/ч и 0,028 кг/ч идет на доокисление до СиО
Суммарное количество Си2О, (кг/ч): 0,001+0,056=0,057
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 0,053*1/4*32/79,55=0,005
Образуется веществ, (кг/ч):
СиО: (0,028+0,133*0,15) *79,55=0,005
Окисление Ге:
Распределение компонента, (кг/ч):
огарок: 0,167*0,65=0,108
пыль циклона: 0,167*0,2=0,033
пыль рукавного фильтра: 0,167*0,15=0,025
Реакции: a) Fe + 0.50? = FeO
М=55,85 М=16 М=71,85 (г/моль)
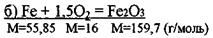
1) в огарке окислится: 0,108 кг/ч
Отношение распределения образования оксидов: РеаОз/ FeO =3/1=0,081/0,027
По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 0,027*16/55,85=0,008
Образуется веществ, (кг/ч):
FeO: 0,027*71,85/55,85=0,035
По реакции (б):
Расходуется кислорода, (кг/ч):
02: 0,081*1,5*32/55,85*2=0,04
Образуется веществ, (кг/ч):
FeiOs: 0,081*159,7/2*55,85=0,116
Оксида FeiOs в исходной шихте, (кг/ч): 47,005*0,65*0,002=0,065
Суммарное количество Ре2Оз, (кг/ч): 0,181
2) в циклоне окислится: 0,033кг/ч
В циклоне окисление идет до РеаОз.
Расходуется кислорода, (кг/ч):
О2: 0,033*1,5*32/55,85*2=0,014
Образуется веществ, (кг/ч):
РегОз =0,065
Оксида Ре2Оз в исходной шихте, (кг/ч): 47,005*0, 20*0,002=0,019
Суммарное количество Ре2Оз, (кг/ч): 0,084
1) в огарке окислится: 0,025 кг/ч
Отношение распределения образования оксидов: РезОз/ FeO =3/1=0,019/0,006
По реакции (а):
Расходуется кислорода, (кг/ч):
О2: 0,006*16/55,85=0,002
Образуется веществ, (кг/ч):
FeO: 0,006*71,85/55,85=0,008
По реакции (б):
Расходуется кислорода, (кг/ч):
О2: 0,019*1,5*32/55,85*2=0,008
Образуется веществ, (кг/ч):
FeiOs: 0,019*159,7/2*55,85=0,027
Оксида Ре2Оз в исходной шихте, (кг/ч): 47,005*0,15*0,002=0,013
Суммарное количество Ре2Оз, (кг/ч): 0,04
Блок 5 Прокалка и сушка.
WOs получают термическим разложением H2WC4 при 750-800 °С
При прокалке идет следующая реакция:
H2WO4^WO3+H2O
Количество продуктов, (кг/ч):
Масса WO3 =153,79 (кг/ч)
Масса Н2О = 165,765-153,76= 11,075 (кг/ч)
Вывод: полученная нарастающая с каждой стадией невязка до 3,626% вызвана погрешностью расчетов.
Операция №1
Переведем заданный базис из объема в массу.
m = V * ρ
m = 1000 * 1,120 = 1120т или 1120000кг.
1). G01 = 1120000
2Fe3+ + Fe → 3Fe2+
m (Fe) = mр-ра / ρр-ра * (с(Fe3+) / М(Fe2O3)) * M(Fe)
Для того, чтобы считать восстановление полным, введем 10% избыток железной стружки.
G011 = G01 / 1,120 * 0,005 /159,7 * 55,8 * 1,1 = 0,001715828 * G01
2). G011 - 0,001715828 * G01 = 0
Операция №2
3). G12 – G01 – G011 = 0
При экстракции соотношение объемов водной (сернокислый раствор) и органической (раствор 0,1 моль/л Д2ЭГФК в керосине) равно 10, т.е. Vв: Vо = 10: 1. Такое соотношение фаз берётся для большего концентрирования ценного компонента.
V = m / ρ
Vв = G12 / ρ12; Vо = G050 / ρ050
10 * ρ12 * G050 = G12 * ρ050
G050 = G12 * ρ050 / 10 * ρ12
G050 = G12 * 0,744 / 10* 1,120 = 0,0664285 * G12
4). G050 – 0,0664285 * G12 = 0
G200 = G12 - G01 / 1,120 * 0,05 (ThO2) - G01 / 1,120 * 0,2 (TiO2) - G01 / 1,120 * 0,57 (РЗЭ) - G01 / 1,120 * 0,4 (V2O5) - G01 / 1,120 * 0,02 * 0,999 (Sc2O3)
5). G200 - G12 + 0,001107125 = 0
6). G23 - G050 - G12 + G200 = 0
Операция №3
При реэкстракции примесей соотношение объемов водной (Раствор 4,5 моль/л H2SO4) и органической (Экстракт содержащий Sc, Ti, Fe3+, РЗЭ и др.) равно 1, т.е. Vв: Vо = 1: 1. Такое соотношение фаз берётся для лучшего извлечения примесей.
G030 = G23 * ρ030 / ρ23
G030 = 1,260 / 0,744 * G23 = 1,693548387 * G23
7). G030 - 1,693548387 * G23 = 0
G300 = G030 + (G01 / 1,120 * 0,05 (ThO2) + G01 / 1,120 * 0,2 (TiO2) + G01 / 1,120 * 0,57 (РЗЭ) + G01 / 1,120 * 0,4 (V2O5)) - G01 / 1,120 * 0,02 * 0,999 (Sc2O3)
8). G300 - G030 – 0,001089285 * G01
9). G34 – G030 – G23 + G300 = 0
Операция №4
При реэкстракции скандия соотношение объемов водной (Раствор 2,5 моль/л NaOH) и органической (Органическая фаза содержащая Sc) равно 0,1, т.е. Vв: Vо = 1: 10. Такое соотношение фаз берётся для большего концентрирования ценного компонента (скандия).
G040 = G34 * ρ040 / 10 * ρ34
G040 = 1,110 / 10 * 0,744 * G34 = 0,147849462 * G34
10). G040 - 0,147849462 * G34 = 0
G45 = G34 – m(Sc3+) + m(Na+)
ScA3 + 3 NaOH → Sc(OH) 3 + 3 NaA
m(Sc3+) = (G01 /1,120 * 0,02 * 0,999) / M(Sc2O3) * 2 * M(Sc(OH) 3) = (G01 /1,120 * 0,02 * 0,999) /137,91 * 2 * 95,97792 = 0,00002483 * G01
m(Na+) = (G01 /1,120 * 0,02 * 0,999) / M(Sc2O3) * 6* M(Na) = (G01 /1,120 * 0,02 * 0,999) / 137,91 * 6* 22,9897 = 0,000017842 * G01
G45 = G34 – 0,000006987 * G01
11). G45 – G34 + 0,000006987 * G01 = 0
12). G46 – G040 – G34 + G45 = 0
Операция №5
При регенерации экстрагента соотношение объемов водной (Раствор 0,5 моль/л H2SO4) и органической (Раствор Д2ЭГФК (натриевая форма)) равно 1, т.е. Vв: Vо = 1: 1.
G051 = G45 * ρ051 / * ρ45
G051 = 1,030 / 0,744 * G45 = 1,384408602 * G45
13). G051 - 1,384408602 * G45 = 0
14). G500 – G051 – G45 + G050 = 0
Операция №6
15). G600 – G46 + G67 = 0
После прохождения операции центрифугирования осадок Sc(OH) 3 имеет влажность 20%.
G67 = m(Sc(OH) 3) / 0,8
G67 = (G01 /1,120 * 0,02 * 0,999) / M(Sc2O3) * 2 * M(Sc(OH) 3) / 0,8 = (G01 /1,120 * 0,02 * 0,999) /137,91 * 2 * 95,97792 / 0,8 = 0,00002483 * G01 / 0,8 = 0,000031037 * G01
16). G67 - 0,000031037 * G01 = 0
Операция №7
G700 = G01 / M(Sc2O3) * 0,999 * 3 * M(H2O) + G67 * 0,2 = 0,000006985 * G01 + 0,2 * G67
17). G700 - 0,000006985 * G01 - 0,2 * G67
18). G70 – G67 + G700 = 0
Заменим потоки в уравнениях на соответствующие неизвестные X.
Общий вид уравнений материального баланса.
1). X1 = 1120000
2). X2 – 0,0017158280*X1 = 0
3). X3 – X1 – X2 = 0
4). X4 – 0,0664285*X3 = 0
5). X5 – X3 + 0,001107125*X1 = 0
6). X6 – X4 – X3 + X5 = 0
7). X7 – 1,693548387*X6 = 0
8). X8 – X7 – 0,001089285*X1 = 0
9). X9 – X7 – X6 + X8 = 0
10). X10 – 0,147849462*X9 = 0
11). X11 – X9 + 0,000006987*X1 = 0
12). X12 – X10 – X9 + X11 = 0
13). X13 – 1,384408602*X11 = 0
14). X14 – X13 – X11 + X4 = 0
15). X15 – X12 + X16 = 0
16). X16 – 0,000031037*X1 = 0
17). X17 – 0,000006985*X1 – 0,2*X16 = 0
18). X18 – X16 + X17 = 0
Расчет полученных уравнений материального баланса ведем с помощью табличного процессора EXCEL [15]. (см. Приложение 1).
Сводные таблицы материального баланса.
| приход | кг | % | расход | кг | % |
| Сернокислый раствор, содержащий Fe, РЗЭ, Sc и др. | 1120000 | 99,83 | Сернокислый раствор | 1121921,73 | 100 |
| Железная стружка | 1921,73 | 0,17 | |||
| итого | 1121921,73 | 100 | итого | 1121921,73 | 100 |
1. Восстановление железа.
| риход | кг | % | расход | кг | % |
| Сернокислый раствор | 1121921,73 | 93,77 | Рафинат, содержащий Fe2+ | 1120681,75 | 93,67 |
| Раствор 0,1 моль/л Д2ЭГФК в керосине | 74527,58 | 6,23 | Экстракт, содержащий Sc, Ti, РЗЭ и др. | 75767,56 | 6,33 |
| итого | 1196449,31 | 100 | итого | 1196449,31 | 100 |
2. Экстракция.
3. Реэкстракция примесей.
| приход | кг | % | расход | кг | % |
| Экстракт, содержащий Sc, Ti, РЗЭ и др. | 75767,56 | 37,13 | Реэкстракт, содержащий V, Ti, Th, РЗЭ и др. | 129536,02 | 63,47 |
| Раствор 4,5 моль/л H2SO4 | 128316,02 | 62,87 | Органическая фаза, содержащая Sc | 74547,56 | 36,53 |
| итого | 204083,58 | 100 | итого | 204083,58 | 100 |
4. Реэкстракция скандия.
| приход | кг | % | расход | кг | % |
| Органическая фаза, содержащая Sc | 74547,56 | 87,12 | Раствор Д2ЭГФК(натриевая форма) | 74539,73 | 87,11 |
| Раствор 2,5 моль/л NaOH | 11021,81 | 12,88 | Sc(OH) 3+H2O (пульпа) | 11029,64 | 12,89 |
| итого | 85569,37 | 100 | итого | 85569,37 | 100 |
5. Регенерация экстрагента.
| приход | кг | % | расход | кг | % |
| Раствор Д2ЭГФК(натриевая форма) | 74539,73 | 41,94 | Раствор Na2SO4 | 103205,60 | 58,07 |
| Раствор 0,5 моль/л H2SO4 | 103193,45 | 58,06 | Раствор 0,1 моль/л Д2ЭГФК в керосине | 74527,58 | 41,93 |
| итого | 177733,18 | 100 | итого | 177733,18 | 100 |
6. Центрифугирование.
| приход | кг | % | расход | кг | % |
| Sc(OH) 3+H2O (пульпа) | 11029,64 | 100 | H2O после центрифугирования | 10994,88 | 99,68 |
| Sc(OH) 3 (осадок с влажностью 20%) | 34,76 | 0,32 | |||
| итого | 11029,64 | 100 | итого | 11029,64 | 100 |
7. Сушка и прокаливание.
| приход | кг | % | расход | кг | % |
| Sc(OH) 3 (осадок с влажностью 20%) | 34,76 | 100 | H2O после сушки | 14,77 | 42,49 |
| Sc2O3 | 19,99 | 57,51 | |||
| итого | 34,76 | 100 | итого | 34,76 | 100 |
Вывод
В процессе производственной деятельности образуются отходы, которые нарушают экологическое равновесие, загрязняя окружающую среду, и снижают степень извлечения ценных компонентов, содержащихся в исходном сырье. Эти отходы необходимо перерабатывать.
В настоящее время подсчеты показали, что удельные капитальные затраты на сбор и переработку вторичного металла в 25 раз меньше, чем на производство металла из руды.
Производительность труда во вторичной цветной металлургии примерно в два раза выше, чем в первичной. Сбор и переработка вторичных металлов имеют не только экономический, но и социальный эффект.
Отходы подразделяют на отходы производства и отходы потребления (лом).
В настоящее время для производства режущих инструментов широко используются твердые сплавы. Они состоят из карбидов вольфрама, титана, тантала, сцементированных небольшим количеством кобальта. Карбиды вольфрама, титана и тантала обладают высокой твердостью, износостойкостью. Скорости резания инструментами, оснащенными твердыми сплавами, в 3-4 раза превосходят скорости резания инструментами из быстрорежущей стали.
Недостатком твердых сплавов, по сравнению с быстрорежущей сталью, является их повышенная хрупкость, которая возрастает с уменьшением содержания кобальта в сплаве. И, следовательно, возникает вопрос утилизации таких сплавов. Переработка лома и отходов позволяет вернуть металл в кругооборот.
5. Сплавы редких металлов перерабатывают окислением, хлорированием, электролизом и гидрометаллургическим способом. Их переработка осложнена более высоким содержанием других металлов и взаимным влиянием компонентов сплавов на технологические процессы. - Окислительные методы.
Их можно использовать и для переработки сплавов и кусковых отходов твердых сплавов. Применяемые в настоящее время инструментальные твердые сплавы базируются на карбидах вольфрама, титана и тантала или на смеси указанных соединений с добавлением связующего металла - кобальта. - Методы хлорирования.
При хороших технологических показателях следует отметить громоздкость оборудования для хлорных схем, а также трудности, связанные с агрессивностью и токсичностью хлора и хлоридов, необходимостью специальных коррозионностойких материалов для аппаратуры и значительными затратами на реагенты - Способы электрохимического растворения отходов.
Электрохимическое растворение отходов сплавов используют на отечественных и зарубежных предприятиях. Этот метод наиболее дешев и не требует сложной аппаратуры. Электрохимическое растворение целесообразно вести в щелочных растворах, так как образуются легко растворимые соли рения, вольфрама и молибдена.
6. Как показали расчеты:
- невязка материального баланса обжига 2,124%, она связана с погрешностью расчетов, - невязка теплового баланса 0,12% рассчитана с удовлетворительной точностью, - площадь пода равна 1,5м2, для расчета печи с такой площадью пода нужна спец литература, целью данной работы не является данный расчет.
Список литературы
1. Твердость и прочность тугоплавких материалов при высоких температурах, В.А. Борисенко. - Киев: издательство Академии наук Украинской ССР, 1984. - 212с.
2. Металлические порошки и порошковые материалы. Справочник.
3. Б.Н. Глебов, под редакцией д-ра техн. Наук Ю.В. Левинского. - М:
4. Экомет, 2005. - 520.
5. Коровин С. С, Дробот Д.В., Федоров П.И. "Редкие и рассеянные элементы. Химия и технология". В трех книгах. Книга 2. учебник для вузов - М.: МИСИС, 1999. - 464с.
6. Коровин С. С, Дробот Д.В., Федоров П.И. "Редкие и рассеянные элементы. Химия и технология". В трех книгах. Книга 3. учебник для вузов - М.: МИСИС, 1999. - 464с.
7. Дробот Д.В., Резник А.М., Юрченко Л.Д. "Оборудование заводов редкометалльной промышленности и основы проектирования". Учеб. пособие. – М.: МИХМ, 1985-72с.
8. Букин В.И., Игумнов М.С., Сафонов В.В., Сафонов Вл.В., Переработка производственных отходов и вторичных сырьевых ресурсов, содержащих редкие, благородные и цветные металлы.
9. Металлы и сплавы. Справочник. Афонин В.К., Ермаков Б.С., и др. под редакцией Солнцева Ю.П. − Санкт – Петербург: НПО Профессионал. 2003. – 376с.
10. NETZSCH-Group // http: // www. rudgormash. ru/
11. Дейнека С.С., Трусова В.Г., Хазан А.З. Хлоридная и регенеративная переработка отходов металлического вольфрама и твердых сплавов // Цветные металлы. 1995. №10. С.17 – 19.
12. УГМК - РУДГОРМАШ. "Обогатительное и горношахтное оборудование" http: // www. rudgormash. ru/
13. Лидин Р.А., Молочко В.А., Андреева Л.Л., Химические свойства неорганических вешеств,− М.: Колос, 2003.
14. Болотников Л.Е., Технологическое проектирование производства редких металлов.
15. Морозов В.А., Миткалийный В.И., Егоров А.В., Сборщиков Г.С. "Металлургические печи атлас". - М.: Металлургия. 1987. - 384с.
16. Краткий справочник физико-химических величин/ Под ред. Мищенко К.П., Равделя А.А.
17. http: // www. mechanik. spb. ru
18. http: // www. upmt. ru
19. http: // www. fingo. ru/fri-360/
20. http: // stankinprom. com. ua/products/images/PDF/rci. pdf
21. http: // wwwЛenterm. n] /lenterm_laboratory_fumaces. html И. http: // www. bank. referatoff. ru
22. http: // www. chemport. ru
23. http: // www. drillmat. ru
24. http: // www. npftin. spb. ru
ОГЛАВЛЕНИЕ
1. Введение.. 5
2. Литературный обзор. 6
2.1. Твёрдые сплавы. 6
2.2. Классификация твёрдых сплавов. 7
2.3. Свойства твердых сплавов и области их применения. 8
2.4. Основные российские производители твёрдых сплавов. 12
3. Предварительная обработка твёрдых сплавов. 17
3.1. Источники лома твёрдых сплавов. 17
3.2. Основные способы переработки твёрдых сплавов. 17
3.2.1. Хлорирование. 17
3.2.2. Методы регенерации твёрдого сплава. 18
3.2.3. Окислительные методы. 18
3.3. Основные этапы подготовки лома твёрдых сплавов. 19
3.4. Исходные данные: 21
3.5. Свойства компонентов вторичного сырья, которые могут быть использованы при разработке принципиальной технологической схемы процесса переработки сырья [6]. 22
3.6 Обоснование выбора стадий предварительной обработки сырья. 23
3.7. Выбор оборудования для предварительной обработки сырья. 25
3.7.1. Одновальцовая дробилка CEB 16/40. 25
3.7.2. Молотковая мельница CHM 23/20. 27
3.7.3. Магнитный сепаратор ПБС-63/50. 28
4. Хлорирование подготовленного сырья. 30
4.1. Хлориды и оксохлориды вольфрама. 30
4.1.2. Оксохлориды вольфрама. 32
4.2. Разработка способа хлорирования сырья. 33
4.2.1. Выбор параметров процесса хлорирования. 34
4.2.2. Выбор стабильного сечения тройной системы, продукты реакций. 34
4.3. Разработка принципиальной схемы.. 37
4.4. Разработка аппаратурно-технологической схемы.. 38
4.4.1. Аппаратурное оформление. 40
4.4.1. Аппаратурное оформление. 41
4.4.2.Описание схемы переработки твердого сплава. 41
5. Расчет материального баланса. 48
5.1 Уравнения материального баланса. 49
5.1.1. Расчет блока №1. 49
5.1.2. Расчет блока № 2. 50
5.1.3. Расчет блока № 3. 51
5.1.4. Расчет блока № 4. 51
5.1.5. Расчет блока № 5. 52
5.1.6. Расчет блока № 6. 52
5.2 Расчет технологической схемы в целом. 53
5.1. Уравнения материального баланса. 59
5.1.1. Расчет потоков: 60
5.1.2. Расчет циклонной пыли. 60
5.1.4. Количество связующих веществ в исходной шихте. 62
5.2 Окисление карбидов. 62
5.2.1. Окисление WC: 62
5.2.2. Окисление TiC: 63
5.2.3. Окисление Со: 64
5.2.4. Окисление Zn: 66
5.2.5. Окисление Си: 67
5.2.6. Окисление Ге: 68
5.2.7. Теоретическое количество воздуха. 70
5.5 Блок 5 Прокалка и сушка. 79
8. Вывод.. 85
9. Список литературы... 87
Введение
В настоящее время для производства режущих инструментов широко используются твердые сплавы. Они состоят из карбидов вольфрама, титана, тантала, сцементированных небольшим количеством кобальта. Карбиды вольфрама, титана и тантала обладают высокой твердостью, износостойкостью. Скорости резания инструментами, оснащенными твердыми сплавами, в 3-4 раза превосходят скорости резания инструментами из быстрорежущей стали.
В 2000 г. исключая Китай, было произведено около 30000 т твердых сплавов. Около 67% от всего количества твердых сплавов используется в мире в режущем инструменте.
Динамика развития производства твердых сплавов может быть проиллюстрирована следующим фактом: в период 1979-1991 гг., т.е. за 12 лет, спрос в мире на режущий инструмент удвоился.
Пропорционально использованию твердых сплавов растет количество амортизационного лома, брака при изготовлении инструментов, пылевидных отходов, образующиеся при заточке инструмента и т.д.
Данные виды отходов, возможно повторно переработать, что экономически более целесообразно чем производство металла из руды. Использование вторичного сырья позволяет решить ряд важнейших проблем: сохранение невосполнимых природных ресурсов; улучшение экологической обстановки; снижение капитальных и энергетических затрат; повышение производства редких металлов.
Цель данной работы состоит: в разработке схемы переработки лома твердых сплавов способом хлорирования, при заданных производительности, температуре обжига и способе подготовки сырья.
Подборе необходимого технологического оборудования.
Оценке экономической эффективности переработки.
Оценке данного процесса с точки зрения безопасности.
Литературный обзор
Твёрдые сплавы.
Твердые сплавы представляют собой композиционные материалы. Композиционный материал представляет собой высокопрочный или высокомодульный материал, называемый армирующим компонентом, соединенный со вторым материалом, называемым матрицей. Композиционные материалы обычно сочетают в себе свойства той и другой составляющих, однако модифицированные условиями их сосуществования.
Размеры частиц твердой карбидной и более мягкой цементирующей фаз обычно весьма малы и для большинства технических сплавов составляет 0,5-10,0 мкм.
Наиболее широкое развитие в области производства и применения получили инструментальные твердые сплавы, которые изготавливаются на основе карбида вольфрама, карбида титана, карбида тантала или сочетаний этих карбидов, иногда с карбидом ниобия, ванадия, хрома в качестве небольших добавок. "Цементирующим" металлом в сплавах служит кобальт, а иногда - никель, железо, молибден.
Сплавы отличаются высокой твердостью (HRA 82-92), сочетающейся с сопротивлением изнашиванию при трении о металлы и о неметаллические материалы, эти свойства сохраняются в значительной степени и при повышенных температурах.
Сплавы не подвергаются заметной пластической деформации при низких температурах и почти не подвержены упругой деформации: величина модуля упругости у твердых сплавов выше, чем у всех известных в технике материалов. Твердые сплавы отличаются также весьма высоким пределом прочности при сжатии. Значение предела прочности при изгибе и ударной вязкости этих сплавов невелики. Сплавы обладают относительно высокой теплопроводностью и электропроводностью, приближающейся к электропроводности железа и его сплавов. В химическом отношении твердые сплавы являются весьма устойчивыми против воздействия кислот и щелочей, некоторые сплавы заметно не окисляются на воздухе даже при 600-800°С. Изделия из твердых сплавов производятся методами порошковой металлургии, позволяющими создать сплавы из компонентов, значительно различающихся по температуре плавления. Наиболее тугоплавкие компоненты не должны подвергаться плавлению в целях придания сплаву нужных свойств.
Карбиды тугоплавких металлов групп IVА-VIA при повышенных температурах приобретают особые свойства. Для них характерны высокие значения модуля Юнга 2,8 • 105-6,5 • 106 МПа, в то время как для большинства переходных металлов эта величина равна 1,4 • 105-3 • 106 МПа. При комнатной температуре карбиды - хрупкие материалы, но при высоких температурах (около 1300 К) они переходят в пластичное состояние, а при температурах выше 1300 К пластически деформируются и известны как самые прочные материалы. Поскольку эти карбиды обладают такой исключительной термопрочностью и хорошей коррозионной стойкостью, их все более широко начинают применять как высокотемпературные конструкционные материалы в ядерной энергетике, ракетной и космической технике, в авиации и других областях. Карбиды используются там, где обычные сплавы не могут работать длительное время из-за слишком высоких рабочих температур. Например, карбид вольфрама (с никелем в качестве связующего) используют для изготовления колец, сопел и других деталей ракетных двигателей. [1]
Классификация твёрдых сплавов.
Твердые сплавы классифицируются по следующим признакам:
по составу:
WC-Co твердые сплавы;
W-TiC-Co твердые сплавы;
WC-(Ti, Та, Nb) С-Со твердые сплавы;
керметы (твердые сплавы с большим содержанием TiC/TiN);
специальные твердые сплавы (сплавы WC-Ni);
по величине зерна (дисперсности) карбидной фазы:
нанокристаллические - средняя величина зерна менее 0,1 мкм;
ультрадисперсные 0,2-0,5 мкм;
субмикронные 0,8-1,5 мкм;
среднезернистые 2,0-3,0 мкм;
крупнодисперсные 4,0-6,0 мкм;
особо крупнозернистые 8,0-15,0 мкм;
По областям применения:
Обработка материалов резанием (обработка со снятием стружки: резание, фрезерование, строгание, сверление): стали, чугуна, цветных металлов, неметаллических материалов и дерева;
Горно-буровые работы (бурение на газ и нефть, проходка туннелей), обработка дорожного покрытия, камнеобработка;
Бесстружковая обработка металлов (формообразующий инструмент при волочении, высадке, выдавливании, прокатке металлов), вырубка, отрезка, штамповка;
Работа в тяжелых условиях, в том числе в агрессивной коррозионной среде (быстро изнашивающиеся и конструкционные детали).
Дата: 2019-05-29, просмотров: 368.