В технологии вольфрама хлорирование практически не используется. Вольфрам относится к числу металлов, для которых можно разработать хлорную схему переработки, особенно в случае переработки нестандартного полиметаллического сырья.
Наиболее общим подходом к разработке технологической схемы хлорирования является систематическое исследование фазных равновесий и свойств компонентов в системах W – Cl и W – Cl – O. Исследование свойств системы даст информацию для всех стадий технологического процесса: хлорирование исходного сырья, конденсацирование суммы хлорпроизводных и их разделение, использование индивидуальных хлорпроизводных в процессах получения и очистки необходимых продуктов [3].
Хлориды вольфрама.
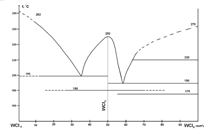
Исследуем систему WCl6 – WCl4. Данная система является боковой стороной треугольника W – Cl – O (рис.4.1.2).
Рис.4.1.1. Диаграмма конденсированного состояния системы WCl4 – WCl6
 |
Хлориды вольфрама многочисленны.
Высшие хлориды вольфрама - кристаллические вещества, гидролизующиеся во влажном воздухе и окисляющиеся кислородом.
Высший хлорид вольфрама WC16 существует в трех полиморфных модификациях.
Наиболее удобным способом получения WC16 является хлорирование металла. Хлорид WC16 конденсируется из паровой фазы в форме темно-фиолетовых кристаллов. Гексахлорид вольфрама не образует прочных комплексов с хлоридами щелочных металлов. Это позволяет использовать для его очистки от хлоридов алюминия и железа методы солевой очистки.
При повышенных температурах устойчивость низших хлоридов вольфрама понижается.
Пентахлорид вольфрама в твердом состоянии - димер W2С110. Пентахлоридвольфрама WC15 термически стабилен: сублимирует и испаряется без заметного разложения, темного (зеленовато-коричневого) цвета. WC15 конгруэнтно плавится при 250°С. В расплавах хлоридов щелочных металлов WCl5 образуют комплексы (Na,K) WCl6.
Тетрахлорид вольфрама - кристаллические вещества темного цвета. Получаются при восстановлении высших хлоридов. Процессы термического разложения МС14 сложны и являются совокупностью реакций сублимации и диспропорционирования с образованием МС1х (д: < 3), составы которых по данным различных авторов отличаются. WC14 образуют с хлоридами щелочных металлов комплексы М2WС16 (М = Na, К, Rb, Cs).
Низшие хлориды WС1х (х < 3) - кристаллические вещества темного цвета, состав и свойства которых изучены недостаточно. Получаются при восстановлении высших хлоридов [3].
Оксохлориды вольфрама
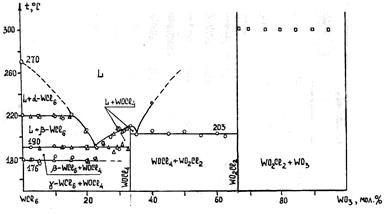 |
Рис.4.2.1. Диаграмма конденсированного состояния системы WCl6 – WO3
Высшие оксохлориды вольфрама WOC14 и WO2C12 кристаллические вещества, гидролизующиеся во влажном воздухе. Диоксодихлориды менее склонны к гидролизу. WOC14 образует темно-красные игольчатые кристаллы тетрагональной сингонии. WO2C12 - светло-желтое кристаллическое вещество. WOC14 плавится и испаряется без заметного разложения; расплавить WO2C12 под обычным давлением не удается, так как он разлагается на WO3 и паровую фазу, содержащую молекулы WOC14 и WC16. WOC14 не образует прочных комплексов с хлоридами щелочных металлов.
Вольфрам в степени окисления (V) образуют оксотрихлорид WOCl3. WOCl3 термически не устойчив, диспропорционирует на WOCl2 и WOCl4
Оксодихлорид WОС12 - химия этого вещества изучена недостаточно. Температура кипения намного выше WOCl4 [3].
Дата: 2019-05-29, просмотров: 363.