Идеальным газом называется воображаемый газ, молекулы которого представляют собой материальные точки, не имеющие собственного объема и не взаимодействующие между собой. Зависимость между основными термодинамическими параметрами такого газа определяется уравнением состояния идеального газа – уравнением Клапейрона-Менделеева:
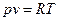 , (1)
, (1)
где 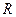 - газовая постоянная,
- газовая постоянная, 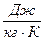 ,
, 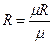 ;
;
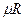 - универсальная газовая постоянная,
- универсальная газовая постоянная, 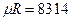
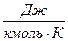 .
.
Реальные газы состоят из молекул, имеющих конечный собственный объем, между которыми действуют силы межмолекулярного взаимодействия (силы притяжения и отталкивания). Эти газы описываются уравнением (1) только при малых плотностях, когда среднее расстояние между центрами молекул сравнительно велико и эти силы не проявляются. В более плотных реальных газах со значительно меньшим расстоянием между молекулами необходимо учитывать и силы взаимодействия, и собственный объем молекул. Поведение реальных газов качественно отражает уравнение Ван-дер-Ваальса:
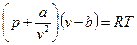 , (2)
, (2)
где 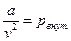 - внутреннее (молекулярное) давление, возникающее за счет действия сил притяжения и отталкивания между молекулами (для жидкостей оно велико);
- внутреннее (молекулярное) давление, возникающее за счет действия сил притяжения и отталкивания между молекулами (для жидкостей оно велико);
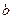 - наименьший объем, до которого можно сжать газ, обусловленный собственным объемом молекул.
- наименьший объем, до которого можно сжать газ, обусловленный собственным объемом молекул.
Тогда 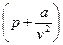 представляет собой полное давление системы, а
представляет собой полное давление системы, а 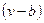 – свободный объем.
– свободный объем.
Для количественных расчетов уравнение (2) часто малопригодно, так как при высоких плотностях, а следовательно, при высоких давлениях параметры, рассчитанные по этому уравнению, расходятся с действительными (экспериментальными) значениями.
Уравнение Ван-дер-Ваальса можно представить в приведенных параметрах состояния. Если переменные p, v и T отнести к их значениям в критической точке 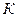 (далее в опыте Эндрюса эта точка будет рассмотрена подробнее), то можно получить приведенные значения объема
(далее в опыте Эндрюса эта точка будет рассмотрена подробнее), то можно получить приведенные значения объема 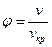 , давления
, давления 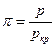 и температуры
и температуры 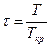 и записать так называемое приведенное уравнение состояния:
и записать так называемое приведенное уравнение состояния:
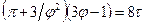 . (3)
. (3)
Состояния веществ, находящихся при одинаковых 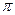 ,
, 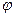 и
и 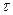 , называются соответственными состояниями.
, называются соответственными состояниями.
Уравнения типа (2) и (3) получаются в случае, если ограничиться рассмотрением только парных взаимодействий между молекулами, т.е. в группах по две молекулы. Поэтому эти уравнения применимы в области не очень высоких давлений.
С повышением давления необходимо учитывать образование устойчивых молекулярных ассоциаций из трех, четырех и более молекул, распад которых возможен только при подводе энергии извне, т.е. при нагревании. Такой газ можно рассматривать как «смесь» нескольких газов, частицами которых являются одиночные, двойные, тройные и т.д. группы молекул [4, 5].
Уравнение состояния реальных газов формально можно записать в виде
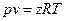 , (4)
, (4)
где z - коэффициент сжимаемости или неидеальности (для идеальных газов z = 1). Коэффициент сжимаемости можно представить в виде вириального уравнения, учитывающего и взаимодействие более высокого порядка:
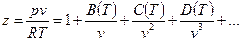 . (5)
. (5)
Правую часть этого уравнения можно рассматривать как разложение в ряд коэффициента z по степеням плотности 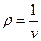 . Зависящие от температуры функции
. Зависящие от температуры функции 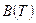 ,
, 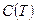 ,
, 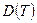 , и т.п. выступают здесь как вириальные (от латинского viris - силы) коэффициенты, учитывающие соответственно парные, тройные, четверные и т.д. взаимодействия. Область справедливости вириального разложения ограничивается сходимостью рядов. Ряды расходятся при плотностях, соответствующих жидкому состоянию. Уравнение (5) оказывается справедливым для газов умеренной плотности. Расчеты вириальных коэффициентов достаточно сложны, и поэтому уравнение (5) используется в основном при проведении научных исследований.
, и т.п. выступают здесь как вириальные (от латинского viris - силы) коэффициенты, учитывающие соответственно парные, тройные, четверные и т.д. взаимодействия. Область справедливости вириального разложения ограничивается сходимостью рядов. Ряды расходятся при плотностях, соответствующих жидкому состоянию. Уравнение (5) оказывается справедливым для газов умеренной плотности. Расчеты вириальных коэффициентов достаточно сложны, и поэтому уравнение (5) используется в основном при проведении научных исследований.
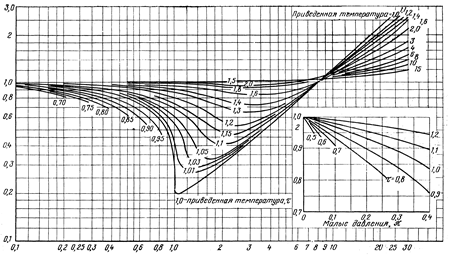
Коэффициент неидеальности z может быть найден также по зависимости 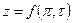 из
из 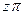 - диаграммы (рис.1). Рассчитанное значение
- диаграммы (рис.1). Рассчитанное значение 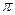 откладывается на соответствующей оси этой диаграммы, и из этой точки проводится прямая, перпендикулярная оси
откладывается на соответствующей оси этой диаграммы, и из этой точки проводится прямая, перпендикулярная оси 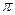 , до пересечения с кривой, соответствующей рассчитанному значению t. Точка пересечения позволяет определить искомую величину коэффициента неидеальности на оси z . Точность расчетов в этом случае окажется такой же, как и по уравнению Ван-дер-Ваальса (2) или приведенному уравнению (3).
, до пересечения с кривой, соответствующей рассчитанному значению t. Точка пересечения позволяет определить искомую величину коэффициента неидеальности на оси z . Точность расчетов в этом случае окажется такой же, как и по уравнению Ван-дер-Ваальса (2) или приведенному уравнению (3).
|
|
Опыт Эндрюса
Свойства реальных газов не только в количественном, но и в качественном отношении отличаются от свойств идеальных газов. Теория идеальных газов не может объяснить фазовые превращения газа и жидкости, она не может установить границы области фазовых переходов, параметры критического состояния.
|
|
|
|
|
|
|
|
|
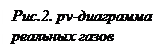
|
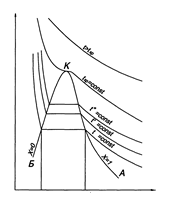
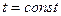 ) сжатия можно по pv-диаграмме (рис. 2). Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 газ сжимается до объема v”, давление газа достигает величины рн – давления насыщения при данной температуре t, и газ начинает конденсироваться при
) сжатия можно по pv-диаграмме (рис. 2). Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 газ сжимается до объема v”, давление газа достигает величины рн – давления насыщения при данной температуре t, и газ начинает конденсироваться при 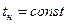 и
и 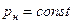 (процесс 2-3). В точке 3 весь газ переходит в жидкое состояние и занимает объем v’, и процесс конденсации завершается. Кривая 3-4 соответствует процессу сжатия жидкой фазы при
(процесс 2-3). В точке 3 весь газ переходит в жидкое состояние и занимает объем v’, и процесс конденсации завершается. Кривая 3-4 соответствует процессу сжатия жидкой фазы при 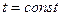 . Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
. Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
Исследуя зависимость v от р на разных изотермах t, t’, t” и т.д., Эндрюс установил, что, чем выше температура, тем меньше разница между удельными объемами сухого насыщенного пара ( 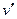 ) и насыщенной жидкости (
) и насыщенной жидкости ( 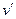 ). С повышением температуры (
). С повышением температуры ( 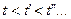 ) точки 2,
) точки 2, 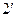 ,
, 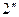 …, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3,
…, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3, 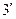 ,
, 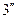 …, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости:
…, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости:
х = 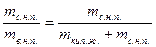 ,
,
где 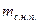 - масса сухого насыщенного пара;
- масса сухого насыщенного пара;
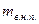 - масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
- масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
Разность удельных объемов 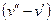 уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.
уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е. 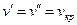 . Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами. Поэтому, проводя изотермическое сжатие при различных температурах, можно графически определить положение критической точки.
. Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами. Поэтому, проводя изотермическое сжатие при различных температурах, можно графически определить положение критической точки.
Таким образом, для реального газа в pv-диаграмме можно выделить пять характерных состояний:
· область жидкого состояния, расположенную левее кривой х = 0 (БК), 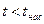 при данном давлении;
при данном давлении;
· линию кипящей (насыщенной) жидкости, х = 0 (БК), 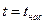 ;
;
· область влажного насыщенного пара – двухфазное состояние, где пар и жидкость находятся в равновесии и имеют одинаковые рн и tн; она расположена между пограничными кривыми х = 0 и х = 1, т.е. в этой области 0 < x < 1 (между БК и АК), 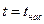 ;
;
· линию сухого насыщенного пара, х = 1 (АК), 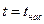 ;
;
· область перегретого пара, расположенную правее кривой х = 1 (АК), 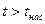 при данном давлении.
при данном давлении.
Необходимо отметить, что при 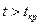 путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Таким образом, газы, у которых
путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Таким образом, газы, у которых 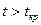 , без понижения температуры нельзя перевести в жидкое состояние.
, без понижения температуры нельзя перевести в жидкое состояние.
В табл. 1 приведены критические параметры некоторых реальных газов.
Таблица 1
Критические параметры некоторых реальных газов
| Параметры | Н2 | N2 | CO2 | O2 | H2O | Hg |
| t кр., °С | -239,9 | -147,0 | 31,05 | 118,4 | 374,15 | 1480 |
| ркр., МПа | 1,293 | 3,39 | 7,837 | 5,07 | 22,13 | 147,0 |
| v кр., м3/кг | 0,0323 | 0,00322 | 0,002137 | 0,00233 | 0,00326 | - |
Вещество в критическом состоянии характеризуется рядом особенностей. Критическая изотерма tкр. в критической точке К имеет горизонтальную касательную и перегиб, т.е.
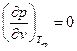 и
и 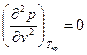 . (6)
. (6)
Вблизи этой точки наблюдается скачок теплоемкости 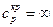 . В точке К теплота парообразования
. В точке К теплота парообразования 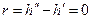 , становятся равными нулю силы поверхностного натяжения
, становятся равными нулю силы поверхностного натяжения 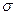 , которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность и наблюдается высокая растворяющая способность вещества.
, которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность и наблюдается высокая растворяющая способность вещества.
Особые свойства веществ в критической и околокритической областях состояния в настоящее время уже находят применение в пищевой, фармацевтической, парфюмерной, химической, нефтеперерабатывающей отраслях промышленности, в решении экологических проблем. В частности, показано использование суб- и сверхкритических «флюидов» в роли экстрагентов и растворителей в процессах выделения, разделения, очистки и фракционирования [3]. При этом решаются проблемы создания перспективных малоотходных и энергосберегающих технологий.
Проведение опытов
Схема экспериментальной установки представлена на рис. 3. Углекислый газ СО2 находится в толстостенном капилляре 1, выдерживающем давление 7 – 10 МПа. Давление создается масляным прессом 4 и через ртутный затвор передается сжимаемому газу. Постоянство заданной температуры обеспечивается термостатом, подающим воду в прозрачную ячейку 2 из оргстекла, где помещается капилляр 1.
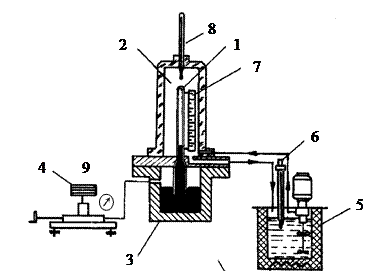 |
Изменение объема газа при сжатии и происходящая при этом конденсация четко фиксируются по положению границы ртути в капилляре с помощью шкалы на мерной линейке 7. Температура в ячейке измеряется ртутным термометром 8, избыточное давление сжимаемого газа – образцовым манометром 9.
 | |||||
 | |||||
 | |||||
Перед проведением опытов необходимо измерить и записать атмосферное давление В и цену деления шкалы манометра.
Работа выполняется в следующей последовательности:
1. Включить термостат 5. Установить на контактном термометре 6 заданную температуру опыта t1 и дождаться ее стабилизации в измерительной ячейке. Значение этой температуры занести в таблицу (табл.2).
2. С помощью масляного пресса 4 сжать газ до появления мениска ртути в поле зрения капилляра 1. Занести в таблицу (табл.2) показания манометра ризб. (в делениях) и по шкале мерной линейки 7 – высоту газа в капилляре l, мм, пропорциональную сжимаемому объему СО2.
3. Повышать давление (по два деления шкалы манометра с фиксацией высоты газа l) до появления мениска конденсата над ртутным столбиком (точка 2 на рис. 2). Данные занести в таблицу (табл.2), где отметить эту точку как начало процесса конденсации.
Таблица 2
Результаты измерений
| № опытных точек | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | ||
| t1 = , °С | ризб. | делений | |||||||||||||||
| кгс/см2 | |||||||||||||||||
| рабс. | МПа | ||||||||||||||||
| l | мм | ||||||||||||||||
| v | м3/кг | ||||||||||||||||
| В = , мм рт. ст. | Шкала манометра 1 дел = , кгс/см2 | ||||||||||||||||
4. Довести до давления, соответствующего 50 делениям манометра, и перевести вещество в жидкое состояние. Занести в таблицу (табл.2) высоту жидкости l и отметить в таблице эту точку (точка 4 на рис. 2).
5. Посредством масляного пресса понижать давление по 4 деления за опыт, записывая высоту столба жидкости в капилляре. После появления в капилляре газа над жидкостью (точка 3 на рис. 2 – начало парообразования) опыты прекратить.
6. По указанию преподавателя повторить действия п.п. 1-5 при температурах t2 и t3.
7. Показать результаты измерений преподавателю.
Положение точки 3 на pv-диаграмме (рис. 2) также можно определить графическим построением. Она находится на пересечении горизонтальной прямой, проведенной через точку 2, и вертикальной прямой, проведенной через точку 4.
Обработка опытных данных
1. Рассчитать абсолютное давление газа для всех измерений:
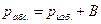 , Па;
, Па;
1 кгс/см2 = 735,6 мм рт. ст.;
750 мм рт. ст. = 105 Па = 0,1 МПа.
При определении ризб. необходимо учитывать цену деления манометра.
2. Удельный объем, равный 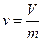 , м3/кг, из опыта рассчитывается как
, м3/кг, из опыта рассчитывается как 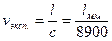 , м3/кг,
, м3/кг,
где V – объем СО2 в капилляре, м3;
m - масса СО2 в капилляре, кг;
l - высота газа в капилляре, мм;
с - постоянная капилляра, с = 8900.
Результаты расчетов p и v занести в таблицу (табл.2).
3. На миллиметровой бумаге построить pv-диаграмму по опытным данным, выбрав масштабы по осям:
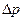 = 1МПа
= 1МПа  2 см;
2 см;
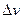 = 0,001 м3/кг
= 0,001 м3/кг  1 см.
1 см.
Используя известные параметры в критической точке К для СО2 (табл. 1), нанести предполагаемые пограничные кривые АК и БК (проведенные через точки 2 и 3) – см. рис. 2. Показать на диаграмме области: жидкого, влажного насыщенного и перегретого состояния вещества, обозначить как кривые кипящей жидкости (х=0) и сухого насыщенного пара (х=1). Показать пунктирными линиями предполагаемую критическую изотерму.
4. Из уравнения (4) рассчитать коэффициент неидеальности z для состояния, указанного преподавателем. Для этой же точки определить коэффициент неидеальности z по 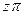 - диаграмме (рис.1). Сравнить полученные результаты.
- диаграмме (рис.1). Сравнить полученные результаты.
5. Рассчитать систематическую погрешность измерений в заданной точке: давления р, барометрического давления В и температуры t:
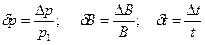 ,
,
где 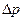 ,
, 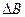 ,
, 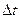 - абсолютные погрешности измерения значений р, В и t соответственно.
- абсолютные погрешности измерения значений р, В и t соответственно.
Подробно материал к этому пункту изложен в разделе «Оценка погрешности эксперимента».
Контрольные вопросы
1. Понятие идеального и реального газа.
2. Уравнения Клапейрона-Менделеева, Ван-дер-Ваальса и приведенное уравнение состояния реальных газов.
3. Коэффициент неидеальности (сжимаемости). 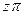 -Диаграмма.
-Диаграмма.
4. Опыт Эндрюса. pv-Диаграмма реальных газов. Характер изотерм 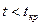 ,
, 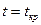 и
и 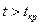 .
.
5. Области фазовых состояний вещества. Понятие степени сухости. Характер изменения давления р и температуры t в области фазовых переходов газ - жидкость.
6. Критическая точка, критическое состояние вещества.
7. Особенности критической и околокритической области состояний вещества. Перспективы применения особых свойств этого состояния в промышленности.
8. Экспериментальная установка и результаты опытов.
9. Источники погрешностей измерения. Виды погрешностей. Методика расчета.
Лабораторная работа 24
Дата: 2019-05-29, просмотров: 367.