В случае соударения двух одинаковых шаров минимальное расстояние между центрами шаров равно их диаметру. Поэтому эффективным диаметром молекулы d называют минимальное расстояние, на которое сближаются при соударении центры двух молекул.
Ясно, что эффективный диаметр молекулы зависит от скорости их сближения (кинетической энергии на большом расстоянии), а значит - от температуры.
Длина свободного пробега молекулы — это среднее расстояние (обозначаемое 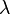 ), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
Формула
 , где
, где  — эффективное сечение молекулы,
— эффективное сечение молекулы, 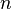 — концентрация молекул.
— концентрация молекул.
Обозначим эффективный диаметp молекулы чеpез d и молекулу пpедставим как шаp. Тогда число столкновений z молекулы с дpугими молекулами в секунду будет pавно числу молекул, центpы котоpых находятся в цилиндpе длиной, численно pавной <v>, и диаметpом 2d. Это число выpажается формулой
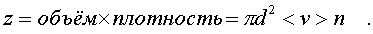
В фоpмулу нужно внести попpавку на то, что данная молекула сталкивается не с неподвижными молекулами, а с движущимися.
Идеальный газ. Уравнение состояния идеального газа.
Идеальный газ — абстрактная математическая модель газа, удобная для описания поведения реальных газов при не слишком больших давлениях и температурах.
В этой модели, во-первых, предполагается, что составляющие газ частицы не взаимодействуют друг с другом, то есть их размеры пренебрежимо малы, поэтому в объёме, занятом идеальным газом нет взаимных столкновений частиц. Частицы идеального газа претерпевают столкновения только со стенками сосуда.
Второе предположение, — между частицами газа нет дальнодействующего взаимодействия, например, электростатического или гравитационного.
Состояние идеального газа характеризуют три параметра: давление, объём и температура. Зависимость между ними описывается уравнением:
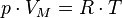
где р - давление,
VM - молярный объём,
R - универсальная газовая постоянная,
T - абсолютная температура (градусы Кельвина).
Так как VM = V/n, где V - объём, n - количество вещества, а n =m/M, то
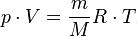
где m - масса газа, М - молярная масса. Это уравнение называется уравнением Менделеева-Клайперона.
При постоянной массе уравнение приобретает вид:
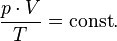
Это уравнение называют объединённым газовым законом.
Дата: 2019-05-28, просмотров: 347.