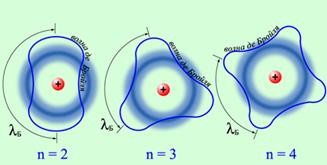
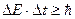Гипотеза де Бройля[53] основана на идее корпускулярно-волновой двойственности свойств частиц вещества.
|
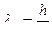 =
= 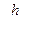 ,
,
где т - масса частицы,
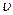 - скорость частицы,
- скорость частицы,
|
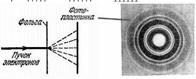
В 1948 году Л.М. Биберман, Н.Г. Сушкин и В. А. Фабрикант экспериментально подтвердили, что волновые свойства присущи не только потоку электронов, но и каждому электрону в отдельности.
Эксперимент показал, что даже в случае слабого электронного пучка, когда каждый электрон проходит через прибор независимо от других, возникающая при длительной экспозиции дифракционная картина не отличается от дифракционных картин, получаемых при короткой экспозиции для потоков электронов, в миллионы раз более интенсивных.
Соотношения неопределенностей Гейзенберга[54]. Волновые свойства микрочастиц вносят ограничения в возможность применять к таким частицам понятия координаты и импульса в их классическом смысле.
Соотношениями неопределенностей Гейзенберга называются неравенства:
|
|
Соотношение неопределенностей для координаты и импульса. Здесь
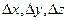 означают интервалы координат, в которых может быть локализована частица, описываемая волной де Бройля, если проекции ее импульса по осям координат заключены в интервалах
означают интервалы координат, в которых может быть локализована частица, описываемая волной де Бройля, если проекции ее импульса по осям координат заключены в интервалах 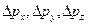 соответственно. Соотношения Гейзенберга показывают, что координаты частицы х, у. z и проекции
соответственно. Соотношения Гейзенберга показывают, что координаты частицы х, у. z и проекции 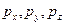
 её импульса на соответствующие оси не могут одновременно иметь значения в точности равные х и рх, у и рy, z и р z . Эти физические величины могут иметь значения, заданные с точностью, определяемой соотношениями Гейзенберга. Чем более точно определено положение частицы, т. е. чем меньше
её импульса на соответствующие оси не могут одновременно иметь значения в точности равные х и рх, у и рy, z и р z . Эти физические величины могут иметь значения, заданные с точностью, определяемой соотношениями Гейзенберга. Чем более точно определено положение частицы, т. е. чем меньше 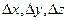 , тем менее точно определены значения проекций ее импульса (т. е. тем больше
, тем менее точно определены значения проекций ее импульса (т. е. тем больше 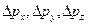 ). Если положение частицы на оси ОХ определено точно и
). Если положение частицы на оси ОХ определено точно и 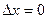 , то
, то 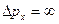 и значение проекции импульса
и значение проекции импульса 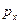 становится совершенно неопределенным.
становится совершенно неопределенным.
6.36.Найдите длину волны де Бройля для электрона, кинетическая
энергия которого равна 1 МэВ. [ 12,3 пм]
6.37.Найдите длину волны де Бройля для электронов, прошедших разность потенциалов: 1) 1 В, 2) 100 В. [1) 1,22∙10-9 м; 2) 0,122∙10-9 м]
6.38.Найдите длину волны де Бройля для атома водорода, движущегося при температуре 20 °С, с наиболее вероятной скоростью. [180пм]
6.39.Электронный пучок ускоряется в электроннолучевой трубке разностью потенциалов 1 кВ. Известно, что неопределенность скорости составляет 0,1 % от ее числового значения. Определите неопределенность координаты электрона. [61 нм]
6.40.Оцените неопределенность координаты электрона в электроннолучевой трубке, если составляющая импульса электрона определена с точностью 5∙10-28 кг∙м/с.
6.41.Электрон с кинетической энергией 4 эВ локализован в области размером 1 мкм. Оцените с помощью соотношения неопределенностей относительную неопределенность его скорости.
6.42.Длительность возбужденного состояния атома водорода соответствует примерно 0,1 мкс. Какова неопределенность энергии в этом состоянии.
6.46.Принимая, что электрон находится внутри атома диаметром 0,3 нм, определите (в электрон-вольтах) неопределенность энергии этого электрона. [16,7 эВ]
Волновая функция и ее статистическая интерпретация. Положение частицы в пространстве в данный момент времени определяется в квантовой механике заданием волновой функции (пси-функции) 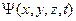 .
.
Вероятность 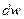 того, что частица находится в элементе объема dV , пропорциональна
того, что частица находится в элементе объема dV , пропорциональна 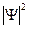 и элементу объема dV :
и элементу объема dV :
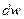 =
= 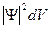 ,
,
где 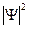 - квадрат модуля
- квадрат модуля 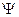 -функции:
-функции: 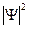 =
= 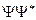 . Здесь
. Здесь 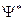 - функция, комплексно сопряженная с
- функция, комплексно сопряженная с 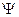 -функцией.
-функцией.
Величина 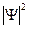 есть плотность вероятности
есть плотность вероятности  - задает вероятность пребывания частицы в данной точке пространства. Интенсивность волны де Бройля определяется величиной
- задает вероятность пребывания частицы в данной точке пространства. Интенсивность волны де Бройля определяется величиной 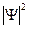 .
.
Условие нормировки вероятностей следует из определения 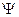 -функции:
-функции:
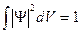 ,
,
где тройной интеграл по объему вычисляется по координатам, х, у и z от — 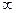 до +
до + 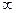 , т. е. по всему бесконечному пространству.
, т. е. по всему бесконечному пространству.
Условие нормировки указывает на то, что пребывание частицы где-либо в пространстве есть достоверное событие и его вероятность должна быть равна единице.
Уравнение Шрёдингера[55]. Временным уравнением Шрёдингера называется основное дифференциальное уравнение квантовой механики относительно волновой функции 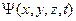 . Оно определяет
. Оно определяет 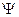 -функцию для микрочастиц, движущихся в силовом поле с потенциальной энергией
-функцию для микрочастиц, движущихся в силовом поле с потенциальной энергией 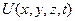 со скоростью
со скоростью 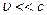 , где с — скорость света в вакууме
, где с — скорость света в вакууме 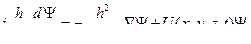
В уравнении: 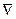 - оператор Лапласа[56],
- оператор Лапласа[56],
т - масса частицы,
h = 6,625∙10-34 Дж∙с – постоянная Планка
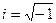 - мнимая единица.
- мнимая единица.
Уравнение Шрёдингера дополняется условиями, которые накладываются на 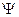 -функцию:
-функцию:
а) функция должна быть конечной, однозначной и непрерывной;
б) производные 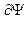 ,
, 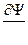 и
и 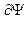 должны быть непрерывны,
должны быть непрерывны,
в) функция 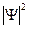 должна быть интегрируема, т.е. интеграл
должна быть интегрируема, т.е. интеграл  должен быть конечным. Это условие в простейших случаях сводится к условию нормировки вероятностей.
должен быть конечным. Это условие в простейших случаях сводится к условию нормировки вероятностей.
Стационарное уравнение Шрёдингера 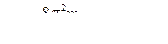 - для случая, когда
- для случая, когда 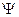 -функция не зависит от времени
-функция не зависит от времени 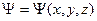 ,
,
В уравнении: E – полная энергия частицы.
Функции 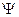 , удовлетворяющие уравнению Шредингера при заданном виде потенциальной энергией
, удовлетворяющие уравнению Шредингера при заданном виде потенциальной энергией 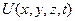 , называются собственными функциями. Они существуют лишь при определенных значениях E, называемых собственными значениями энергии. Совокупность собственных значений E образует энергетический спектр частицы.
, называются собственными функциями. Они существуют лишь при определенных значениях E, называемых собственными значениями энергии. Совокупность собственных значений E образует энергетический спектр частицы.
Стационарное уравнение Шрёдингера для частицы в потенциальной яме имеет вид:
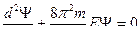 или
или 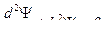
при краевых условиях 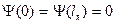 , означающих, что
, означающих, что 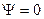 и
и 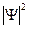 =0 вне области
=0 вне области 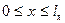 , т. е. что вероятность найти частицу вне потенциальной ямы равна нулю.
, т. е. что вероятность найти частицу вне потенциальной ямы равна нулю.
Решение уравнения Шрёдингера:
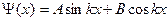
где А и В - постоянные,
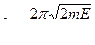 - волновое число.
- волновое число.
Вероятность обнаружить частицу в любой точке пространства постоянна.
Для волны, распространяющейся в положительном направлении оси ОХ,
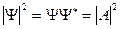 , где А-нормировочный коэффициент.
, где А-нормировочный коэффициент.
Из краевых условий следует, что так как 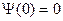 , то
, то 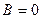 ; и
; и 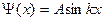 ,
, 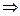 ,
, 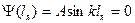 ,
, 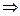 ,решением уравнения
,решением уравнения 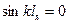 является
является
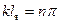 , т.е. волновое число принимает ряд дискретных значений, соответствующих требованию:
, т.е. волновое число принимает ряд дискретных значений, соответствующих требованию:
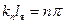 , где
, где 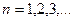
Последнее уравнение означает, что:
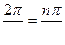 или
или 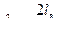 .
.
|
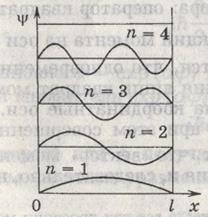
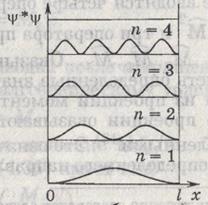
Из графиков, например, следует, что в состоянии с n=2 частица не может быть обнаружена в середине ямы и вместе с тем одинаково часто бывает как в левой, так и в правой половине ямы. Такое поведение частицы несовместимо с представлениях о траекториях.
Собственные значения 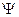 функции уравнения Шрёдингера находятся из условия
функции уравнения Шрёдингера находятся из условия
|
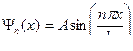 .
.
Для нахождения коэффициента 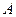 воспользуемся условием нормировки согласно которому должно выполняться равенство
воспользуемся условием нормировки согласно которому должно выполняться равенство 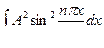 =1
=1
Произведем интегрирование[57]
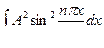 =
=  ,
,  ,
,  =1,
=1,  ,
, 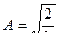 . Таким образом, собственные функции имеют вид
. Таким образом, собственные функции имеют вид
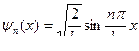 .
.
Квантованными физическими величинами называются величины, которые могут принимать лишь определенные дискретные значения.
|
|
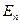 частицы в одномерной потенциальной яме бесконечной глубины имеют дискретный характер
частицы в одномерной потенциальной яме бесконечной глубины имеют дискретный характер 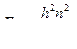 .
.
Так как 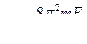 , а
, а 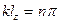 , то
, то
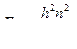 .
.
Квантованные значения En называются уровнями энергии, а числа 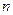 , определяющие энергетические уровни частицы в потенциальной яме, называются квантовыми числами.
, определяющие энергетические уровни частицы в потенциальной яме, называются квантовыми числами.
При больших квантовых числах происходит относительное сближение энергетических уровней частицы в потенциальной яме.
Туннельным эффектом называется прохождение («просачивание») частиц сквозь потенциальные барьеры.
Туннельный эффект является квантовомеханическим эффектом, связанным с тем, что частицы обладают волновыми свойствами.
Парадокс туннельного эффекта заключается в том, что прохождение частицы сквозь потенциальный барьер позволяет обнаружить ее в области запрещенной с классической точки зрения, где потенциальная энергия частицы превышает ее энергию.
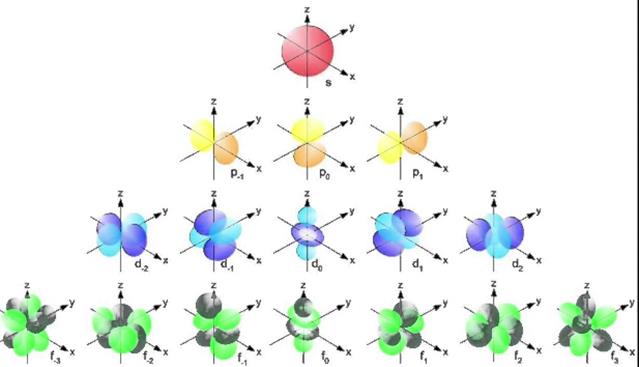
Квантовые характеристики электрона. Теория Бора приписывала четырем электронным оболочкам К, L, M и N квантовое число и, равное соответственно 1, 2, 3 и 4. Эти числа соответствуют повышающимся энергетическим уровням оболочек. Однако электронные оболочки в действительности расщеплены на подоболочки, каждая со своим собственным квантовым энергетическим уровнем.
| n | 1 | 2 | 3 | 4 |
| Обозначение оболочки | K | L | M | N |
| l | 0 | 1 | 2 | 3 |
| Обозначение подоболочки | s «резкая» (sharp) | p «главная» (principal) | d «диффузная» (diffuse) | f «фундаментальная» (fundamental) |
|
Линии, обусловленные переходами между этими подоболочками, испытывают дальнейшее расщепление, если атомы элементов помещены во внешнее магнитное поле. Это расщепление называется эффектом Зеемана. Экспериментально установлено, что указанное расщепление возможно только для р-, d- и f-подоболочек. Каждый энергетический уровень, на который они расщепляются в магнитном поле, соответствует одной орбитали в подоболочке. Магнитное поле не оказывает влияния на s-подоболочку, так как она состоит всего из одной s-орбитали сферической формы.
В отсутствие магнитного поля все орбитали одной подоболочки имеют одинаковую энергию. Орбитали, имеющие одинаковую энергию, называются вырожденными.
Атомные спектры элементов при определенных условиях обнаруживают расщепление, обусловленное наличием у электрона особого свойства -спина, которое можно представить себе как вращение электрона вокруг собственной оси. По направлению это вращение может быть правосторонним (по часовой стрелке) либо левосторонним (против часовой стрелки).
Таким образом, энергетический уровень электрона в атоме определяется следующими четырьмя характеристиками: оболочкой, подоболочкой, орбиталъю и спином. Каждой из этих характеристик сопоставляется определенное квантовое число.
Четыре квантовых числа характеризуют состояние каждого электрона в атоме:
Квантовые числа
| Обозначение | Наименование | Принимаемые значения |
| n | главное | 1,2,3… |
| l | орбитальное | 0,1,2,…,(n-1) |
| ml | магнитное | 0,±1,±2,±… ±l |
| s ms | спиновое магнитное спиновое | 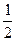 ±
± 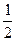
|
Следует отметить, что каждый электрон имеет свой индивидуальный набор квантовых чисел, которым он отличается от всех других электронов данного атома.
В 1925 г. Паули установил квантово - механический принцип (принцип запрета Паули): в любом атоме не может быть двух электронов, находящихся в одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: n, l , m, ms.
Принцип Паули дал возможность теоретически обосновать периодическую систему элементов Менделеева, создать квантовые статистики, современную теорию твердых тел и др.
Для одного фиксированного значения главного квантового числа n существует 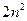 различных квантовых состояний электрона.
различных квантовых состояний электрона.
Принцип Паули дает объяснение периодической повторяемости свойств атома, системе Менделеева.
Порядковый номер химического элемента Z равен общему числу электронов в атоме.
Если Z - число электронов в атоме, находящихся в состоянии, которое задается набором 4-х квантовых чисел n, l, m, ms, то Z(n, l, m, ms) = 0 или 1.
Если Z - число электронов в атоме, находящихся в состояниях, определяемых набором 3-х квантовых чисел n, l, m, то Z(n, l, m)=2. Такие электроны отличаются ориентацией спинов.
Если Z - число электронов в атоме, находящихся в состояниях, определяемых 2-мя квантовыми числами n, l,то Z(n, l)=2(2l+1).
Если Z - число электронов в атоме, которые находятся в состояниях, определяемых значением главного квантового числа n, то Z(n)= 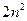 .
.
Электроны в атоме, занимающие совокупность состояний с одинаковыми значениями главного квантового числа n, образуют электронный слой: при n=1 К - слой; при n=2 L - слой; при n=3 М - слой; при n=4 N - слой; при n=5 О - слой и т.д.
6.47.Запишите возможные значения орбитального квантового числа l и магнитного квантового числа т l для главного квантового числа п = 4.[ l =0, т l = 0; l =1, т l = 0, ±1; l =2, т l = 0, ±1, ±2; l =3, т l = 0, ±1, ±2, ±3]
6.48.Определите, сколько различных волновых функций соответствует главному квантовому числу п = 3.[9]
6.49.Постройте и объясните диаграмму, иллюстрирующую расщепление энергетических уровней и спектральных линий (с учетом правил отбора) при переходах между состояниями с l = 2 и l = 1.
6.50.Определите числовое значение: 1) собственного механического момента импульса (спина); 2) проекции спина на направление внешнего магнитного поля.
6.51.Учитывая принцип Паули, определите максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом.
6.52.Заполненной электронной оболочке соответствует главное квантовое число п=3 . Определите число электронов на этой оболочке, которые имеют одинаковые квантовые числа: 1) ms= -1/2 ; 2) ml = 0; 3) ml =-1, ms =1/2.[1) 9; 2) 6; 3) 2]
6.53.Заполненной электронной оболочке соответствует главное квантовое число п = 4. Определите число электронов на этой оболочке, которые имеют одинаковые квантовые числа: 1) т l=-3; 2) ms =1/2, l=2;3) ms=-l/2, т l =1.[1) 2; 2) 5; 3) 3]
6.54.Запишите квантовые числа, определяющие внешний, или валентный, электрон в основном состоянии атома натрия.[n=3, l =0, т l =0, ms =±1/2]
Раздел 4. Физика ядра
Основные формулы

|
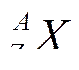

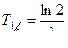
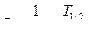

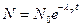
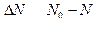
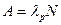
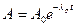
Правила смещения
| a- распад | β- - распад | β+ - распад |
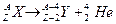
| 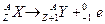
| 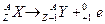
|
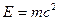
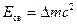
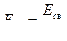
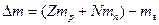
Энергия связи, приходящаяся на 1 а.е.м. (1 а.е.м.=1,660565∙10-27 кг), равна 931,4 МэВ.
Энергия ядерной реакции: Q=c2[(m1+m2)-(m3+m4)]
| Величина | Единица | ||
| Обозначение | Наименование | ||
| Z | порядковый номер водородоподобного элемента | - | - |
| N0 | число атомов в начальный момент времени | ||
| l р | постоянная распада | 1/с | 1/с |
| τ | среднее время жизни атома радиоактивного вещества | с | с |
| А0 | начальная активность | Бк(беккерель) | с-1 |
| E св | энергия связи | Дж | кг∙м2/c2 |
| E уд | удельная энергия связи | Дж/нуклон | |
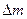
| дефект массы | кг | кг |
| m р | масса протона | кг | кг |
| mn | масса нейтрона | кг | кг |
| m я | масса ядра | кг | кг |
r0 = 1,4∙10-15 м – коэффициент пропорциональности
с ≈ 3∙108 м/с – скорость света в вакууме
| Масса частиц | |
| электрона | 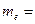 9,1×10–31кг » 5,5×10–4 а.е.м. 9,1×10–31кг » 5,5×10–4 а.е.м.
|
| протона | 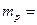 1,672648586∙10-27 кг=1,00727647011 а.е.м. 1,672648586∙10-27 кг=1,00727647011 а.е.м.
|
| нейтрона | 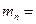 1,674954386∙10-27 кг=1,00866501237 а.е.м. 1,674954386∙10-27 кг=1,00866501237 а.е.м.
|
Масса нейтральных атомов
| Элемент | Порядко-вый номер | Изотоп | Масса, а.е.м. | Элемент | Порядко-вый номер | Изотоп | Масса, а.е.м. |
| (Нейтрон) | 0 | п | 1,00867 | Азот | 7 | 13 N | 13,00574 |
| Водород | 1 | 1Н | 1,00783 | 14 N | 14,0030 | ||
| 2Н | 2,01410 | 15 N | 15,00011 | ||||
| 3Н | 3,01605 | Кислород | 8 | 16 O | 15,99491 | ||
| Гелий | 2 | 3Не | 3,01603 | 17 О | 16,99913 | ||
| 4 Не | 4,00260 | 18 O | 17,99916 | ||||
| Литий | 3 | 6 Li | 6,01513 | Фтор | 9 | 19 F | 18,99840 |
| 7 Li | 7,01601 | Натрий | 11 | 22 Na | 21,99444 | ||
| Бериллий | 4 | 7 Be | 7,01693 | 23 Na | 22,98977 | ||
| 9 Be | 9,01219 | Магний | 12 | 23 Mg | 22,99414 | ||
| 10 Be | 10,01354 | Алюминий | 13 | 30 Al | 29,99817 | ||
| Бор | 5 | 9B | 9,01333 | Кремний | 14 | 31 Si - | 30,97535 |
| 10 В | 10,01294 | Фосфор | 15 | 31 P | 30,97376 | ||
| 11 В | 11,00931 | Калий | 19 | 41 K | 40,96184 | ||
| Углерод | 6 | 10 С | 10,00168 | Кальций | 20 | 44 Ca | 43,95549 |
| 12 С | 12,00000 | Свинец | 82 | 206 Pb | 205,97446 | ||
| 13 С | 13,00335 | Полоний | 84 | 210 Po | 209,98297 | ||
| 14 С | 14,00324 |
|
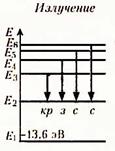
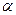 - излучение - ионизирующее излучение, состоящее из альфа-частиц (ядра атома гелия
- излучение - ионизирующее излучение, состоящее из альфа-частиц (ядра атома гелия 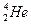 ), характеризующееся малой проникающей способностью (от него защищает ткань, лист бумаги) и высокой относительной биологической эффективностью; используется в лучевой терапии;
), характеризующееся малой проникающей способностью (от него защищает ткань, лист бумаги) и высокой относительной биологической эффективностью; используется в лучевой терапии;
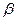 -излучение (бета-лучи) - поток электронов (
-излучение (бета-лучи) - поток электронов ( 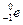 ) или позитронов (
) или позитронов ( 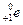 ), испускаемых при бета-радиоактивном распаде атомов, для защиты от него используются толстые слои металла;
), испускаемых при бета-радиоактивном распаде атомов, для защиты от него используются толстые слои металла;
γ -излучение – поток высокочастотного электромагнитного излучения, обладает высокой проникающей способностью, его можно ослабить, используя толстые листы свинца и железобетонные конструкции.

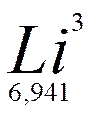
В ядерной физике участников ядерной реакции принято записывать:

Массовое число A может быть только целым, так как показывает количество нуклонов.
|
|
Изотопы (от греч. isos — одинаковый и topos — место), разновидности атомов одного и того же химического элемента, атомные ядра которых содержат одинаковое число протонов и различное число нейтронов.
В ядрах водорода всегда 1 протон, а число нейтронов может быть равно 0 (протий), 1 (дейтерий), 2 (тритий).
Альфа-расп а д ( 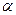 -распад) – это испускание альфа-частиц атомными ядрами в процессе самопроизвольного (спонтанного) радиоактивного распада.
-распад) – это испускание альфа-частиц атомными ядрами в процессе самопроизвольного (спонтанного) радиоактивного распада.
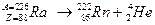
|
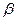 -распад) - это радиоактивный распад атомного ядра, сопровождающийся вылетом из ядра электрона.
-распад) - это радиоактивный распад атомного ядра, сопровождающийся вылетом из ядра электрона.
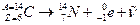
Этот процесс обусловлен самопроизвольным превращением одного из нуклонов ядра в нуклон другого рода, а именно превращением нейтрона ( 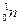 ) в протон (
) в протон ( 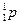 ).
).
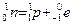 +
+ 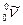
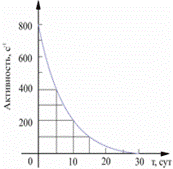
Период полураспада – это время, в течение которого распадается половина атомов данного количества радиоактивного вещества. Период полураспада обозначается Т.
Единицы измерения [c].
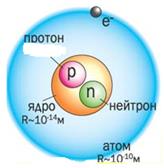
Ядерные силы - это силы взаимодействия между нуклонами; обеспечивают большую величину энергии связи. Ядерные силы являются наиболее важным и распространённым примером сильного взаимодействия. Ядерные силы примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов.
|
Особенностью ядерных сил является то, что они действуют на малых расстояниях, около 10-14 м.
Энергия связи атомных ядер. Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы. Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
Есв= ∆Мс2
c ≈ 3×108 м/с– скорость света в вакууме;
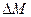 - дефект массы, [кг] или [а.е.м.] (атомная единица массы[58])
- дефект массы, [кг] или [а.е.м.] (атомная единица массы[58])
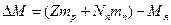
Z - зарядовое число;
mp – масса протона, [кг] или [а.е.м.];
Nn - количество нейтронов;
mn – масса нейтрона, [кг] или [а.е.м.];
Mя- масса ядра, [кг] или [а.е.м.];
Nр - количество протонов.
Ядерная реакция – это процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, сопровождающийся изменением состава и структуры ядра и выделением вторичных частиц или γ-квантов.
При ядерных реакциях выполняются законы сохранения: импульса, энергии, зарядового и массового числа.
6.55.Укажите второй продукт ядерной реакции: 2713Al + 10n = ? + 42He.
6.56.Укажите второй продукт ядерной реакции: 147N + 42He = 11H + ?
6.57.Какая доля радиоактивных атомов распадается через промежуток времени, равный двум периодам полураспада?
6.58.Определите период полураспада радиоактивного изотопа, если 5/8 начального количества ядер этого изотопа распалось за 849 с. [10 мин]
6.59.Постоянная радиоактивного распада изотопа  РЬ равна 10-9 с-1. Определите время, в течение которого распадется 2/5 начального количества ядер этого радиоактивного изотопа. [16,2 лет]
РЬ равна 10-9 с-1. Определите время, в течение которого распадется 2/5 начального количества ядер этого радиоактивного изотопа. [16,2 лет]
6.60.Вычислите дефект массы и энергию связи ядра  В.[0,079 а.е.м.;73,64 МэВ]
В.[0,079 а.е.м.;73,64 МэВ]
6.61.Определите удельную энергию связи ядра 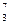 Li .
Li .
6.62.Объясните, как изменится положение химического элемента в таблице Менделеева после a- и β-распадов ядер его атомов.
6.63. Ядро изотопа урана 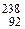 U после нескольких радиоактивных распадов превратилось в ядро изотопа
U после нескольких радиоактивных распадов превратилось в ядро изотопа 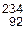 U. Какие это были распады?
U. Какие это были распады?
6.64.Пользуясь таблицей Менделеева и правилами смещения, определите, в какой элемент превращается 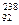 U после трех a- и двух β -распадов.
U после трех a- и двух β -распадов.
6.65.Радиоактивный изотоп радия 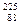 Ra претерпевает четыре a -распада и два β - распада. Определите для конечного ядра: 1) зарядовое число Z; 2) массовое число А.
Ra претерпевает четыре a -распада и два β - распада. Определите для конечного ядра: 1) зарядовое число Z; 2) массовое число А.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Детлаф А.А.,.Яворский Б.М. Курс физики. М.: Высшая школа, 1989.
2. Савельев И.В. Курс общей физики. М.: Наука, т. 1-3, 1978.
3. Яворский Б.М., Детлаф А.А. Справочник по физике. – М.: Наука, 1985.
4. Анисимов В.М., Данилова И.Н., Солохина Г.Э., Пронина В.С. Лабораторные работы по физике. Часть 1. Часть 2 / Под ред. Г.Г.Спирина, - М.: ОАО Авиаиздат, 2007.
5. Анисимов В.М., Третьякова О.Н.. Механика. Практический курс/ Под ред. Г.Г.Спирина, М.: ОАО Авиаиздат, 2007.
6. Анисимов В.М., Третьякова. Основы квантовой физики. Практический курс. / Под ред. . Г.Г.Спирина, М.: ОАО Авиаиздат, 2007.
7.Ваулин Е.Л., Гордеев О.А., Коновалова З.И.,.Мартыненко Т.П, Одинцова Г.А., Тарасов В.Е., Третьякова О.Н. Квантовая физика. Практический курс. /Под ред. проф. Г.Г.Спирина, - М.: ОАО Авиаиздат, 2007.
8.Лаушкина Л.А, Солохина Г.Э., Черкасова М.В. Молекулярная физика и термодинамика. Практический курс/Под ред. проф. Г.Г.Спирина, - М.: ОАО Авиаиздат, 2007.
9.Лаушкина Л.А., Солохина Г.Э., Хохлачева Г.М, Электромагнетизм. Практический курс /Под ред. проф. Г.Г.Спирина, - М.: ОАО Авиаиздат, 2007.
10.Рудакова Л.И., Соколова Е.Ю., Ющенко Т.А. Волновая оптика. Практический курс. /Под ред. проф. Г.Г.Спирина, - М.: ОАО Авиаиздат, 2007.
11.Яворский Б.М., Детлаф А.А. Справочник по физике. – М.: Наука, 1985.
СПРАВОЧНЫЙ ОТДЕЛ
Таблица 1.
Справочные данные
| Постоянные величины | Приставки | |
| G = 6,67×10–11 Н∙м2/кг2 NА= 6,02×1023 моль-1 k = 1,38×10-23 Дж/К R = 8,31 Дж/(моль∙ К) к = 9×109 Н∙м2/Кл2 e0 = 8,85×10-12 Ф/м c ≈ 3×108 м/с h = 6,63×10-34 Дж∙с | Э экса 1018 П пэта 1015 Т тера 1012 Г гига 109 М мега 106 к кило 103 г гекто 102 да дека 101 | д деци 10-1 с санти 10-2 м милли 10-3 мк микро 10-6 н нано 10-9 п пико 10-12 ф фемто 10-15 аа а атто 10-18 |
Таблица 2.
Диэлектрическая проницаемость некоторых веществ
| Вещество | 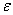
|
| Вода (чистая) | 81 |
| Воздух | 1,0006 |
| Кварц | 4,5 |
| Парафин | 2,3 |
| Слюда | 6-8 |
| Стекло | 4-7 |
Дата: 2019-04-23, просмотров: 515.