Основные формулы
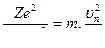

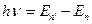
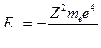
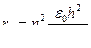 v =
v = 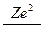
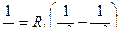
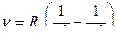 , n = 1, 2, 3, …; n΄ = n+1, n+2,…
, n = 1, 2, 3, …; n΄ = n+1, n+2,…
| Серия Лаймана (ультрафиолетовый диапазон) | Серия Бальмера (видимый диапазон) | Серия Пашена (инфракрасный диапазон) |
| n=1 | n=2 | n=3 |
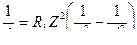
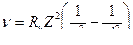
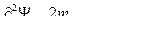
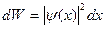
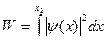
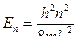
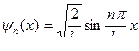
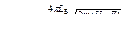
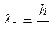

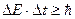
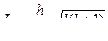
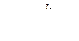
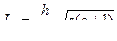
Квантовые числа
| Обозначение | Наименование | Принимаемые значения |
| n | главное | 1,2,3… |
| l | орбитальное | 0,1,2,…,(n-1) |
| ml | магнитное | 0,±1,±2,±… ±l |
| s ms | спиновое магнитное спиновое | 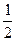 ±
± 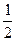
|
| n | 1 | 2 | 3 | 4 |
| Обозначение оболочки | K | L | M | N |
| l | 0 | 1 | 2 | 3 |
| Обозначение подоболочки | s | p | d | f |
| Величина | Единица | ||
| Обозначение | Наименование | ||
| Z | порядковый номер водородоподобного элемента | - | - |
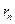
| радиус n-ой орбиты | м | м |
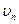
| скорость электрона на n-ой орбите | м/с | м/с |
| n | номер орбиты, главное квантовое число | - | - |
| ν | частота | Гц | 1/с |
| λ | длина волны | м | м |
| Е | энергия | Дж | кг∙м2/с2 |
| U | разность потенциалов, приложенная к рентгеновской трубке | В | кг∙м2/(А∙с3) |
| λБ | длина волны де Бройля | м | м |
| р | импульс частицы | кг∙м/c | кг∙м/c |
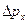
| неопределенность проекции импульса на ось х | кг∙м/c | кг∙м/c |
| Δх | неопределенность координаты | м | м |
| ΔЕ | неопределенность энергии данного квантового состояния | Дж | кг∙м2/с2 |
| Δ t | время пребывания системы в данном квантовом состоянии | с | с |
| ψ(х) | волновая функция | ||
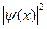
| плотность вероятности | ||
| dW | вероятность обнаружить частицу в интервале от x до х+dx | ||
| W | вероятность обнаружить частицу в интервале от x1 до х2 | ||
| l я | ширина потенциального ящика | м | м |
| D | прозрачность потенциального барьера | - | - |
| U | высота потенциального барьера | Дж | кг∙м2/с2 |
| m | масса | кг | кг |
| L | орбитальный момент импульса электрона | кг∙м/c | кг∙м/c |
| l | орбитальное квантовое число | - | - |
| LZ | проекция орбитального момента импульса электрона | кг∙м/c | кг∙м/c |
| L Б | ширина барьера | м | м |
| ml | магнитное квантовое число | - | - |
| ms | спиновое квантовое число | - | - |
| Т | абсолютная температура | К | К |
| n | концентрация | м-3 | м-3 |
| с V | молярная теплоемкость | Дж/(моль∙К) | кг∙м2/(мольК∙с2) |
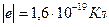
mе = 9,1∙10-31 кг – масса покоя электрона
 1,672648586∙10-27 кг – масса покоя протона
1,672648586∙10-27 кг – масса покоя протона
 1,674954386∙10-27 кг – масса покоя нейтрона
1,674954386∙10-27 кг – масса покоя нейтрона
e0 = 8,85×10-12 Ф/м – электрическая постоянная (диэлектрическая проницаемость вакуума)
Rλ=1,097∙107 м-1 – постоянная Ридберга Rν=Rl∙c=3,29∙1015 с-1
h = 6,625∙10-34 Дж∙с – постоянная Планка
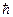 =h/2π = 1,0545887∙10-34 Дж∙с – редуцированная постоянная Планка или постоянная Дирака
=h/2π = 1,0545887∙10-34 Дж∙с – редуцированная постоянная Планка или постоянная Дирака
с ≈ 3∙108 м/с – скорость света в вакууме
k=1,38∙10-23 Дж/К – постоянная Больцмана
Модели строения атома
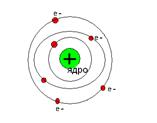
| Модель Томсона[41] (пудинг с изюмом) 1903 г | Модель Резерфорда[42] (планетарная модель) 1911 г . | Модель Д.Д.Иваненко[43] и В.Гейзенберга[44] (протонно-нейтронная модель строения ядра) 1932 г . | ||||||
|
|
|
|
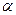 -частиц при прохождении через тонкие слои вещества.
-частиц при прохождении через тонкие слои вещества.
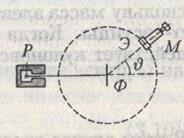
Опыт осуществлялся следующим образом. Выделяемый отверстием узкий пучок альфа-частиц, испускаемых радиоактивным веществом Р. падал на тонкую металлическую фольгу Ф. При прохождении через фольгу 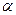 -частицы отклонялись от первоначального направления движения на различные углы -
-частицы отклонялись от первоначального направления движения на различные углы - 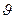 .
.
Рассеянные  -частицы ударялись об экран Э, покрытый сернистым цинком, и вызываемые ими сцинтилляции наблюдались в микроскоп M. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги, и устанавливать таким образом под любым углом. Весь прибор помещался в откачанный кожух, чтобы устранить рассеяние
-частицы ударялись об экран Э, покрытый сернистым цинком, и вызываемые ими сцинтилляции наблюдались в микроскоп M. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги, и устанавливать таким образом под любым углом. Весь прибор помещался в откачанный кожух, чтобы устранить рассеяние  -частиц за счет столкновений с молекулами воздуха.
-частиц за счет столкновений с молекулами воздуха.
Оказалось, что некоторое количество  -частиц рассеивается на очень большие углы (почти до 180°). Проанализировав результаты опыта, Резерфорд пришел к выводу, что столь сильное отклонение
-частиц рассеивается на очень большие углы (почти до 180°). Проанализировав результаты опыта, Резерфорд пришел к выводу, что столь сильное отклонение  -частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, которое создается зарядом, связанным с большой массой и сконцентрированным в очень малом объеме. Основываясь на этом выводе, Резерфорд предложил в 1911 г. ядерную модель атома.
-частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, которое создается зарядом, связанным с большой массой и сконцентрированным в очень малом объеме. Основываясь на этом выводе, Резерфорд предложил в 1911 г. ядерную модель атома.
Согласно Резерфорду атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющее размеры, не превышающие 10-12 см, а вокруг ядра расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре.
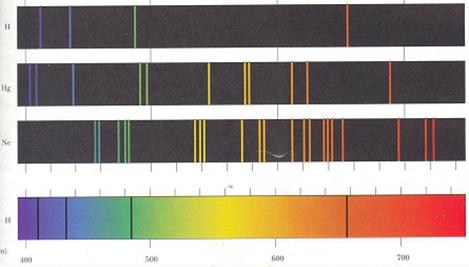
Энергетический спектр атомов и молекул - упорядоченная по длинам (частотам[45]) совокупность монохроматических волн, на которую разлагается свет или иное электромагнитное излучение. Типичный пример светового спектра - хорошо известная всем радуга.
Спектральным анализом называют совокупность физических методов качественного и количественного определения состава веществ в результате исследования их спектров излучения или поглощения.
Спектральный анализ является мощным средством исследования свойств веществ и установления новых закономерностей микромира.
Спектр можно получить, разложив данное излучение с помощью спектрального прибора (дифракционной решетки, призмы и т.д.).
Оптический спектр – это спектр излучения[46] или спектр поглощения[47] оптического излучения.
Спектры излучения : совокупность частот (или длин волн), которые содержатся в излучении какого-либо вещества.
|
Спектры поглощения - это совокупность частот, поглощаемых данным веществом.
Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы которого находятся в невозбужденном состоянии.
| Виды спектров | Состав спектра | Источники |
| Непрерывный | Содержит все длины волн определенного диапазона от красного с λ ≈ 7,6.10-7 м до фиолетового с λ ≈ 4.10-7 м | Излучают нагретые твердые и жидкие вещества, газы, нагретые под большим давлением |
| Линейчатый | Состоит из отдельных линий разного цвета (длины волны, частоты), имеющих разные расположения | Испускается газами в атомарном состоянии. Каждый атом излучает набор электромагнитных волн определенных частот. Каждый химический элемент имеет свой спектр |
| Полосатый | Состоят из широких спектральных полос, положение которых характерно для данного вещества | Испускается газом в молекулярном состоянии. |
Характерным свойством всех атомов и молекул является то, что спектр каждого элемента, молекулы данного вещества индивидуален, неповторим и служит в спектральном анализе средством его идентификации ("удостоверением личности").
В настоящее время составлены каталоги спектров всех элементов. Это позволяет выполнять поэлементный спектральный анализ сложных веществ путем расшифровки спектров в результате сравнения их с теми, которые находятся в каталогах спектров.
Спектр атома водорода.. Теоретический расчет спектров многоэлектронных атомов и молекул является очень сложной квантовомеханической (и математической) задачей. Наиболее простыми системами, дающими линейчатые спектры, являются атом водорода и водородоподобные атомы или ионы, то есть такие, у которых на последней (валентной) электронной оболочке находится один электрон.
В 1885 г. швейцарский ученый Иоган Бальмер обратил внимание на закономерности расположения спектральных линий в видимой и близкой к ультрафиолетовой области спектра атома водорода.

Частоты (длины волн) спектральных линий для атома водорода и водородоподобных атомов, лежащих в видимой части спектра, определяются по формулам:
ν = Rν ( 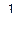 -
- 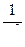 ), или
), или  = Rλ (
= Rλ ( 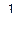 -
- 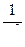 ),
),
где 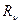 = 3,29∙1015 с-1 или Rλ = 1,097∙107 м-1 – постоянные Ридберга.
= 3,29∙1015 с-1 или Rλ = 1,097∙107 м-1 – постоянные Ридберга.
В 1906 г. Теодор Лайман открыл спектральную серию в ультрафиолетовой части спектра водорода (серия Лаймана). Причем частоты спектральных линий для атома водорода и водородоподобных атомов могут быть определены по формулам:
ν = Rν (1 - 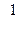 ) или
) или  = Rλ (1 -
= Rλ (1 - 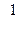 ),
),
Фридрих Пашен обнаружил в 1908 г. первые две линии инфракрасного участка спектра, которые могут быть рассчитаны по формуле:
ν = Rν (  -
- 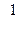 ) или
) или  = Rλ (
= Rλ (  -
- 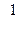 ).
).
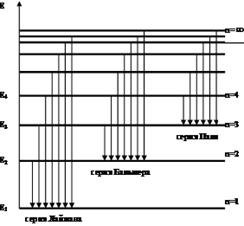
Все представленные серии спектральных линий атома водорода можно представить общими формулами:
ν = Rν 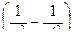 или
или  = Rλ
= Rλ 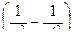 . (1)
. (1)
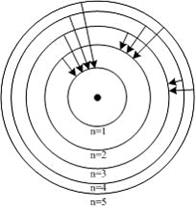
При n = 1 получается серия Лаймана, лежащая в далёкой ультрафио-летовой области спектра;
при n = 2 - серия Бальмера, линии которой расположены в видимой и близкой ультрафиолетовой областях;
При n = 3 - серия Пашена в инфракрасной области спектра.
Позже были обнаружены в инфракрасном диапазоне еще серии спектрального излучения, законы распределения которых также определяются формулами (1). Целые числа n и n1 называются главными квантовыми числами, причем 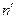 = n+1, n+2 и т.д.
= n+1, n+2 и т.д.
Постулаты Бора . С точки зрения классической физики наличие спектральных линий у атомов объяснить невозможно. Согласно теории электромагнитного излучения движущаяся заряженная частица – электрон является источником электромагнитного излучения, в процессе движения и излучения электрон должен терять свою энергию постепенно, следовательно, атом должен излучать непрерывный спектр.
Датский физик Н. Бор [48]в 1913 г. для объяснения устойчивости атома ввел основные допущения (постулаты), которые легли в основу теории атома Бора, явившейся предшественницей квантовой механики.
Теория Бора является первой попыткой аналитического описания закономерностей строения атома и спектра его излучения и дает хорошее согласование с экспериментом только для атома водорода и водородоподобных атомов.
В основе теории два постулата:
Первый постулат существования в атоме стационарных состояний (орбит движения электронов), не изменяющихся во времени без внешнего воздействия:
В атоме существует ряд дискретных стационарных состояний, которым соответствуют определенные значения энергии атома. В стационарном состоянии атом не излучает и не поглощает энергии.
Дискретные стационарные состояния в теории Бора отбираются с помощью "правила квантования орбит": момент импульса[49] электрона на стационарной орбите кратен постоянной Планка:
mvr = n 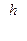 или mvr = n ħ, (2)
или mvr = n ħ, (2)
где m = 9,1∙10-31 кг – масса электрона,
v – скорость электрона на орбите,
r – радиус орбиты,
h = 6,63∙10-34 Дж∙с – постоянная М. Планка,
ħ = 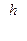 = 1,05∙10-34 Дж∙с
= 1,05∙10-34 Дж∙с
n = 1,2,3… - главное квантовое число.
Второй постулат испускания или поглощения одного кванта энергии при переходе атома из одного стационарного состояния в другое стационарное состояние.
При переходе атома из одного стационарного состояния в другое атом излучает и поглощает квант энергии ε = hν , равный разности энергий двух стационарных состояний:
hν = 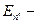
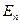
 или h
или h 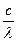 =
= 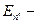
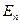 . (3)
. (3)
Теория Бора позволяет рассчитать параметры электрона в атоме (радиус орбиты, скорость, энергию).
r = 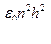 ; v =
; v = 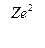 ; Еполн. = –
; Еполн. = – 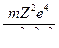 .
.
Радиус орбиты. Полагаем, что из атома удалены все электроны, кроме одного; и электрон вращается по круговой орбите вокруг неподвижного ядра, тогда
заряд ядра атома q = Z|e|,
где |е| = 1,6∙10-19 Кл - элементарный заряд,
Z - порядковый номер химического элемента в периодической таблице элементов Д.И. Менделеева.
Между положительно заряженным ядром (заряд q1 = Z|e|) и электроном (модуль заряда q2 = |e|) действует сила электростатического взаимодействия, которая согласно закону Кулона[50] может быть представлена:
F = 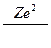 , где
, где
r – радиус орбиты,
ε0 = 8,85∙10-12 Ф/м – электрическая постоянная.
C другой стороны, так как электрон движется по окружности, следовательно, он обладает центростремительным (нормальным) ускорением
а = 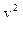
Согласно второму закону Ньютона: F = ma.
Значит:
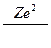 = m
= m 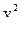 . (4)
. (4)
С помощью правила квантования орбит можно исключить скорость из формулы (2) и получить выражения для возможных радиусов орбит:
r = 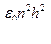 . (5)
. (5)
Скорость электрона в водородоподобном атоме. Используя формулу (4), можно получить выражение для расчета скоростей движения электрона по соответствующим орбитам:
v = 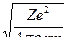 (6,а)
(6,а)
Если учесть формулу (5), то получим зависимость скорости от главного квантового числа
v = 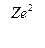 (6,б) .
(6,б) .
Энергия электрона в водородоподобном атоме. Полная энергия электрона складывается из кинетической
К = 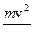
и потенциальной[51]
U = – 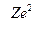 энергий. Учитывая выражение (6,а), получим:
энергий. Учитывая выражение (6,а), получим:
Еполн. = 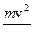 –
– 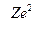 = –
= – 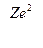 . (7)
. (7)
Если воспользоваться формулой (4), то увидим, что полная энергия зависит от квантового числа:
|
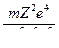 . (8)
. (8)
По второму постулату Бора при переходе электрона с орбиты (3):
hν = 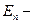
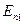 =
= 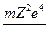
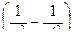 , следовательно,
, следовательно,
ν = 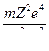
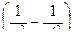 = Z2Rν
= Z2Rν 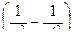 , где
, где
Rν = 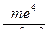 = 3,29∙1015 с-1 – постоянная Ридберга.
= 3,29∙1015 с-1 – постоянная Ридберга.
Или
h 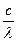 =
= 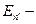
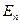 =
= 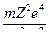
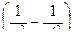 , следовательно,
, следовательно,
 =
= 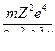
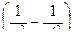 = Z2Rλ
= Z2Rλ 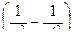 , (9)
, (9)
где
Rλ = 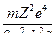 = 1,097∙107 м-1.
= 1,097∙107 м-1.
Из формул (5), (6,б), (8) видно, что для электрона в атоме (ионе) радиусы орбит, скорости и энергии в стационарных состояниях могут принимать только дискретные значения, определяемые квантовым числом n.
Атом водорода (Z = 1) имеет наиболее простой линейчатый спектр излучения.
|
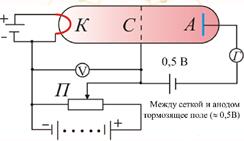
В трубке, заполненной парами ртути под небольшим давлением (~ 1ммрт. ст.), имелись три электрода: катод К, сетка С и анод А. Электроны, вылетавшие из катода вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов U , приложенной между катодом и сеткой.
Эту разность потенциалов можно было плавно менять с помощью потенциометра П.
Между сеткой и анодом создавалось слабое электрическое поле
(разность потенциалов порядка 0,5 В), тормозившее движение электронов к аноду.
|
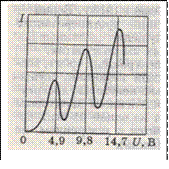
Полученные результаты представлены на рис. Видно, что сила тока вначале монотонно возрастала, достигая максимума при U = 4,9 В, после чего с дальнейшим увеличением U резко падала, достигая минимума, и снова начинала расти. Максимумы силы тока повторялись при U , равном 9,8; 14,7 В и т. д.).
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы могут воспринимать энергию только порциями: 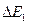 =
= 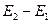 либо
либо 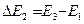 и т.д.
и т.д.
До тех пор, пока энергия электрона меньше 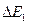 соударения между электроном и атомом ртути носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона при столкновениях практически не изменяется. Часть электронов попадает на сетку, остальные же, проскочив через сетку, достигают анода, создавая ток в цепи гальванометра Г. Чем больше скорость, с которой электроны достигают сетки (чем больше U ), тем больше доля электронов, проскочивших через сетку, и тем, следовательно, больше сила тока I.
соударения между электроном и атомом ртути носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона при столкновениях практически не изменяется. Часть электронов попадает на сетку, остальные же, проскочив через сетку, достигают анода, создавая ток в цепи гальванометра Г. Чем больше скорость, с которой электроны достигают сетки (чем больше U ), тем больше доля электронов, проскочивших через сетку, и тем, следовательно, больше сила тока I.
Когда энергия, накапливаемая электроном в промежутке катод-сетка, достигает значения 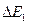 соударения перестают быть упругими - электроны при ударах об атомы передают им энергию
соударения перестают быть упругими - электроны при ударах об атомы передают им энергию 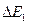 и продолжают затем двигаться с меньшей скоростью. Поэтому число электронов, достигающих анода, уменьшается. Например, при U = 5,3 В электрон сообщает атому энергию, соответствующую 4,9 В (первый потенциал возбуждения атома ртути), и продолжает двигаться с энергией 0,4 эВ. Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение 0,5 В и будет возвращен обратно на сетку.
и продолжают затем двигаться с меньшей скоростью. Поэтому число электронов, достигающих анода, уменьшается. Например, при U = 5,3 В электрон сообщает атому энергию, соответствующую 4,9 В (первый потенциал возбуждения атома ртути), и продолжает двигаться с энергией 0,4 эВ. Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение 0,5 В и будет возвращен обратно на сетку.
Атомы, получившие при соударении с электронами энергию 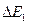 , переходят в возбужденное состояние, из которого они спустя время порядка
, переходят в возбужденное состояние, из которого они спустя время порядка 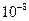 с возвращаются в основное состояние, излучая фотон с частотой
с возвращаются в основное состояние, излучая фотон с частотой 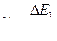 .
.
При напряжении, превышающем 9,8 В, электрон на пути катод-анод может дважды претерпеть неупругое соударение с атомами ртути, теряя при этом энергию 9,8 эВ, вследствие чего сила тока снова начнет уменьшаться. При еще большем напряжении возможны трехкратные неупругие соударения электронов с атомами, что приводит к возникновению максимума при U = 14,7 В, и т. д.
При достаточном разрежении паров ртути и соответствующем ускоряющем напряжении электроны за время до столкновения с атомами могут приобретать скорость, достаточную для перевода атома в состояние с энергией 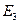 .
.
|
6.24. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровожда-ющиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Какой переход соответствует наибольшей частоте кванта в серии Лаймана?
6.25.Определите длину волны спектральной линии, соответствующую переходу электрона в атоме водорода с шестой боровской орбиты на вторую. К какой серии относится эта линия и которая она по счету? [0,41 мкм; четвертая линия серии Бальмера]
6.26.Определите длину волны, соответствующую второй спектральной линии в серии Пашена.
6.27.Определите максимальную и минимальную энергии фотона в видимой серии спектра водорода (серии Бальмера). [3,41 эВ; 1,89 эВ]
6.28.Определите энергию фотона, испускаемого при переходе электрона в атоме водорода с третьего энергетического уровня на второй. [1,89 эВ]
6.29.Определите частоту света, излучаемого возбужденным атомом водорода, при переходе электрона на второй энергетический уровень, если радиус орбиты электрона изменился в 9 раз.
6.30.Определите энергию ионизации атома водорода и найдите энергию фотона, соответствующую самой длинноволновой линии серии Лаймана. [13,6 эВ; 10,2 эВ]
6.31.Определите первый потенциал возбуждения атома водорода.
6.32.Определите работу, которую необходимо совершить, чтобы удалить электрон со второй боровской орбиты атома водорода за пределы притяжения его ядром. [5,45∙10-19 Дж]
6.33.Электрон выбит из атома водорода, находящегося в основном состоянии, фотоном энергии 17,7 эВ. Определите скорость электрона за пределами атома. [2,49 Мм/с]
6.34.Определите, какая энергия требуется для полного отрыва электрона от ядра однократно ионизованного атома гелия, если: 1) электрон находится в основном состоянии; 2) электрон находится в состоянии, соответствующем главному квантовому числу 3. [1) 54,4 эВ; 2) 6,04 э B]
6.35. Определите работу, которую необходимо совершить, чтобы удалить электрон со второй боровской орбиты атома водорода за пределы притяжения его ядром. [0,006 нм; 0,009 нм]
Дата: 2019-04-23, просмотров: 326.