а)Геометрическая изомерия (цис-,трансизомерия). Наблюдается у соединений с двойной связью и у малых циклов. В случае соединений с двойной связью два одинаковых заместителя, связаны с различными атомами углерода ,в цисизомерах расположены по одну сторону плоскости связи C=C, а в трансизомерах- по разные стороны:
CH3 CH3 CH3 H
\ / \ /
C=C С=С
/ \ / \
H H H CH3
цис-бутен – 2 транс-бутен -2
В случае малых циклов цис- и трансизомеры различаются взаимным расположением заместителей по отношению к плоскости цикла:
R1 R1 R1 R2
R2 R2 R2 R1
цисизомер трансизомер
б)Оптическая изометрия(энантиометрия,зеркальная изометрия ). Проявляется в способности некоторых соединений вращать плоскость поляризованного света в противоположные стороны. Это следствие хиральности молекул(несовместимость объекта с его отображением в идеальном плоском зеркале).
При наличии в молекуле асимметрического атома углерода (атом с четырьмя различными заместителями)молекула может существовать в виде двух изомеров(энантиомеры),относящихся друг к другу как несимметричныйпредмет и его зеркальное отображение.
H H
CI-C-I, I-C-CI.
Br Br
Амины. Их строение и свойства. Получение анилина и применение.
Ответ. Амины-производные аммиака, в молекуле которого атомы водорода (частично или полностью) замещены углеводородными радикалами.
В зависимости от числа радикалов различают амины первичные (с одним радикалом), вторичные ( с двумя) и третичные (с тремя).
R-N-H, R1-N-R2, R1-N-R2,
│ │ │
H H R3
первичный амин вторичный амин третичный амин
Названия аминов производят от названия радикалов, входящих в их молекулы, добавляя окончание –амин:
CH3NH2, CH3-NH-CH3,
метиламин диметиламин
CH3-CH2-N-CH2-CH2-CH3.
│
CH3
метилэтилпропиламин
Физические свойства
Простейшие амины – газы, имеющие запах аммиака. Средние амины – жидкости со слабым запахом рыбы, хорошо растворимые в воде. Высшие амины – твёрдые вещества без запаха. В воде нерастворимы.
Химические свойства
Свойства, сходные со свойствами аммиака
Сходства свойств аминов и аммиака объясняется их электронным строением. Молекулы аммиака и аминов содержат атомы азота, имеющий свободную не поделенную пару электронов (точками указаны электроны атома азота):
H H H R
x • x • x • x •
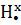
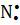 ,
, 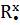
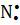 ,
, 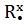
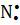 ,
, 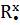
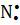 .
.
x • x• x• x•
H H R R
а) Взаимодействие с водой (образуется основание, раствор имеет щелочную реакцию):
CH3NH2 + HOH = [CH3NH3]+OH- .
гидроксид метиламмония
( слабое основание)
б) Взаимодействие с кислотами ( амины обладают основными свойствами: они присоединяют протон H+):
CH3NH2 + HCI = [ CH3NH3]CI.
хлорид метиламмония
Особые свойства:
1.Окисление ( горение на воздухе):
4CH3NH2 + 9O2 = 4CO2↑+ 2N2↑ + 10H2O.
2.Бромирование :
C6H5NH2 + 3Br2 = C6H2Br3NH2↓ + 3HBr.
2,4,6 - триброманилин
3.Присоединение алкилгалогенидов:
C6H5NH2 + C2H5CI = [C6H5NH2C2H5]+CI-.
Получение анилина
Получение анилина C6H5NH2 – восстановление нитросоединения до амина ( реакция Зинина,1842 г.):
C6H5NH2 + 3(NH4)2S = C6H5NH2 + 3S+ 6NH3+ 2H2O.
Современный метод:
Fe + 2HCI = FeCI2 + 2H,
атомарный
водород
C6H5NO2 + 6H = C6H5NH2 + 2H2O.
Наиболее перспективен контактный способ - пропускание смеси паров нитробензола и водорода над катализатором:
кат.
C6H5NO2 + 3H2 ═ C6H5NH2 + 2H2O.
300 °C
Восстановители: (NH4)2 S,H2, Fe (в виде чугунных стружек) в присутствии HCI.
Применение анилина:
Дата: 2019-05-28, просмотров: 307.