Периодическая система химических элементов – это графическое изображение пародического закона. Она представлена в виде таблицы, содержащей 7 периодов, 10 рядов и 8 групп элементов. Каждая группа состоит из двух подгрупп – главной и побочной.
Для элементов, объединенных в одну группу, характерны следующие закономерности:
Высшая валентность элементов в соединениях с кислородом соответствует номеру группы (исключение: медь может быть и двухвалентной).
В главных подгруппах с увеличением относительных атомных масс (при движении сверху вниз) усиливаются металлические свойства элементов и ослабевают неметаллические.
При движении по периоду слева направо усиливаются неметаллические свойства и ослабевают металлические.
Порядковый номер химического элемента (Z) совпадают с зарядом ядра его атома.
Для атома 1939K (А – массовое число): Z = 19 (число протонов) и N=A-Z=39-19=20 (число нейтронов).
Сущность периодичности состоит в том, что при возрастании положительных зарядов ядер атомов химических элементов наблюдается периодическое повторение химических элементов с одинаковым числом валентных (внешних) электронов. Этим объясняется периодическая повторяемость свойств элементов и их соединений.
Значение периодического закона
Закон сыграл большую роль в создании современной теории строения атома, которая подтвердила его положения.
Явление периодичности в изменении свойств химических элементов было объяснено электронными структурами атомов.
Возрастание числа химических элементов в периодах (2-8, 18-32) привело ученых к мысли о заполнении энергетических уровне соответствующим числом электронов.
На основе периодического закона удалось предсказать и открыть заурановые элементы.
Периодический закон и периодическая система химических элементов имели большое значение для открытия радиоактивных изотопов и областей их применении.
6. В периодическом законе и периодической системе химических элементов ярко проявляются общие законы развития природы:
• закон перехода количества в качество,
• закон единства и борьбы противоположностей,
• закон отрицания отрицания.
Амфотерность неорганических и органических соединений.
Ответ. Амфотерные элементы – элементы, оксиды и гидроксиды которые проявляют амфотерные свойства.
К амфотерным элементам относятся: алюминий, цинк, хром, желез, марганец и др.
Амфотерные оксиды – это оксиды элементов, проявляющие свойства, характерные и для основных оксидов
Al2O3 + 2NaOH сплавление2NaAlO2 + H2O,
(твердый) алюминат натрия
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Амфотерные гидроксиды – гидроксиды, проявляющие свойства, характерные и для кислот, и для оснований:
Al (OH)3 + 3HCl = AlCl3 +3H2O (Al(OH)3 как основание),
Al(OH)3 +NaOH + 2H 2O = Na[Al(OH) 4(H 2O) 2) ] (Al(OH)3 как кислота ).
Чем выше степень окисления элемента, тем более сильные кислотные свойства проявляют его оксиды (например, хром).
Среди органических соединений амфотерными свойствами обладают аминокислоты благодаря наличию двух функциональных групп:NH2 (аминогруппа) и СООH (карбоксильная группа).
Для аминокислот характерны свойства, присущие аминам и карбоновым кислотам.
1. Свойства кислоты:
а) взаимодействие с металлом:
2NH2CH2COOH + 2Na = 2NH2CH2COONa + H2 ↑
б) взаимодействие с оксидом металла:
2NH2CH2COOH + MgO = (NH2CH2COO)2 Mg + H2O;
в) взаимодействие с основанием:
NH2CH2COOH + NaOH = NH2CH2COONa + H2O;
г) взаимодействие с солью:
2NH2CH2COOH + Na2CO3 = 2NH2CH2COONa + H2O + CO2↑;
д ) реакция этерификации:
NH2CH2COOH + HOC2H5 = NH2CH2COOC2H5 + H2O.
2. Свойства (как амин):
NH2CH2COOH + HCl = Cl- [+NH2CH2COOH] .
3. Поликонденсация(взаимодействие друг с другом):
NH2CH2COOH + H2NCH2COOH = NH2CH2 CONH CH2COOH + H2O;
пептидная группа
дипептид ɑ- аминоуксусной кислоты
Многоатомные спирты, их строение свойства и применение.
Физические свойства
Вязкие, сиропоподобные жидкости, без цвета и запаха, сладковатого вкуса, хорошо растворимые в воде. Температура кипения этиленгликоля – 197,6 ̊С, глицерина – 290 ̊С. Этиленгликоль – яд!
Химические свойства
1. Взаимодействие со щелочными металлами:
CH2(OH)CH2(OH) + 2Na = CH2(ONa)CH2(ONa) + H2↑.
2. Взаимодействие с галогеноводородами:
CH2(OH)CH2(OH) + 2HCl = CH2ClCH2Cl + 2H2O.
дихлорэтан
3. Нитрование:
CH2(OH)CH(OH)СH2(OH) + 3HNO3 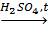 CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O . нитроглицерин
CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O . нитроглицерин
4. Качественная реакция на глицерин:
2CH2 (OH)CH(OH)CH2(OH) + Cu(OH)2
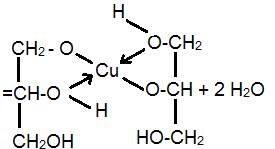
глицерат меди(II)
(раствор ярко-синего цвета)
Получение
1. 3С2H4 + 2KMnO4 + 4H2O = 3CH2(OH)CH2(OH) + 2MnO2 + 2KOH.
2. CH2ClCH2Cl + 2NaOH = CH2(OH)CH2(OH) + 2NaCl.
3. 2C2H4 + O2 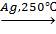 2H2C – CH2,
2H2C – CH2,
\ /
O
этиленоксид
H2C – CH2 + H2O = CH2(OH)CH2(OH)
\ /
O
4. CH3CHCH2 + O2  CH2CHCHO + H2O,
CH2CHCHO + H2O,
акролен
CH2CHCHO + H2 = CH2CHCH2OH,
аллиловый спирт
CH2CHCH2OH + H2O2 = CH2(OH)CH(OH)CH2(OH).
Применение
1. В производстве антифризов (веществ, понижающих температуру замерзания растворов).
В парфюмерии (глицерин).
Ответ. Окислительно - восстановительные реакции – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. При этом происходит смещение валентных (связывающих) электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью.
0 +5 +2 +4
Cu + 4HNO3 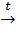 Cu(NO3)2 + 2NO2
Cu(NO3)2 + 2NO2  + 2H2O.
+ 2H2O.
Если атом, ион или молекула в процессе реакции оттягивает на себя дополнительную электронную плотность( присоединение электронов), то этот атом, ион или молекула называется окислителем, а сам процесс присоединение электронов – восстановлением.
В нашем случае: +5 +4
N+1e= N,
Написать схему реакции.
Физические свойства
Химические свойства
1.Горение ( сильный коптящее пламя):
2C6H6 + 15O2=12CO2↑ + 6H2O.
Получение
1.Дегидрирование циклопарафинов ( Зелинский, 1912 г.):
C6H12 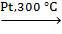 C6H6 + 3H2.
C6H6 + 3H2.
2.Дегидрирование алканов:
C6H14 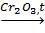 C6H6 + 4H2.
C6H6 + 4H2.
3.Тримеризация ацетилена:
актив. уголь
3C2H2 C6H6.
600 °С
Применение
Как растворитель лаков.
7.Как добавка к моторному топливу (для повышения октанового числа).
Ответ. Изомерия – существование соединений, имеющих одинаковый состав и одинаковую молекулярную массу, но различное строение молекул. Такие соединения, обладающие различными физическими и химическими свойствами, называют изомерами.
При наличии в молекуле асимметрического атома углерода (атом с четырьмя различными заместителями)молекула может существовать в виде двух изомеров(энантиомеры),относящихся друг к другу как несимметричныйпредмет и его зеркальное отображение.
H H
CI-C-I, I-C-CI.
Br Br
Физические свойства
Химические свойства
H H H R
x • x • x • x •
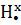
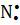 ,
, 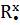
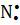 ,
, 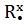
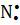 ,
, 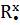
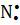 .
.
x • x• x• x•
H H R R
а) Взаимодействие с водой (образуется основание, раствор имеет щелочную реакцию):
CH3NH2 + HOH = [CH3NH3]+OH- .
гидроксид метиламмония
( слабое основание)
б) Взаимодействие с кислотами ( амины обладают основными свойствами: они присоединяют протон H+):
CH3NH2 + HCI = [ CH3NH3]CI.
хлорид метиламмония
Особые свойства:
1.Окисление ( горение на воздухе):
4CH3NH2 + 9O2 = 4CO2↑+ 2N2↑ + 10H2O.
2.Бромирование :
C6H5NH2 + 3Br2 = C6H2Br3NH2↓ + 3HBr.
2,4,6 - триброманилин
3.Присоединение алкилгалогенидов:
C6H5NH2 + C2H5CI = [C6H5NH2C2H5]+CI-.
Получение анилина
Получение анилина C6H5NH2 – восстановление нитросоединения до амина ( реакция Зинина,1842 г.):
C6H5NH2 + 3(NH4)2S = C6H5NH2 + 3S+ 6NH3+ 2H2O.
Современный метод:
Fe + 2HCI = FeCI2 + 2H,
атомарный
водород
C6H5NO2 + 6H = C6H5NH2 + 2H2O.
Наиболее перспективен контактный способ - пропускание смеси паров нитробензола и водорода над катализатором:
кат.
C6H5NO2 + 3H2 ═ C6H5NH2 + 2H2O.
300 °C
Восстановители: (NH4)2 S,H2, Fe (в виде чугунных стружек) в присутствии HCI.
Применение анилина:
Ответ.
1. Получение (COOH)2 ( Ф.Вёлер, 1824 г.):
t
2C + N2 = C2N2,
дициан
C2N2 + 4H2O=(COONH4)2,
оксалат аммония
(COONH4)2 + H2SO4=(COOH)2 + (NH4)2SO4.
2.Синтез мочевины :
а ) (CN)2 + 2NH3 + H2O = CO(NH2)2 + NH4 CN (Вёлер ,1824 г .);
t
б )2C + N2 = C2N2,
C2N2 + H2 = 2HCN,
синильная кислота
HCN + NH3 = NH4 CN,
цианид аммония
2NH4CN + O2 = 2NH4CNO,
цианат аммония
NH4 –O-C≡N 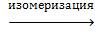 NH2 –CO-NH2(Вёлер,1828 г.).
NH2 –CO-NH2(Вёлер,1828 г.).
Егидная группа.
О
-С
Н.
7. Разложение:
HCOOH 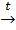 CO↑+H2O.
CO↑+H2O.
H 2 SO 4
Получение
1. Из соли :
2CH3COONa+H2SO4=2CH3COOH+Na2SO4.
2. Окисление алкана:
2СH4+3O2=2HCOOH+2H2O.
3. Окисление спирта:
R-CH2OH+O2=R-COOH+H2O.
4. Окисление альдегида:
R-CHO+[O]=R-COOH
альдегид окислитель
5. Из оксида углерода( II) и гидроксида натрия:
CO+NaOH 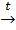 HCOONa,
HCOONa,
p формиат натрия
2HCOONa+H2SO4=2HCOOH+Na2SO4.
6. Из спирта и оксида углерода( II) :
СH3OH+CO 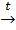 CH3COOH.
CH3COOH.
p
7. Гидролиз нитрилов:
CH3C≡N+2H2O=CH3COOH+NH3.
Применение
HCOOH – в синтезе органических веществ ( как восстановитель), в пищевой отрасли промышленности (как антисептик и консервант), в текстильной отрасли промышленности (при крашении тканей), в медицине (как средстве для растирания).
2. CH3COOH – для получения пластмасс, красителей, лекарственных веществ, искусственного волокна (ацетатный шелк), невоспламеняющейся кинопленки. Ее соли – гербициды. Ее сложные эфиры используются в парфюмерии и медицинской отрасли промышленности.
3. C15H31COOH и C17H35COOH – для получения мыл.
Структура
Третичная структура белка- специфическое взаимное расположение участков спиральной цепи молекулы белка и отдельных молекул. Третичная структура обусловлена наличием дисульфидных, сложноэфирных и солевых мостиков, а также межмолекулярных водородных связей.
Физические свойства
Химические свойства
1. Денатурация – процесс необратимого свертывания белков, связанный с разрушением исходной структуры. Денатурация происходит при высоких температурах, действии радиации, солей тяжелых металлов, химических веществ( кислот, щелочей, спиртов).
Значение белков в природе
Функции белков в живых организмах следующие : строительная ( из белков состоят тела всех живых существ), двигательная ( актин, миозин), транспортная( гемоглобин), защитная (специфические реакции иммунитета- антитела), сигнальная ( белки, плазмалеммы, рецепторы), каталитическая ( пепсины, расщепляют белки), регуляторная ( инсулин участвует в обмене углеводов).
Гетерогенные реакции протекают между веществами, находящимися в разных фазах. Пример такой реакции- растворение железных стружек в соляной кислоте.
Скорость гомогенной реакции- это величина, определяемая изменением концентрации одного из вступивших или образующихся в результате реакции веществ в единицу времени в единице объема:
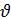 гомог= -(С2-С1)/(t2-t1)=
гомог= -(С2-С1)/(t2-t1)=  C/
C/  t (моль*л-1* с-1).
t (моль*л-1* с-1).
Скорость гетерогенной реакции- величина, определяемая числом молей веществ, вступивших в реакцию или образовавшихся в единицу времени на единице поверхности:
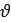 гетер= -
гетер= -  v/(S
v/(S  t).
t).
АКР- в узлах атомы. Примеры : бор, углерод (алмаз), кремний, германий. Атомы соединены прочными ковалентными связями, поэтому для веществ характерны высокие температуры кипения и плавления, высокая прочность и твердость. Большинство таких веществ не растворимо в воде.
ИКР – в узлах катионы и анионы. Примеры : NaCl, KF, LiBr. Такой тип решетки имеется у соединений с ионным типом связи (металл-неметалл). Вещества тугоплавкие, малолетучие, сравнительно прочные, хорошие проводники электрического тока, хорошо растворимы в воде.
Мет. КР – решетка веществ, состоящих только из атомов металла. Примеры : Na, K, Al, Zn, Pb и т.д. Агрегатное состояние твердое, нерастворимо в воде. Кроме щелочных и щелочно-земельных металлов, проводники электрического тока, температуры кипения и плавления колеблются от средних до очень высоких.
Периодическая система химических элементов – это графическое изображение пародического закона. Она представлена в виде таблицы, содержащей 7 периодов, 10 рядов и 8 групп элементов. Каждая группа состоит из двух подгрупп – главной и побочной.
Для элементов, объединенных в одну группу, характерны следующие закономерности:
Дата: 2019-05-28, просмотров: 650.