В главных подгруппах с увеличением относительных атомных масс (при движении сверху вниз) усиливаются металлические свойства элементов и ослабевают неметаллические.
При движении по периоду слева направо усиливаются неметаллические свойства и ослабевают металлические.
Порядковый номер химического элемента (Z) совпадают с зарядом ядра его атома.
Для атома 1939K (А – массовое число): Z = 19 (число протонов) и N=A-Z=39-19=20 (число нейтронов).
Сущность периодичности состоит в том, что при возрастании положительных зарядов ядер атомов химических элементов наблюдается периодическое повторение химических элементов с одинаковым числом валентных (внешних) электронов. Этим объясняется периодическая повторяемость свойств элементов и их соединений.
Значение периодического закона
Закон сыграл большую роль в создании современной теории строения атома, которая подтвердила его положения.
Явление периодичности в изменении свойств химических элементов было объяснено электронными структурами атомов.
Возрастание числа химических элементов в периодах (2-8, 18-32) привело ученых к мысли о заполнении энергетических уровне соответствующим числом электронов.
На основе периодического закона удалось предсказать и открыть заурановые элементы.
Периодический закон и периодическая система химических элементов имели большое значение для открытия радиоактивных изотопов и областей их применении.
6. В периодическом законе и периодической системе химических элементов ярко проявляются общие законы развития природы:
• закон перехода количества в качество,
• закон единства и борьбы противоположностей,
• закон отрицания отрицания.
Амфотерность неорганических и органических соединений.
Ответ. Амфотерные элементы – элементы, оксиды и гидроксиды которые проявляют амфотерные свойства.
К амфотерным элементам относятся: алюминий, цинк, хром, желез, марганец и др.
Амфотерные оксиды – это оксиды элементов, проявляющие свойства, характерные и для основных оксидов
Al2O3 + 2NaOH сплавление2NaAlO2 + H2O,
(твердый) алюминат натрия
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Амфотерные гидроксиды – гидроксиды, проявляющие свойства, характерные и для кислот, и для оснований:
Al (OH)3 + 3HCl = AlCl3 +3H2O (Al(OH)3 как основание),
Al(OH)3 +NaOH + 2H 2O = Na[Al(OH) 4(H 2O) 2) ] (Al(OH)3 как кислота ).
Чем выше степень окисления элемента, тем более сильные кислотные свойства проявляют его оксиды (например, хром).
Среди органических соединений амфотерными свойствами обладают аминокислоты благодаря наличию двух функциональных групп:NH2 (аминогруппа) и СООH (карбоксильная группа).
Для аминокислот характерны свойства, присущие аминам и карбоновым кислотам.
1. Свойства кислоты:
а) взаимодействие с металлом:
2NH2CH2COOH + 2Na = 2NH2CH2COONa + H2 ↑
б) взаимодействие с оксидом металла:
2NH2CH2COOH + MgO = (NH2CH2COO)2 Mg + H2O;
в) взаимодействие с основанием:
NH2CH2COOH + NaOH = NH2CH2COONa + H2O;
г) взаимодействие с солью:
2NH2CH2COOH + Na2CO3 = 2NH2CH2COONa + H2O + CO2↑;
д ) реакция этерификации:
NH2CH2COOH + HOC2H5 = NH2CH2COOC2H5 + H2O.
2. Свойства (как амин):
NH2CH2COOH + HCl = Cl- [+NH2CH2COOH] .
3. Поликонденсация(взаимодействие друг с другом):
NH2CH2COOH + H2NCH2COOH = NH2CH2 CONH CH2COOH + H2O;
пептидная группа
дипептид ɑ- аминоуксусной кислоты
Многоатомные спирты, их строение свойства и применение.
Ответ. Многоатомные спирты – органические соединения, содержащие несколько гидроксильных групп, соединенных углеводородным радикалом.
CH2(OH) – CH2(OH) – этандиол-1,2, или этиленгликоль (двухатомный спирт),
CH2(OH)–CH(OH)–CH2(OH) – пропантриол-1,2,3, или пропиленгликоль, или глицерин (трехатомный спирт).
Физические свойства
Вязкие, сиропоподобные жидкости, без цвета и запаха, сладковатого вкуса, хорошо растворимые в воде. Температура кипения этиленгликоля – 197,6 ̊С, глицерина – 290 ̊С. Этиленгликоль – яд!
Химические свойства
1. Взаимодействие со щелочными металлами:
CH2(OH)CH2(OH) + 2Na = CH2(ONa)CH2(ONa) + H2↑.
2. Взаимодействие с галогеноводородами:
CH2(OH)CH2(OH) + 2HCl = CH2ClCH2Cl + 2H2O.
дихлорэтан
3. Нитрование:
CH2(OH)CH(OH)СH2(OH) + 3HNO3 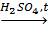 CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O . нитроглицерин
CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O . нитроглицерин
4. Качественная реакция на глицерин:
2CH2 (OH)CH(OH)CH2(OH) + Cu(OH)2
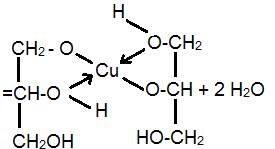
глицерат меди(II)
(раствор ярко-синего цвета)
Получение
1. 3С2H4 + 2KMnO4 + 4H2O = 3CH2(OH)CH2(OH) + 2MnO2 + 2KOH.
2. CH2ClCH2Cl + 2NaOH = CH2(OH)CH2(OH) + 2NaCl.
3. 2C2H4 + O2 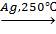 2H2C – CH2,
2H2C – CH2,
\ /
O
этиленоксид
H2C – CH2 + H2O = CH2(OH)CH2(OH)
\ /
O
4. CH3CHCH2 + O2 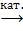 CH2CHCHO + H2O,
CH2CHCHO + H2O,
акролен
CH2CHCHO + H2 = CH2CHCH2OH,
аллиловый спирт
CH2CHCH2OH + H2O2 = CH2(OH)CH(OH)CH2(OH).
Применение
1. В производстве антифризов (веществ, понижающих температуру замерзания растворов).
Дата: 2019-05-28, просмотров: 344.