Вирус SV40 (англ. Macaca mulatta polyomavirus 1, ранее Simian virus 40) — вид полиомавирусов, обнаруженный в клетках обезьян, из рода Betapolyomavirus, является типовым видом рода. Как и у других полиомавирусов, геном SV40 представлен кольцевой двуцепочечной ДНК.
Вирус SV40 имеет икосаэдрический вирион, содержащий геномную ДНК длиной около 5000 пар оснований. Вирион прикрепляется к рецепторам MHC класса 1 на поверхности клетки при помощи гликопротеина VP1. Внутри ядра клетки клеточная РНК-полимераза II экспрессирует ранние гены. Транскрибированная мРНК подвергается разрезанию на два фрагмента, кодирующие большой и малый Т-антигены. Около 5 % большого Т-антигена поступает в плазматическую мембрану клетки, а около 95 % поступает в ядро. В большой Т-антиген связывается с тремя сайтами в вирусной ДНК, связывание с сайтом I и II регулирует синтез ранних РНК, связывание со вторым сайтом происходит в каждом клеточном цикле II. Связывание с сайтом I вызывает репликацию ДНК в месте ориджина репликации. Сборка вирионов осуществляется в ядре клетки.
SV 40 – обезьяний вирус – содержит 2-нитевую ДНК размером 5 тыс. пар оснований. Он может с различным результатом размещаться в клетках макак резус и в клетках грызунов. При заражении обезьян данный вирус проходит литический цикл развития, т. е., после проникновения в цитоплазму клетки, происходит раздваивание вируса. ДНК попадает в ядро клетки, где начинается транскрипция ранних, а затем и поздних генов.
Ранние гены обеспечивают образование вирусных НК и обозначаются как T, t-антиген.
Поздние гены – обеспечивают образование 3 белков вирусного капсида VP 1, VP 2, VP 3.
В результате происходит образование зрелых вирусных частиц, ч/з 30 мин – лизис инфицированной клетки. Клетки, в которых происходит литический цикл развития – клетки пермиссивные.
Если SV 40 попадает в организм грызуна, он встраивается в одну из хромосом и развивается. Наблюдается неупластическая трансформация – непермиссивные. Необходимо наличие точки начала репликации, наличие регуляторной последовательности, для начала транскрипции и-РНК. Суммарные размеры рекомбинантной ДНК не должны быть более 5 тыс. пар оснований. Либо в составе рекомбинантной ДНК, либо в составе генома клетки д. б. гены, которые обеспечивают образование белков малого и большого антигена, а также белков вирусного капсида.
В настоящее время существует 3 вектора на основе SV 40.
1. Векторы трансдуцирующие – рекомбинантные ДНК вводятся в пермиссивные клетки, которые образуют вирусные частицы.
2. Векторы плазмидные - рекомбинантные ДНК вводятся в непермиссивные клетки, в которые она за определенное время либо встраивается, либо наследуется как плазмида.
3. Векторы пассивные (трансформирующие векторы) – служат для введения ДНК в клетки, обеспечивая ее встраивание в хромосому, но сам вектор в клетке не наследуется.
С учетом этих подходов можно использовать 2 приема для введения рекомбинационной ДНК в клетку. В составе вирусной ДНК на чужеродном фрагменте можно заменить либо ранние области генома, либо поздние. В случае, если идет замещение поздней области генома, необходимо использовать вирусы-помощники, прошедшие постртрасвекции или заражение 2 типовыми вирусными частицами, которые различаются дефектам в ранней или поздней области гена. Образуется потомство с частицами без рекомбинантных ДНК и с частицами вируса-помощника.
Замещение ранней области генома – используются специальные клеточные линии (cos линии клеток) в которой содержатся гены связанные с образованием малого и большого Т-антигена и при попадании в такие клетки рекомбинантных ДНК инициируется репликация такой ДНК, синтезируются белки вирусной оболочки и образуются вирусные частицы, все из которых содержат рекомбинационные ДНК.
Из-за насыщенности генетической структуры вируса SV40 лишь в ограниченном числе мест на его ДНК могут происходить незначительные перестройки типа вставок или делеций без потери жизнеспособности вируса. При встройке в ДНК данного вируса чужеродного фрагмента по любому из уникальных мест гидролиза рестриктазами будет происходить нарушение той или иной функции (см. рис. 14.1), т. е. гибридные вирусы SV40 будут дефектны. Чтобы гибридная ДНК могла упаковаться в вирусный капсид, ее размер должен составлять 70-100 % генома вируса. Поэтому для получения гибридного вирусного потомства необходимо чужеродный фрагмент ДНК встраивать в молекулу вирусной ДНК, у которой предварительно с помощью рестриктаз делетирован определенный район. Такие векторы являются векторами замещения. Обязательное условие при конструировании гибридных вирусов — сохранение неповрежденной области начала репликации вирусной ДНК. Нарушенные при встройке в векторную ДНК другие вирусные функции необходимо комплементировать с помощью ви- руса-помощника. Молекулярные векторы данного типа на основе ДНК вируса SV40 называют литическими векторами.
В большей части выполненных исследований гибридные вирусы SV40 получены замещением участка ДНК из области поздних генов вируса фрагментом чужеродной ДНК. Гибриды данного типа содержат полностью область ранних генов и репликатор вируса SV40 и могут размножаться в виде вирусных частиц при совместной инфекции пермиссивных клеток с вирусом-помощником дикого типа или термочувствительным мутантом по ранним генам (обычно tsA).
Для встройки фрагментов ДНК в область поздних генов вируса SV40 можно использовать рестриктазы Нра\\, ЕсоШ, ВатШ, НаеII, Accl, Kpnl, имеющие уникальные места гидролиза на вирусной ДНК, а также Hhal, имеющую два участка гидролиза (см. рис. 14.1). При использовании других рестриктаз обычно проводят неполный гидролиз вирусной ДНК, продукты гидролиза разделяют электрофорезом и векторный фрагмент ДНК SV40 выделяют из геля.
49. Организация РНК-содержащих онкогенных вирусов (ретровирусов). Провирусная ДНК, экспрессия, длинные концевые повторы (LTR).
К РНК-содержащим вирусам относятся многие вирусы растений, возбудители заболеваний человека и животных: вирус полиомиелита, вирусы гриппа А, В и С, вирусы паротита (свинки), кори, чумы плотоядных животных (чумки), бешенства, вирус иммунодефицита человека (ВИЧ). Многие РНК-содержащие вирусы вызывают ОРВИ (например, коронавирусы), желудочно-кишечные заболевания (реовирусы птиц, млекопитающих и человека).Вирионы РНК-содержащих вирусов содержат РНК. После проникновения в клетку вирусная РНК становится матрицей для синтеза ДНК и РНК.
Вирионы ретровирусов представляют собой округлые частицы, обладающиетрехслойной структурой. Центральная часть вириона представлена нуклеопротеиновым комплексом, который включает молекул ревертазы . Эта структура окружена капсидом-белковой оболочкой.Геном ретровирусов уникален в следующих отношениях: 1) является единственным диплоидным; 2) вирусная РНК синтезируется и изменяется с помощью механизма, изменяющего клеточную мРНК; 3) это единственный геном, связанный со специфическим переносом функции РНК целиком к первичной репликации; 4) это единственный геном, кодирующий обратную транскриптазу, которая сама по себе уникальна.
В сердцевине содержатся две идентичные молекулы одноцепочечной РНК (то есть геном ретровирусов диплоидный) длиной 8000-10000 нуклеотидов каждая, тРНК , а также некоторые белки, например обратная транскриптаза и интеграза . Концы вирусной РНК модифицированы как у мРНК : на 5'-конце находится 7-метилгуанозин, необходимый для инициации трансляции , на З'-конце - полиадениловая последовательность, которая определяет стабильность мРНК (чем короче полиадениловая последовательность, тем быстрее происходит распад матрицы).
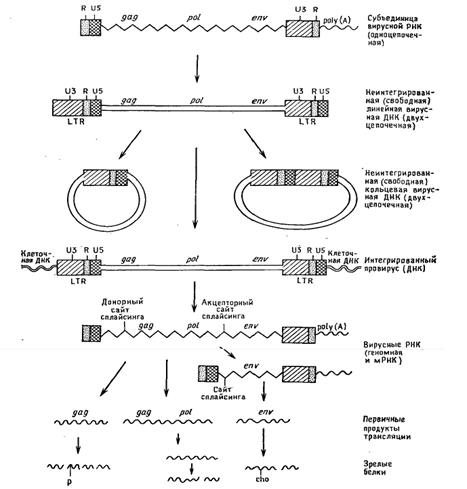
Ретровирусная РНК участвует не в синтезе белка, а транскрибируется с образованием ДНК. ДНК-форму ретровирусного генома называют провирусом. После проникновения в клетку вирусу, чтобы жить и развиваться, необходимо свою генетическуюинформацию, записанную в форме полимерной молекулы РНК, превратить в ДНКовую форму . Для этого клетка синтезирует белок-фермент, закодированный в вирусном геноме, под названием обратная транскриптаза . Этот фермент осуществляет образование на РНК однонитевой ДНК-копии. Затем с помощью того же фермента достраивается вторая нить ДНК. Новосинтезированная двунитевая ДНК-копия вируса получило название провируса. ДНК провируса имеет размер около 10 тыс. пар нуклеотидов и окружена с обеих сторон одинаковыми последовательностями нуклеотидов, называемыми длинными концевыми повторами- LTR, размером по 600-700 п.н. каждый . В этих длинных концевых повторах содержатся все необходимые для регуляции работы генов элементы, которые управляют работой вирусных генов в новом для них месте.
LTR, long terminal repeats. Последовательности LTR включают в себя последовательности STR. Возникновение LTR очень важно для экспрессии вирусных генов. Они содержат вирусные регуляторные транскрипционные элементы: промотор, энхансер, и другие. Например, некоторые вирусы содержат элементы, определяющие зависимость вирусной транскрипции от наличия определённых гормонов. LTR и являются теми регуляторными сигналами, которые вирус использует для эксплуатации клеточной транскрипционной машины в своих целях.
Продуктом транскрипции является полноразмерная вирусная РНК. Она должна транслироваться. И здесь вирусу необходимо решить такую проблему: нужно синтезировать много белков, а РНК одна. И в клетках эукариот РНК моноцистронны, то есть предназначены для синтеза только одного белка. Синтез белка в большинстве случаев начинается с ближайшего к кэп-сайту инициирующего кодона[4].
Если просмотреть открытую рамку считывания от этого ближайшего инициирующего кодона, то мы увидим, что если бы вирус пользовался традиционными способами экспрессии, то он смог бы синтезировать только полипептид GAG. А дальше идёт стоп- кодон. Как быть с POL и ENV? Кроме того, эти полипептиды очень длинны, а в вирусе содержатся гораздо более короткие. Проблема решается несколькими способами.
ü Во-первых, с помощью сплайсинга эта одна РНК превращается в нашем упрощённом варианте ещё в одну, более короткую. При этом последовательности, кодирующие ENV полипептид, оказываются рядом с инициирующим кодоном, ближайшим к кэп-сайту, и начинают транслироваться.
ü Во-вторых, разными для разных ретровирусов способами они ухитряются обойти стоп-кодон после открытой рамки считывания GAG и синтезировать сплавленный полипетид GAG-POL, который содержит последовательности обеих групп белков.
ü В-третьих, полученные длинные полипептиды подвергаются процессингу и разрезаются на множество белков, которые и функционируют либо в роли регуляторных, как, например, обратная транскриптаза, либо в роли структурных, как, например, белки оболочки зрелых вирусов.
Иными словами, ретровирусы используют гибкую тоталитарную систему для весьма тонкой регуляции синтеза большого разнообразия белков под контролем одного промотора.
Ретровирусы могут применяться в качестве векторов, например, в генотерапии. Механизм проникновения внутрь клеток при помощи слияния мембран. У них есть ряд преимуществ: широкий круг хозяев, стабильность в интегрированном в геном хозяина состоянии. Недостатки: сложно добиться высокого титра, заражает только делящиеся клетки.
Дата: 2019-05-28, просмотров: 1011.