Опишите структурные особенности ДНК как основного носителя генетической информации. Укажите особенности РНК как важнейших молекул в реализации генетической информации. Каталитические свойства РНК (рибозимы).
Молекула ДНК – это двухцепочечная спираль, закрученная вокруг собственной оси.
В полинуклеотидной цепочке соседние нуклеотиды связаны между собой ковалентными связями, которые образуются между фосфатной группой одного нуклеотида и З’-спиртовой группой пентозы другого. Такие связи называются фосфодиэфирными. Фосфатная группа образует мостик между З’-углеродом одного пентозного цикла и 5’-углеродом следующего.
Остов цепей ДНК образован, таким образом, сахарофосфатными остатками.
Полинуклеотидная цепь ДНК закручена в виде спирали, напоминая винтовую лестницу и соединена с другой, комплементарной ей цепью с помощью водородных связей, образующихся между аденином и тимином (две связи), а также гуанином и цитозином (три связи). Нуклеотиды А и Т, Г и Ц называются комплементарными. В результате у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гуаниловых — числу цитидиловых. Эта закономерность получила название «правило Чаргаффа». Благодаря этому свойству последовательность нуклеотидов в одной цепи определяет их последовательность в другой. Такая способность к избирательному соединению нуклеотидов называется комплементарностъю, и это свойство лежит в основе образования новых молекул ДНК на базе исходной молекулы.
Цепи в молекуле ДНК противоположно направлены, т. е., если одна цепь имеет направление от З’-конца к 5’-концу, то в другой цепи З’-концу соответствует 5’-конец и наоборот. Это свойство биспирали ДНК называется антипараллельностью.
Впервые двухцепочечная модель молекулы ДНК была предложена в 1953 г. американским ученым Дж. Уотсоном и англичанином Ф. Криком. Он объединил данные Э. Чаргаффа о соотношении пуриновых и пиримидиновых оснований молекул ДНК и результаты рентгеноструктурного анализа, полученные М. Уилкинсом и Р. Франклин. За разработку двухспиральной модели молекулы ДНК Уотсон, Крик и Уилкинс были удостоены в 1962 г. Нобелевской премии. Диаметр молекулы ДНК – 2 нм, шаг спирали – 3,4 нм; каждый виток спирали содержит 10 пар нуклеотидов. Спиральная структура поддерживается многочисленными водородными связями, возникающими между комплементарными азотистыми основаниями, и гидрофобными взаимодействиями. Молекулы ДНК эукариотических организмов линейны. У прокариот ДНК, напротив, замкнута в кольцо и не имеет ни 3’-, ни 5’-концов.
Рибонуклеиновая кислота (РНК) — линейный полимер, состоящий из одной цепочки нуклеотидов. Мономеры РНК состоят из пятиуглеродного сахара — рибозы, остатка фосфорной кислоты и азотистого основания. Три азотистых основания в молекулах РНК такие же как и у ДНК — аденин, гуанин, цитозин, а четвертым является урацил. Образование полимера РНК происходит (также, как и у ДНК) через ковалентные связи между рибозой и остатком фосфорной кислоты соседних нуклеотидов. Функции РНК различаются в зависимости от вида рибонуклеиновый кислоты. Нуклеотиды РНК состоят из сахара - рибозы, к которой в положении 1 'присоединена одна из основ: аденин, гуанин, цитозин или урацил. Фосфатная группа объединяет рибозы в цепочку, образуя связи с 3 'атомом углерода одной рибозы и в 5' положении другого. Фосфатные группы при физиологическом рН отрицательно заряжены, поэтому РНК - можно назвать полианионом. РНК транскрибируется как полимер четырех оснований (аденина (A), гуанина (G), урацила (U) и цитозина (C)), но в «зрелой» РНК есть много модифицированных оснований и сахаров. Всего в РНК насчитывается около 100 различных видов модифицированных нуклеозидов, из которых:
- 2'-О-метилрибоза наиболее частая модификация сахара;
- Псевдоуридин - наиболее часто модифицированная основа, которая встречается чаще всего. В псевдоуридине (Ψ) связь между урацилом и рибозой не C - N, а C - C, этот нуклеотид встречается в разных положениях в молекулах РНК. В частности, псевдоуридин важен для функционирования тРНК. Важная структурная особенность РНК, отличающая ее от ДНК - наличие гидроксильной группы в 2 'положении рибозы, которая позволяет молекуле РНК существовать в А, а не В-конформации, которая наиболее часто наблюдается в ДНК. В А-форме глубокая и узкая большая бороздка и неглубокая и широкая малая бороздка. Второе последствие наличия 2 'гидроксильной группы состоит в том, что конформационно пластичные, то есть, не принимающие участие в образовании двойной спирали, участки молекулы РНК могут химически атаковать другие фосфатные связи и их расщеплять.
Рибозим (сокращение от «рибонуклеиновая кислота» и «энзим»), также называемая ферментативной РНКили каталитической РНК это молекула РНК, обладающая каталитическим действие. Многие рибозимы естественного происхождения катализируют расщепление самих себя или
других молекул РНК, кроме тогообразование пептидной связи в белках происходит при помощи рРНК рибосомы. В рамках исследований, посвященных происхождению жизни, удалось создать искусственные рибозимы типа РНКполимеразы, способные при определенных условиях катализировать свою собственную сборку. Лабораторные образцы, однако, показали невысокую каталитическую способность: они успевают собрать в цепочку не более 14нуклеотидов за 24 часа, по истечении которых они разлагаются за счет гидролиза фосфодиэфирных связей. Несмотря на то, что большинство рибозимов достаточно редко встречаются в клетках, иногда они очень важны для их существования. Например, активная часть рибосомы — молекулярной машины, осуществляющей трансляцию белков из РНК — является рибозимом.В качестве кофакторов некоторые рибозимы часто содержат двухвалентные ионы металлов, например, Mg2+.То обстоятельство, что РНК может содержать наследственную информацию, позволило Уолтеру Гилберту выдвинуть предположение, что в древности РНК использовалась как в качестве генетического материала, так и в качестве катализаторов и структурных компонентов клетки, а впоследствии эти роли были перераспределены между ДНК и белками. Эта гипотеза сейчас известна как Гипотеза мира РНК.
Если РНК были первыми молекулярными машинами, использовавшимися в ранних живых клетках, то рибозимы, существующие сегодня (например, аппарат рибосомы), могут считаться живыми ископаемыми — образцами живых существ, состоящих из нуклеиновых кислот. Недавние исследования сворачивания прионов показывают, что РНК может катализировать сворачивание белка в патологические конфигурации подобно ферментам-шаперона.
Транскрипция
В результате транскрипции происходит синтез цепи РНК, нуклеотидная последовательность которой комплементарна одной из цепей ДНК; при этом генетическая информация, содержащаяся в ДНК, передается молекуле РНК. В результате транскрипции образуются три класса РНК: иРНК, тРНК, рРНК. Поскольку в основе транскрипции лежит принцип комплементарности, этот процесс имеет определенное сходство с репликацией. Однако между ними существует и важное различие. Если в процессе репликации копируется вся молекула ДНК, то при транскрипции транскрибируется только ее незначительная часть. Катализирует синтез РНК фермент РНК-полимераза. Транскрибируемый участок ДНК ограничен со стороны 3’-конца промотором,– участком с которым связывается РНК-полимераза, со стороны 5’-конца – терминатором – участком, в котором прерывается синтез РНК. Последовательность ДНК, ограниченная промотором и терминатором, представляет собой единицу транскрипции – транскриптон (рис. 46).
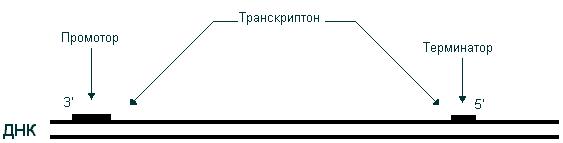
Рис. 46. Транскриптон
РНК-полимераза в качестве субстратов для синтеза РНК использует рибонуклеозид-5’-фосфаты (АТФ, ГТФ, ЦТФ и УТФ). Она удлиняет цепь, присоединяя нуклеотиды к 3’-концу, т.е. так же, как и ДНК-полимераза, наращивает цепь в направлении5’®3’. Этот фермент требует для своей работы в качестве матрицы одну из цепей ДНК. Из двух цепей ДНК транскрибируется только одна. В отличие от ДНК-полимеразы, РНК-полимераза не нуждается в затравке. Удлинение цепи РНК описывается уравнением:

Нуклеотиды присоединяются к цепи в соответствии с принципом комплементарности. Напротив аденина матричной цепи ДНК в растущую цепь РНК всегда будет встроен урацил, напротив гуанина – цитозин, напротив тимина – аденин и напротив цитозина – гуанин соответственно. Т.о., образовавшаяся в результате транскрипции РНК комплементарна матричной цепи ДНК (рис. 47).
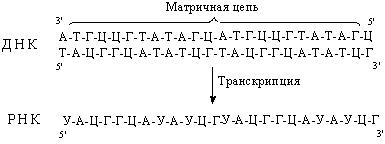
Рис. 47. Образовавшаяся в результате транскрипции РНК комплементарна матричной цепи ДНК
В процессе транскрипции выделяют три стадии: инициацию, элонгацию и терминацию. На стадии инициации РНК-полимераза, взаимодействуя с промотором, вызывает расхождение цепей ДНК и начинает синтез молекулы РНК. В ходе элонгации новосинтезированная цепь РНК образует (за счет спаривания ее оснований с основаниями матричной цепи ДНК) короткие отрезки гибридной двойной спирали ДНК – РНК, которые необходимы для правильного считывания цепи ДНК. Как только РНК-полимераза достигнет терминирующих последовательностей, запускается последняя стадия – терминация. По ее завершении происходит освобождение вновь синтезированной цепи РНК (рис. 48).
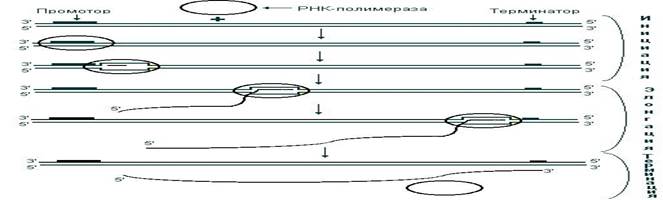
Рис. 48. Стадии транскрипции
Синтезированные молекулы РНК могут подвергаться посттранскрипционным ковалентным модификациям, так называемому процессингу (созреванию).
В большинстве случаев первичные транскрипты, образующиеся вышеписанным способом, не являются зрелыми молекулами РНК, а требуют процесса созревания, который называется процессингом РНК. У прокариот первичные транскрипты, сформированные при транскрипции генов, кодирующих белки, функционируют в качестве мРНК без последующей модификации или процессинга. Более того, трансляция мРНК часто начинается даже до завершения синтеза 3ʹ-конца транскрипта. Совсем иная ситуация наблюдается для молекул прокариотических рРНК и тРНК. В этом случае кластеры рРНК- или т-РНК-генов часто транскрибируются с образованием единой цепи РНК. Для формирования зрелых функциональных форм необходимо специфическое разрезание первичных РНК-транскриптов и их модификация. Эти молекулярные события и называются процессингом РНК (или посттранскрипционной модификацией).
РНК-полимераза I
РНК-полимераза I эу кариот является большим ферментом, состоящим не менее чем. из 11 субъединиц, и транскрибиру ющим генырРНК. Гены рРНК представлены в геноме клетки большим числомкопий и кодируют три наиболее кру пных рРНК - 18S, 5.8 Sи 28S.Гены рРНК расположены в виде серии тандемных повторов,отделенных друт от друга спейсером (рис. 4.7). В конце спейсера находится сайт терминации (Т), он же отвечает и за реиннциацию синтеза нового транскрипта. После освобождения транскрипта в сайтетерминации РНК-полимераза I остается связанной с ДНК, и затемпри у частии белкового фактора начинает синтез нового транскрипта.В спейсере имеются энхансеры (40 - 60 п.н.), активирующие транскрипцию в десятки раз. Степень активации пропорциональна числуэнхансеров.
Рибосомные гены транскрибируются в ядрышках ввиде единого 45S-PHKтранскрипта (13000 ну клеотидов). После синтеза 45S-PHK расщепляется с образованием 28S-PHK(окало 5000нуклеотидов), 18S-PHK (около 2000 нуклеотидов) и 5.8S-PHK(около160 нуклеотидов).Транскрипция генов рРНК соответствует 50 - 70 % от общегообъема клеточной транскрипции.У человека гаплоидные клетки содержат окало 200 геновpPНK, которые распределены в виде небольших кластеров по пятихромосомам.5SрРНК кодируется другими генами и транскрибируется РНК-полимеразой III.
РНК-полимераза II
РНК-полимераза II ответственна за синтез иРНК и состоит изболее, чем 10 субъединиц. Тем не менее, она не в состоянии самостоятельно осуществлять транскрипцию. Для ее работы требуетсядополнительно десятки белковых молекул, так называемых факторовтранскрипции.
В узнаваемом РНК-полимеразой II промоторе в пределах 100-200 п.н. перед стартом транскрипции обнаружены каноническиенуклеотидные последовательности: TATA, СААТ, GС -блоки и др.(рис. 4.8). В различных промоторах могут присутствовать разныеблоки, расположенные в различном порядке относительно друг другаи на разных расстояниях от точки начала транскрипции. Неодинаковая структура промоторов обуславливает различия в экспрессии генов.
Точка начала
транскрипции

Рис. 4.8. Условная схема расположения нуклеотидных последовательностей в промоторах для РНК-полимеразы II
Особую роль в регуляции скорости транскрипции играют полинуклеотидные последовательности - энхансеры и сайленсеры. Сэнхансерами взаимодействуют белки-активаторы, которые, контактируя с РНК-полимеразой, активируют ее. в результате транскрипциягенов усиливается . С сайленсерами же взаимодействуютбелки-ингибиторы, оказывающие тормозящие действие на активность РНК-полимеразы и снижающие. Энхансеры могут занимать различное положение относительногена. Чаще они располагаются перед геном за несколько сот и дажеза несколько тысяч п.н. В то же время энхансеры обнаружены в нитронах. Иногда они находятся за геном. Свойствами энхансера могутобладать икодирующие последовательности. В некоторых случаяхинтенсивность транскрипции гена может контролироваться несколькими энхаисерами. Граница энхансера бывает размыта – удалениенуклеотидных последовательностей постепенно снижает его активность. Однако энхансеры могут содержать блоки, мутации в которыхрезко снижают их активность. Энхансеры можно переносить от одного гена к другому.Энхансеры в зависимости от регуляторного фактора могут вести себя как сайленсеры.Организация сайленсеров имеют много общего с организациейэнхансеров.
РНК-полимеразы III
РНК-полимераза III транскрибирует гены 5SрРНК, тРПК и нескольких мяРНК. Эти три класса генов используют свои собственныеклассы промоторов. Промоторы, узнаваемые РНК-полимеразой III,находится внутри генов тРНК и 5SрРНК. В случае генов тРНК промоторы состоят из двух блоков: 1-й блок начинается через 8-30 п.н.после точки начала транскрипции и представлен в усредненном видепоследовательностью TGGCNNAGTGG, 2-й блок находится на расстоянии +51...+72 и его усредненная последовательность -GGTTCGANNCC (N- любой нуклеотид).Что касается генов, кодирующих мяРНК, то их промоторы расположены перед точкой начала транскрипции. У большинства геновэтого класса промоторы состоят из ТАТА-блока с центром в положении -30 и из второго блока с центром в положении -60.
Транскрипция генов класса I. К генам класса I относятся гены рРНК. У большинства эукариот в состав рибосом входят 18S рРНК, 28S рРНК, 5,8S рРНК, 5S рРНК. Все эти рРНК, кроме 5S рРНК транскрибируются РНК-полимеразой I. Число генов, кодирующих рРНК, колеблется от сотен до нескольких тысяч в зависимости от вида эукариот. На долю генов класса I приходится половина общей транскрипционной активности в большинстве клеток эукариот. Гены рРНК находятся в одной или нескольких хромосомах (у человека около 200 генов рРНК, расположенных в 13, 14, 15, 21 и 22 хромосомах). В этих хромосомах расположены области с характерной морфологией, названные ядрышковыми организаторами, в которых и располагаются гены рРНК. Гены рРНК практически всех эукариот построены в виде длинных повторов типа «голова к хвосту». Как правило, кодирующие области генов 18S, 5,8S, и 28S рРНК сгруппированы в указанном порядке в одну транскрипционную единицу (кластер). Каждый кластер имеет длину от 7 до 14 т.н.п. (в зависимости от вида) и отделен от других кластеров межгенным спейсером, длина которого у разных видов значительно различается, но в пределах одного вида относительно постоянна. Единица трнскрипции начинается от области межгенного спейсера на 5׳-конце и заканчивается в разных сайтах межгенного спейсера за областью, кодирующей 28S рРНК. Кодирующие области генов рРНК у разных видов являются консервативными, а длина и нуклеотидные последовательности межгенных спейсеров сильно различаются от вида к виду. После завершения транскрипции происходит созревание про-рРНК (процессинг). Для рРНК он заключается в нарезании первичного транскрипта эндонуклеазами, и вышеплении зрелых рРНК при участии мяРНК (они взаимодействуют с пограничными участками спейсерных последовательностей в молекуле – предшественнике рРНК). Кроме того, происходит сплайсинг интрона в последовательности 28S рРНК. Сигналы инициации транскрипции генов рРНК видоспецифичны (т.е. свои для каждого вида).. С этими последовательностями связываются соответствующие регуляторные белки, которые облегчают связывание РНК-полимеразы. Терминация транскрипции генов рРНК осуществляется в сайте, расположенном примерно на 200 н.п. (и более) левее последовательности 28S рРНК, находящейся на 3׳-конце кластера. Выявлены специфические последовательности, служащие сигналом к окончанию транскрипции. Они несколько отличаются у разных видов. У человека предположительно такая поледовательность выглядит следующим образом: 5׳-ГГГТТГАССА-3׳. Есть данные, что терминация в указанном сайте происходит при связывании белковых факторов транскрипции. Транскрипция генов класса III. Гены разных тРНК (в эукариотических клетках насчитывается 40 – 60 основных типов тРНК) также часто сгруппированы в кластеры, расположенные в разных хромосомах. У человека на гаплоидный геном приходится 1300 генов тРНК (по 10 – 20 копий для каждой тРНК). Характер организации генов тРНК в составе блоков сильно варьирует у разных организмов. Расположение генов тРНК в кластерах не столь регулярно, как в случае рибосомных генов: направление транскрипции близлежащих генов бывает противоположным, а гены могут быть разделены промежутками, включающими 100 – 150, а иногда и несколько тысяч нуклеотидных пар. Природа и функции участков ДНК, разделяющих гены тРНК, не выяснены. Промотор гена тРНК располагается внутри кодирующей последовательности и имеет два района (А- и В-боксы), необходимые для правильной и эффективной транскрипции. А-бокс локализован в области от +10 до +20 н.п., а В-бокс – между парами оснований +50 и +65. Канонические последовательности А- и В-боксов имеют вид: 5׳-ТГГЦNNАГТГГ-3׳ и 5׳-ГГТЦСГАNNЦ-3׳ (N – любой нуклеотид). Расстояние между А- и В-боксами составляет 50 н.п. В транскрипции генов тРНК участвуют факторы TFIIIA, TFIIIB, TFIIIC и т.д. В генах тРНК многих организмов имеется один интрон размером от 14 до 60 н.п. (в зависимости от вида тРНК). Он всегда локализуется в одном и том же месте у разных тРНК: через один нуклеотид от 3׳-конца антикодона. Единый транскрипт подвергается процессингу: нарезается эндонуклеазами и подравнивается экзонуклеазами. Интрон вышепляется при сплайсинге. Для терминации используются специальные последовательности на 3׳-конце, содержащие остатки тимина.
Опишите механизмы трансляции мРНК у прокариот. Основные этапы синтеза белков. Каким образом происходит выбор стартового AUG- кодона (SD-aSD) у прокариот? Рибозимная активности 23S рРНК.
Как и у эукариот, у прокариот выделяют три основных этапа трансляции: инициация, элонгация и терминация.
Инициация.
Инициация трансляции у прокариот обслуживается белковыми факторами инициации IF (от англ. initiation factors). У бактерий существуют три фактора: IF-1, IF-2, IF-3. IF-2 обладает ГТФазной активностью и играет важнейшую роль в связывании инициаторной аминоацил-тРНК (тРНК с присоединённой аминокислотой). Факторы IF-1 и IF-2 влияют на конформацию малой субъединицы, помогая ей связываться с тРНКfMet, переносящей формилметионин. Как правило, она связывается со старт-кодоном AUG, но иногда в роли старт-кодона выступает кодон CUG, кодирующий валин. Комплементарно спариваясь со старт-кодоном, тРНКfMet задаёт рамку считывания. Выбор старт-кодона осуществляется при связывании малой субъединицы с мРНК, причём инициаторная тРНКfMet связывается с малой субъединицей в комплексе с факторами инициации и ГТФ. Выбор стартового кодона у бактерий происходит с участием последовательности Шайна — Дальгарно — короткой последовательности длиной 5—8 нуклеотидов, обогащённой пуриновыми основаниями и комплементарно связывающейся с обогащённой пиримидинами областью 16S рРНК, входящей в состав малой субъединицы. Когда комплекс малой субъединицы с мРНК и тРНКfMet образовался, факторы IF-3 и IF-1 покидают его, уступая место большой субъединице, присоединение которой завершает сборку рибосомы прокариот. При присоединении большой субъединицы формируются Р- и А-сайты. Далее фактор IF-2 гидролизует ГТФ, и выделившаяся энергия расходуется на стабилизацию тРНКfMet в Р-сайте рибосомы.
У бактерий в элонгации ключевую роль играют особые белковые факторы — EF-Tu и EF-G. Сначала EF-Tu одновременно связывает ГТФ и молекулы аминоацил-тРНК. Этот фактор обеспечивает точность трансляции несколькими способами. Во-первых, когда EF-Tu препровождает до рибосомы аминоацил-тРНК, он проверяет соответствие тРНК и несомой аминокислоты. Во-вторых, он отслеживает первичное взаимодействие между антикодоном подходящей аминоацил-тРНК и кодоном мРНК в А-сайте. Когда аминоацил-тРНК находится в комплексе с EF-Tu, связанным с ГТФ, то она изогнута так, что её антикодон может связаться с кодоном мРНК, но аминокислота не может быть включена в белковую цепь. Однако в случае правильного соответствия кодона и антикодона рибосома запускает быстрый гидролиз ГТФ, после которого EF-Tu отсоединяется от тРНК и рибосомы, так что аминокислота может быть включена в цепь. Проверка соответствия кодона и антикодона осуществляется самой рибосомой: рРНК обёртывается вокруг пары кодон—антикодон, и при её окончательном замыкании, которое имеет место только в случае правильного соответствия, происходит гидролиз ГТФ. Отделившийся EF-Tu, связанный с ГДФ, обменивает свой ГДФ на ГТФ при участии ещё одного фактора элонгации, EF-Ts, который катализирует отделение ГДФ от EF-Tu.
Вновь поступившая аминокислота, связанная с тРНК, оказывается в А-сайте рибосомы. В это время в Р-сайте рибосомы находится тРНК, к которой прикреплён синтезированный участок пептида (или инициаторная аминокислота). В Р-сайте рибосомы происходит пептидилтрансферазная реакция, при которой аминокислота из А-сайта присоединяется к пептиду. Таким образом, после этой реакции в Р-сайте оказывается пустая молекула тРНК, а в А-сайте находится тРНК, связанная с пептидом. После этого большая субъединица рибосомы смещается относительно малой на три нуклеотида, и пустая тРНК оказывается в Е-сайте, откуда она покидает рибосому и отправляется за следующей молекулой аминокислоты, а синтезированный пептид, связанный с тРНК, оказывается в Р-сайте; А-сайт же освобождается для новой аминоацил-тРНК. Смещение большой субъединицы (транслокация) требует гидролиза ГТФ, который осуществляет белок EF-G, связывающийся с опустевшим А-сайтом[4].
Первый на N-конце белка аминокислотный остаток формилметионина впоследствии отщепляется при участии аминопептидаз.
Терминация.
У бактерий в терминации трансляции принимают участие три белковых фактора: RF-1, RF-2 и RF-3, которые распознают стоп-кодоны в мРНК: RF-1 узнаёт кодоны UAG и UAA, а RF-2 распознаёт UAA и UGA. Фактор RF-3 выполняет вспомогательную работу. Трёхмерная структура RF-1 и RF-2 напоминает формой и распределением заряда тРНК и, таким образом, представляют собой пример молекулярной мимикрии. Когда в А-сайт рибосомы попадает стоп-кодон, с ней связывается соответствующий RF-фактор и тем самым блокирует присоединение аминоацил-тРНК. Кроме того, в клетках обычно нет тРНК, комплементарных стоп-кодонам. RF стимулируют пептидилэстеразную активность рибосомы, что приводит к гидролизу связи между С-концом новосинтезированного пептида и тРНК. В результате белок удаляется из рибосомы, и она сама диссоциирует на большую и малую субъединицу. Терминация трансляции происходит с участием ГТФ, который выступает в роли аллостерического регулятора активности RF.
мРНК бактерий обычно полицистронны, то есть содержат несколько старт- и стоп-кодонов. Хотя рибосома бактерий и распознаёт терминирующие кодоны, она может продолжить движение по мРНК и начать трансляцию следующей кодирующей области.
Опишите механизмы инициации трансляции мРНК и выбор стартового AUG- кодона в клетках эукариот (модель М. Козак и ее модификации). Укажите особенности процесса трансляции мРНК в клетках эукариот и прокариот.
Поскольку каждый кодон содержит три нуклеотида, один и тот же генетический текст можно прочитать тремя разными способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания. За некоторыми интересными исключениями, значимой является информация, закодированная только в одной рамке считывания. По этой причине крайне важным для синтеза белка рибосомой является её правильное позиционирование на стартовом АУГ-кодоне — инициация трансляции.
Инициация
Синтез белка в большинстве случаев начинается с АУГ-кодона, кодирующего метионин. Этот кодон обычно называют стартовым или инициаторным. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определённых нуклеотидных последовательностей в районе стартового кодона (последовательность Шайна — Дальгарно у прокариот и последовательность Козак у эукариот). Немаловажная роль в защите 5'-конца мРНК принадлежит 5'-кэпу. Существование последовательности, отличающей стартовый АУГ от внутренних совершенно необходимо, так как в противном случае инициация синтеза белка происходила бы хаотично на всех АУГ-кодонах.
Механизмы инициации трансляции у про- и эукариот существенно отличаются: прокариотические рибосомы потенциально способны находить стартовый АУГ и инициировать синтез на любых участках мРНК, в то время как эукариотические рибосомы обычно присоединяются к мРНК в области кэпа и сканируют её в поисках стартового кодона.
Трансляция у прокариот и эукариот.
В прокариотических клетках процесс трансляции сопряжен с синтезом мРНК: они происходят практически одновременно. В значительной степени это связано с недолговечностью бактериальной мРНК, которая достаточно быстро подвергается распаду.
Трансляция у прокариот начинается вскоре после образования 5'-конца мРНК, раньше, чем заканчивается ее синтез. В результате вслед за РНК-полимеразой по мРНК движутся рибосомы, осуществляющие сборку пептидных цепей. Через некоторое время после начала транскрипции (около 1 мин) и до завершения трансляции 3'-конца матрицы начинается деградация ее 5'-конца. Ввиду того что время жизни разных мРНК не одинаково, количество белка, синтезированного на разных матрицах, различно.
Соединение рибосомы с мРНК обусловлено комплементарным взаимодействием нуклеотидов одной из рРНК с нуклеотидной последовательностью лидера мРНК. У эукариот трансляция осуществляется в цитоплазме, куда попадает из ядра зрелая мРНК. Копированный конец мРНК распознается малой субчастицей рибосомы, затем лидирующая последовательность, содержащая до 100 нуклеотидов, взаимодействует с рРНК. Синтез белка в эукариотической клетке, осуществляемый на моноцистронной мРНК, завершается после прохождения рибосомой по всей мРНК, вплоть до узнавания ею кодона-терминатора, прекращающего образование пептидных связей.
Опишите основные механизмы регуляции работы генов и основные генетические элементы, регулирующие экспрессию генов прокариот (промотор, оператор, репрессор, индуктор, аттенюатор, оперон, рибопереключатели)
Гены функционируют в клетке не сами по себе, а входят в состав более сложной генной регуляторной системы. Количество структурных генов в разных оперонах различно. Участок ДНК, на на котором проходит считывание информации, называется единицей транскрипции (Рис. 27, 28). Он ограничен промотором (зона начала транскрипции) и терминатором (зона остановки транскрипции).
1. Промотор – это строго определенная нуклеотидная последовательность, которая узнается ферментом транскрипции – РНК – полимеразой.
У E. coli промотор – это пара нуклеотидных последовательностей из 6-7 и 9 нуклеотидов каждая, отдельных друг от друга 25 нуклеотидами.
Промотор выполняет следующие функции:
а) это место присоединения РНК – полимеразы к молекуле ДНК
б) последовательность оснований в промоторе определяет какая из цепей ДНК будет «смысловой», т.е. с какой цепи ДНК будет идти считывание информации (РНК – полимераза всегда двигается по цепи ДНК от 3' к 5' концу).
У про- и эукариот последовательности промоторов разные. Это учитывается в генной инженерии, в случае встраивания в геном бактерии генов человека.
Промоторы эукариот разнообразны по числу и строению элементов. Промотор эукариотического гена – это участок ДНК, на котором собираются белки транскрипции, узнающие свои сайты связывания и взаимодействующие друг с другом и с иРНК – полимеразой. В составе эукариотического гена имеются особые цис-действующие элементы регуляции - усилители или активаторы, глушители или угнетатели транскрипции. Они разнообразны по строению, положению и функциям. Они могут располагаться как на 5'- так и на3'- конце фрагмента ДНК, включающего ген, так и в составе интронов.
2. Оператор – это нетранскрибирумая последовательность нуклеотидов, участок связывания белка - репрессора. Он располагается в непосредственной близости к промотору или перекрывается с ним. У многих опероновимеется не один, а несколько сайтов связывания с регуляторными белками, которые не обязательно располагаются рядом, а могут находиться по разные стороны от промотора. Поэтому сейчас принято говорить о сайтах связывания регуляторов. Связывание белка – репрессора с оператором либо создает стерические (пространственные) затруднения для связывания РНК-полимеразы с промотором, либо препятствует продвижению ее по смысловой цепи ДНК, и определяет точку начала транскрипции. Следует отметить, что ни промотор, ни оператор в РНК не транскрибируются и зоны промотора и оператора могут перекрываться.
3. Терминатор – участок молекулы ДНК, где заканчивается процесс транскрипции.
Оператор и структурные гены образуют оперон. Именно так назвали эту структуру французские ученые Франсуа Жакоб и Жак Моно, которые первыми в 1959 -1961г. работая с бактериальными клетками предложили механизм регуляции работы гена или генной экспрессии. За эту работу в 1965г. они получили Нобелевскую премию. Как выяснили Жакоб и Моно работой оперона управляют гены – регуляторы. Они не входят в состав оперона, но являются необходимой частью регуляторной системы. Гены – регуляторы у прокариот находятся на той же хромосоме, что и оперон. У эукариот они могут располагаться далеко от промотора эукариотического гена и оказывать дистанционное влияние на его транскрипцию. Гены - регуляторы контролируют синтез белка – репрессорасвязывающегося с оператором. Синтез белков – репрессоров, как и всех белков, идет на рибосомах в цитоплазме. Транскрипция определяется белком-репрессором, который может закрывать оператор (репрессор активен) или открывать его (репрессор неактивен), т.е. возможны два варианта регуляции активности генов.
I. Ген – регулятор отвечает за синтез активного белка – репрессора. Белок – репрессор имеет два активных центра:
1. центр связывания с оператором
2. центр связывания с субстратом. Под субстратом (индуктором) понимают любое вещество, информация о синтезе или распаде которого закодирована в данном опероне или гене. Это могут быть гормоны, аминокислоты, углеводы, питательные вещества, яды и т.д.
Субстрата в клетке нет, поэтому активная форма белка – репрессора соединяется с оператором, т.е. оператор закрыт и через него не может пройти фермент РНК – полимераза, транскрипция не идет.
Открытие оператора идет с помощью субстрата (индуктора), поступающего в клетку. Индуктор взаимодействует с белком – репрессором, что приводит к изменению его конформации (пространственной структуры). У инактивированного белка репрессора резко снижается родство к зоне оператора и он отсоединяется от него. Оператор свободен и это позволяет РНК-полимеразе начать транскрипцию. Она продолжается до тех пор, пока в клетке есть субстрат, т.е. пока есть необходимость в продуктах данного оперона или гена.
При сокращении количества субстрата его уже не хватает на молекулы белка – репрессора и активный белок – репрессор присоединяется к оператору. Транскрипция прекращается. Следует отметить, что в клетке белок реперссор синтезируется постоянно и его количество строго определенное. Например, в клетке E. сoli находится около 10 молекул белка-репрессора, который регулирует работу лактозного оперона.
II. Ген – регулятор отвечает за синтез неактивной формы белка – репрессора, т.е. он не может присоединится к оператору. Оператор свободен иРНК – полимераза свободно проходит к структурным генам. Оперон будет работать до тех пор, пока есть необходимость в продуктах данного оперона.
Когда данный продукт клетке уже не нужен (он не расходуется в биохимических процессах и накапливается в клетке), субстрат взаимодействует с неактивным белком – репрессором, активирует его. Белок-репрессор закрывает оператор и выключает транскрипцию.
У эукариот регуляция белкового синтеза еще сложнее и осуществляется на многих этапах от ДНК к белку. Но рассмотренные механизмы регуляции работы генов имеют место и у эукариот. Ж. Моно сказал: «Что хорошо и правильно для бактерий с генетической точки зрения, то правильно и для слона»
Например, образование некоторых ферментов индуцируется присутствием их субстрата:
1. наличие в крови алкоголя индуцирует в клетках печени усиленный синтез фермента, разрушающего алкоголь – алкогольдегидрогеназы.
Регуляция функционирования белок-кодирующих генов эукариот. Генетические элементы, регулирующие их экспрессию. Основные этапы и механизмы процессинга пре-мРНК (кэпирование, метилирование, сплайсинг, полиаденилирование)
Процессинг м- РНК
Кэпирование представляет собой присоединение к 5'-концу транскрипта 7-метилгуанозина через необычный для РНК 5',5'-трифосфатный мостик, а также метилирование остатков рибозы двух первых нуклеотидов. Процесс кэпирования происходит во время синтеза молекулы пре-мРНК. Кэпирование защищает 5'-конец первичного транскрипта от действия рибонуклеаз, специфически разрезающих фосфодиэфирные связи в направлении 5’→3'.
Функции кэпа и связанных с ним белков:
· участие в сплайсинге;
· участие в процессинге 3'-конца мРНК;
· экспорт мРНК из ядра;
· защита 5'-конца транскрипта от экзонуклеаз;
· участие в инициации трансляции.
Полиаденилирование
Фермент поли(А)-полимераза присоединяет 3'-концу транскрипта от 100 до 200 остатков адениловой кислоты. Полиаденилирование осуществляется при наличии сигнальной последовательности 5'- AAUAAA-3' на 3'-конце транскрипта, за которой следует 5'-CA-3'. Вторая последовательность является сайтом разрезания.
Сплайсинг
После полиаденилирования мРНК подвергается сплайсингу, в ходе которого удаляются интроны (участки, которые не кодируют белки), а экзоны (участки, кодирующие белки) сшиваются и образуют единую молекул. Сплайсинг катализируется крупным нуклеопротеидным комплексом — сплайсосомой, состоящей из белков и малых ядерных РНК. Многие пре-мРНК могут быть подвергнуты сплайсингу разными путями, при этом образуются разные зрелые мРНК, кодирующие разные последовательности аминокислот (альтернативный сплайсинг).
Метилирование
мРНК эукариот подвергаются посттранскрипционному метилированию. То есть сметению (метилированию) наружу ингибиторного гена. Наиболее распространённой модификацией является метилирование остатков аденина по положению N6 с образованием N6-метиладенозина (m6A). Этот процесс метилируют ферменты N6-аденозинметилтрансферазы, которые распознают остатки аденина в консенсусных последовательностях GAC (70 % случаев) и AAC (30 % случаев). Соответствующие деметилазы ингибируют обратный процесс деметилирования. Учитывая обратимость и динамичность процесса метилирования мРНК, а также повышенную концентрацию m6A в длинных экзонах и вокруг стоп-кодонов, предполагают, что метилирование мРНК выполняет регуляторную функцию.
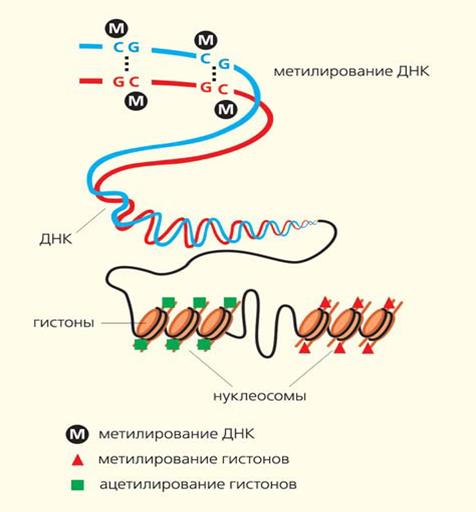
Метилирование ДНК
Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома. Метилирование ДНК заключается в присоединении метильной группы к цитозину в составе CpG-динуклеотида в позиции С5 цитозинового кольца. Метилирование ДНК происходит путем обратимой химической реакции азотистого основания — цитозина, в результате чего метильная группа СН3 присоединяется к углероду с образованием метилцитозина. Этот процесс катализируется ферментами ДНК-метилтрансферазами. Для метилирования цитозина необходим гуанин, в результате образуется два нуклеотида, разделенные фосфатом (СрG). Скопление неактивных последовательностей СрG называется островками СрG. Последние представлены в геноме неравномерно . Большинство из них выявляются в промоторах генов. Метилирование ДНК происходит в промоторах генов, в транскрибируемых участках, а также в межгенных пространствах.
Гиперметилированные островки вызывают инактивацию гена, что нарушает взаимодействие регуляторных белков с промоторами. Метилирование ДНК оказывает огромное влияние на экспрессию генов и, в конечном счете, на функцию клеток, тканей и организма в целом. Установлена прямая зависимость между высоким уровнем метилирования ДНК и количеством репрессированных генов.
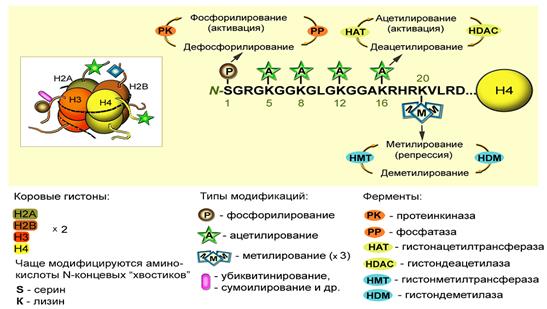
Ацетилирование гистонов
Существует большое число посттрансляционных модификаций гистонов, которые формируют хроматин. В 1960-е годы Винсент Олфри идентифицировал ацетилирование и фосфорилирование гистонов из многих эукариот. Ферменты ацетилирования и деацетилирования (ацетилтрансферазы) гистонов играют роль в ходе транскрипции. Эти ферменты катализируют ацетилирование локальных гистонов. Деацетилазы гистонов репрессируют транскрипцию. Эффект ацетилирования это ослабление связи между ДНК и гистонами из-за изменения заряда, в результате чего хроматин становится доступным для факторов транскрипции. Ацетилирование представляет собой присоединение химической ацетил-группы (аминокислоты лизин) на свободный участок гистона. Как и метилирование ДНК, ацетилирование лизина представляет собой эпигенетический механизм для изменения экспрессии генов, не влияющих на исходную последовательность генов. Шаблон, по которому происходят модификации ядерных белков, стали называть гистоновым кодом. Модификации гистонов играют фундаментальную роль в нормальных процессах и при заболеваниях.

Механизм ремоделирования хроматина
Опишите молекулярные и клеточные механизмы процессов РНК-интерференции (РНКи) в клетках эукариот. Использование РНКи для изменения активности генов и изучения функциональной роли кодируемых ими белков.
Принцип РНК-интерференции
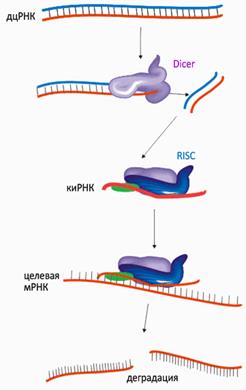 Сегодня изучение малых регуляторных РНК является одной из наиболее бурно развивающихся областей молекулярной биологии. Обнаружено, что все короткие РНК выполняют свои функции на основе явления, названного РНК-интерференцией (суть этого феномена заключается в подавлении экспрессии гена на стадии транскрипции или трансляции при активном участии малых молекул РНК). Очень схематично механизм РНК-интерференции показан на врезке «Основы РНК-интерференции».
Сегодня изучение малых регуляторных РНК является одной из наиболее бурно развивающихся областей молекулярной биологии. Обнаружено, что все короткие РНК выполняют свои функции на основе явления, названного РНК-интерференцией (суть этого феномена заключается в подавлении экспрессии гена на стадии транскрипции или трансляции при активном участии малых молекул РНК). Очень схематично механизм РНК-интерференции показан на врезке «Основы РНК-интерференции».
Двуцепочечные молекулы РНК (дцРНК) нехарактерны для нормальных клеток, но они являются обязательным этапом жизненного цикла многих вирусов . Специальный белок Dicer, обнаружив в клетке дцРНК, «режет» её на небольшие фрагменты. Антисмысловая цепь такого фрагмента, которую уже можно называть короткой интерферирующей РНК (киРНК, от siRNA — small interference RNA), связывается комплексом белков под названием RISC (RNA-induced silencing complex), центральный элемент которого — эндонуклеаза семейства Argonaute. Связывание с киРНК активирует RISC и запускает в клетке поиск молекул ДНК и РНК, комплементарных «шаблонной» киРНК. Судьба таких молекул — быть уничтоженными или инактивированными комплексом RISC. Подытоживая, короткие «обрезки» чужеродной (в том числе, введённой намеренно) двуцепочечной РНК служат «шаблоном» для широкомасштабного поиска и уничтожения комплементарных мРНК (а это эквивалентно подавлению экспрессии соответствующего гена), — причем, не только в одной клетке, но и в соседних. Для многих организмов — простейших, моллюсков, червей, насекомых, растений — этот феномен является одним из основных способов иммунной защиты против инфекций.
Вирус вторгается в бактериальную клетку; 2. Нуклеиновые кислоты вируса записываются в CRISPR участке; 3. Формирование CRISPR РНК; 4. CRISPR РНК прикрепляется к ферменту Cas9; 5. CRISPR РНК направляет фермент Cas9 к вирусу. Он разрезает и уничтожает вирусный геном.
Редактирование. Чтобы исправить «неправильный» ген, нам нужен очень точный молекулярный «скальпель», который найдет мутантную последовательность нуклеотидов и сможет «вырезать» ее из ДНК. Таким «скальпелем» и является Cas9. С помощью гида РНК, последовательность которой совпадает с искомым местом, он может внести разрыв в нужное место генома. Узнавание мишени происходит на участке длиной в 20–30 нуклеотидов. В среднем последовательности такой длины встречаются в геноме человека единожды, что позволяет обеспечить точность. Клетка не умрет от внесения разрыва в ДНК, так как он будет исправлен по здоровой копии из парной хромосомы за счет естественного процесса репарации ДНК. Если парной хромосомы нет, как в случае гемофилии, можно внести в клетку участок «правильного» гена одновременно с Cas9 и РНК-гидом и использовать его как матрицу для залечивания внесенного разрыва.
С помощью CRISPR/Cas9 можно делать мультиплексное редактирование сразу нескольких неправильных генов. Для этого достаточно ввести белок Cas9 и несколько разных РНК-гидов. Каждый из них направит Cas9 к собственной мишени, и вместе они устранят генетическую проблему.
В целом описанный механизм функционирует за счет принципа комплементарности, который впервые был предложен Джимом Уотсоном и Френсисом Криком в их знаменитой модели двуцепочечной ДНК. Цепочки двойной спирали ДНК «узнают» друг друга по правилам комплементарности. CRISPR РНК узнает свои мишени в двуцепочечной ДНК таким же образом, при этом образуется необычная структура, содержащая двуцепочечный участок взаимокомплементарных РНК и одной из цепей ДНК-мишени, а другая цепь ДНК оказывается «вытесненной».
Прастите.
Засовывая вектор в клетку, ученый может хотеть двух разных вещей:
1. чтобы происходила только транскрипция гена-вставки (то есть, синтез РНК на матрице ДНК — например, этого достаточно, если в клетку вносится какая-нибудь некодирующая РНК);
2. чтобы происходила и транскрипция, и трансляция гена-вставки (то есть, экспрессия кодируемого вставкой белка).
В первом случае вектор называется транскрипционным, во втором — экспрессионным. Экспрессионные векторы обычно немного сложнее транскрипционных, потому что в них присутствуют:
1. Консенсусная последовательность Козак. Это длинное имя носит короткий (примерно в 10 нуклеотидов) фрагмент в самом начале молекулы матричной РНК, который через белки-посредники обеспечивает связывание этой мРНК с рибосомой (без чего, как нетрудно догадаться, синтез белка невозможен). Последовательность Козак характерна только для эукариот, причем у представителей разных видов она немного отличается. Поэтому, создавая экспрессионный вектор, надо вставлять в него последовательность, которая характерна именно для того живого существа, в клетки которого мы собираемся вставлять вектор. Кроме того, последовательность Козак бывает сильной и слабой — то есть, приводящей к синтезу большого или малого количества белка. У прокариот роль последовательности Козак выполняет последовательность Шайна-Дальгарно, которая непосредственно (в смысле — без посредников, в отличие от последовательности Козак) соединяется с рибосомой, после чего и начинается синтез белка;
2. Последовательность Козак находится перед вставляемым геном. А после него должны находиться еще несколько коротких участков, к которым присоединяются белки, выполняющие полиаденилирование — пришивание к концу свежесинтезированной РНК полиаденинового хвоста. Этот хвост выполняет несколько функций, в том числе, обеспечивает экспорт РНК в цитоплазму и помогает организации трансляции — то есть, если мы хотим обеспечить синтез белка на основе нашей РНК, нам без него не обойтись;
3. мРНК, которая служит матрицей для синтеза белка, может быть транскрибирована только и исключительно РНК-полимеразой II типа. Поэтому нам нужно вставить в плазмиду именно тот промотор, который работает с этой РНК-полимеразой.
Создан еще один вид фагового вектора – фагмиды. Представляют собой фаговые векторы. Они созданы на основе плазмид, в которые встроен репликатор фагов содержащий 1 нить ДНК. И если такой плазмидой, содержащей репликатор фага, содержащего нитевидную ДНК, ввести в бактериальную клетку и одновременно заразить интактную фагом F1,то данная плазмида (фагмида) будет реплицироваться по типу фаговой репликации и включаться в белковую оболочку ,которая возникает за счет репродукции вот этого интактного фага ,фага помощника. И на ряду с образованием нормальных фаговых частиц F1 будут формироваться фаговые частицы содержащие однонитевую плазмидную ДНК. Таким образом фагмиды позволяют получать однонитевые ДНК содержащие сегмент чужДНК . Это удобно для создания так называемых меченных зондов. Но можно получить и в виде двунитевых молекул, тогда надо получить однонитевую молекулу из этих фагов in vitro,с помощью достройки комплемментарной 2-ой нити. Так что, фагмиды позволяют получать гибридные ДНК в виде однонитевой и двунитевой ДНК, но с использованием системы синтеза белка in vitro.
Векторы, совмещающие в себе элементы нитевидного фага и плазмиды. Впервые фагмиды созданы в 1981 г.
(a) При этом по EcoRI-участку плазмиды pBR322 был встроен фрагмент репликативной формы нитевидного фага f1 размером 1.3 т.п.н., который включает все элементы генома, необходимые для репликации и морфогенеза фага и получена фагмида pD4. При инфицировании культуры E. coli, содержащей pD4, неизмененным фагом f1, около половины секретируемых вирусных частиц несут одноцепочечную ДНК фагмиды. Вторая половина несет одноцепочечную ДНК фага f1.
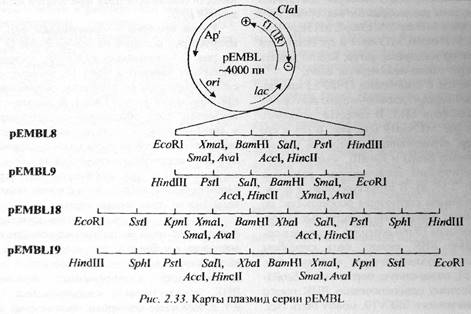
(б) Фрагмент генома фага f1 был перенесен в плазмиду pUC, не нарушая при этом ее генетических детерминант. Так была создана фагмида pEMBL. В зависимости от ориентации вcтроенного фрагмента чужДНК в фагмиде, секретируемые вирусные частицы впоследствии несут в своем капсиде либо +-, либо –-цепь фагмиды pEMBL.
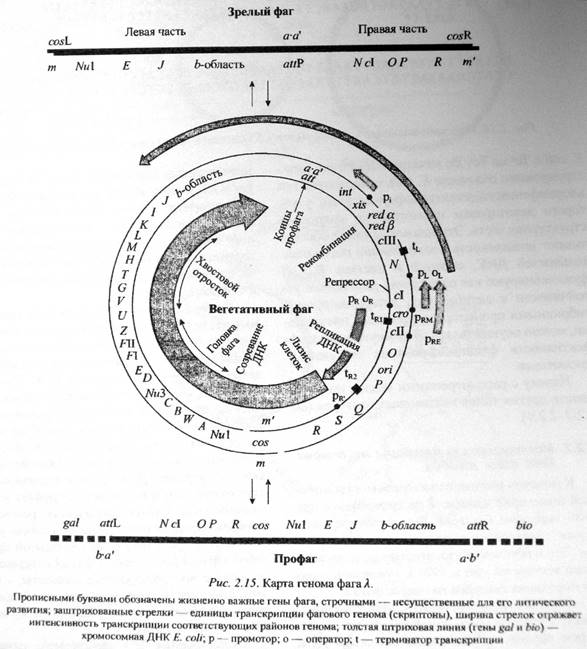
24. Альтернативные пути и этапы репликации бактериофага λ (лямбда). Литический цикл, лизогенный путь.
Репликация фага лямбда на стадии его внутреклеточной репродукции довольно сложный процесс начинается в одной точке, обычной оri- репликации и распространяется в 2-х противоположных направлениях.
Репликация с начала идет по типу тета-репликации, а на завершающих стадиях переходит на репликацию по типу катящегося кольца ибо формируются конкотемерные ДНК фага λ, которые могут возникать и другим способом, по скольку линейные молекулы геномные ДНК фага λ имеют липкие концы, комплементарные, то они могут соединяться друг с другом без участия рекомбинационной системы клетки формировать структурные геномные структуры типа конкотемеров.
Процесс созревания фаговых частиц у фага λ напоминает таковой у фага Т4: идет разобщенный синтез предшественников фагов, белковых и нуклеиновых компонентов, а затем на завершающей стадии в силу механической сборки формируются полноценные фаговые частицы и процесс репродукции завершается в некоторых случаях при одном типе репродукции- лизисом клетки, высвобождением фагового потомства во внешнюю среду, лизис осуществляется ферментом типа фагового лизоцима, который характеризуется высокой специфичностью и эффективностью и детерминируется продуктом гена R.
Молекула геномной ДНК фага λ нарезается на отдельные геномы по cos-сайтам ферментом терминазой и сам процесс нарезания именуется терминазной реакцией, которая обеспечивается ферментом продукта фагового гена А.
Схема: процесс обр-ния фаговых частиц. Конкотемерные ДНК фага λ режется по cos-сайтам ферментом терминазой с последующей упаковкой отрезанных геномов. И потом после заполнения пустотелой фаговой предголовки имеет место соединение с остальными белками фаговой частицы, с белками хвоста, с белками нити формируются полноценные вирионы фага λ.
Интересной особенностью процесса созревания у фага λ является необходимость присутствия ДНК в виде конкатемеров, если конкатемеры не образуются, то упаковка фаговых геномов не осуществляется и полноценные фаговые частицы не формируются. Если клетка заражается фагом λ в условиях препятствующих формированию кокнатемеров, ну различного рода моделирующие соответствующие условия, то созревание фаговых частиц не наступает.
Модель.
Здесь уместно остановится на терминазной реакции и на тех фактах, которые объясняют процесс упаковки фаговой ДНК фага λ в формирующуюся головку. Схема организации cos-сайтов и участия некоторых генов в процессе упаковки и структура, именуемая порталом фага λ, которыми соединяет головку с хвостовым отростком и участвует в упаковке ДНК.
Терминация детерминируется 2-мя генами: ген Nu1 и А. Первый ген детерминирует малую субъединицу терминазы, второй- большую. Ген В детерминирует структуру белка-портала, ген Q участвует в детерминации структур необходимых для процесса соединения головки с хвостом, детерминирует структуру акцепторных или дополнительных белков. Ген С представляет собой компонент капсида, вовлекаемый в образование коннектора-- структур соединяющий головку с хвостом.
Cos-сайт представляет собой тройственную структуру и состоит из cos-Q, cos-N и cos-B.– Cos-Q – последовательность необходимая для терминации процесса упаковки, cos-N – сайт, где осуществляется никирование конкотемерной ДНК в области кос-сайта, ступенчато-обратный разрез с образованием липких концов на окончаниях молекулы геномной ДНК. Сos-B сайт подразделяется на несколько областей именуемых R1, R2, R3, которые являются сайтами связывания с малой субъединицы терминазы, а область I1- для взаимодействия с фактором интеграции клетки-хозяина, который необходим в процессах лизогенизации.
Каким образом осуществляется терминазная реакция? Терминатор соединяется со случайно встречаюцимся cos-сайтом и вводит ступенчатообразные разрезы, обозначаемые N1 и N2, при этом формируются концы геномных ДНК фага λ: левый и правый конецы. Терминатор соединяется с левым концом выступающего конкотемера и формируется временный комплекс – комплекс1, состоящий из теминазы и фаговой ДНК.Этот комплекс приводит к образованию тройственного комплекса, более стабильного, состоящего уже из предголовки, терминазы и упаковывающейся ДНК. При этом левый конец, отрезанный уже от конкотемера, проникает в предголовку и с участием естественно, гидролиза АТФ для высвобождения свободной энергии необходимой для осуществления этого процесса, до следующего сos-сайта.
Развитие умеренных фагов (лизогения) подробно охарактеризовано для колифага λ. Это сложный фаг, содержащий линейную двухцепочечную ДНК. На 5/-конце каждой ее цепи имеется одноцепочечная последовательность из 12 нуклеотидов – липкие концы (cos-сайты). Сразу же после проникновения фаговой ДНК в бактериальную клетку, липкие концы ДНК ковалентно соединяются ДНК-лигазой клетки-хозяина и образуется кольцевая молекула.
Далее, как правило, эта кольцевая молекула бактериофаговой ДНК не приступает к транскрипции, а встраивается в бактериальную хромосому. Установлено, что гены фага λ кодируют синтез четырех регуляторных белков, один из которых репрессорный белок сI (кодируется геном сI) блокирует развитие событий литического цикла, а антирепрессорный белок Cro (кодируется геном сro), наоборот, запускает их. После поступления ДНК фага λ в клетку, выбор между литическим и лизогенным путями развития зависит от относительной скорости накопления регуляторных белков: если преобладает антирепрессорная функция белка Cro, то развиваются события литического цикла, если успевает проявиться функция репрессорного белка сI, литический цикл не осуществляется, так как белок сІ связывается с ДНК фага λ в особых участках, препятствуя транскципции фаговых генов.
Встраивание ДНК фага λ в бактериальную хромосому осуществляется согластно интегративной модели А.Кемпбелла. Этот процесс называется сайт-специфической рекомбинацией, так как встраивание ДНК фага λ осуществляется в одном и том же месте (сайте) между генами gal и bio и не зависит от rec A-системы бактериальной клетки.
За интеграцию ДНК фага λ ответственен фермент лямбда-интеграза. Этот фермент узнает две разные последовательности – одну в хромосомной ДНК (att λ), а другую в ДНК фага (b2). Затем происходит разрыв обеих молекул ДНК и последующее их перекрестное воссоединение.
После этого ДНК фага λ реплицируется с клеточной ДНК как единая структура, и все дочерние клетки при делении получают копию фаговой ДНК в составе хромосомы. Подобные клетки называются лизогенными, а ДНК фага λ в них – профагом.
Состояние лизогении поддерживается благодаря постоянному образованию белка-репрессора сІ, и довольно неустойчиво: в любой момент может произойти переключение на литический путь из-за проявления антирепрессорных функций белка Cro. Показано, что в популяции лизогенных бактерий в одной из 102 – 105 клеток происходит спонтанная индукция профага и запускается литический цикл, а такие клетки подвергаются лизису. Эффективность данного процесса зависит как от состояния бактерии-хозяина, так и действия разнообразных физических и химических факторов. Индукторами перехода лизогения ↔ литический цикл являются ультрафиолетовое излучение, митомицин С, алкилирующие агенты, для некоторых фагов также и изменение температуры.
Явление индукции профага очень важно учитывать при составлении многокомпонентных заквасок для получения молочнокислых продуктов. Если среди штаммов, входящих в такие закваски окажутся лизогенные и нелизогенные, но чувствительные к фагу, обусловившему лизогению бактерий, то произойдет явление фаголизиса (т.е. гибели клеток), очень опасное для молочной промышленности.__ Следует отметить, что фаголизис может быть обусловлен и вирулентными фагами, попадающими в технологические потоки при плохой организации производства. Явление фаголизиса так же может наблюдается и в процессе микробного синтеза аминокислот, что значительно снижает рентабельность этих отраслей биотехнологии.
Таким образом, умеренные бактериофаги могут находиться в трех состояниях:
- в свободном состоянии в виде частиц – вирионов;
- в состоянии профага;
- в вегетативном (активном) состоянии, когда бактериофаг способен вызывать лизис бактериальной клетки
25. Клонирование рекомбинантных ДНК с помощью векторов на основе бактериофага (лямбда)
Штамм бактерии, лизогенный по какому-то умеренному фагу, обозначают по принципу: E. coli С600(λсI857), где в скобках – штамм лизогенирующего фага. Геном фага λ можно разделить на 3 основные части:
(1) сектор, включающий все гены (от Nu1 до J), белковые продукты которых необходимы для формирования капсида и упаковки в них молекул ДНК.
(2) сектор между J и N несущественен для литического развития фага. Этот сектор содержит ген, участвующие в сайтспецифической интеграции ДНК фага в бактериальную хромосому (int) и исключение профага из хромосомы (xis).
(3) Сектор остальных контролирующих элементов, включая гены, необходимые для репликации фаговой ДНК (O и P) и для лизиса клеток (S и R).
Район GC-богатых липких концов, длиной по 12 нукл. (cosR и cosL) называется cos-сайтом.
При размножении фага в клетке, его ДНК находится в конкатемерной форме – т.е. несколько полных фаговых геномов соединены в одну молекулу ДНК. Белки Nu1 и А связываются с cos-сайтами на такой конкатемерной молекуле и обеспецивают ее нарезание на одельные геномы, с образованием «липких» концов. ДНК пакуется в головку, а затем происходит присоединение хвостового отростка.
В геноме фага λ и имеется 5 мест расщепления для EcoRI, причем 3 из них находятся в области генов, несущественных для литического развития фага. Для HindIII имеется 6 мест узнавания, их них 5 – в области, несущественных для развития фага.
Встройка фрагментов чужДНК по сайтам рестрикции ограничена размером генома фага: жизнеспособность «гибридного» фага резко снижается, если размер его ДНК составляет более 105 или менее 78% размера ДНК фага дикого типа. Размер ДНК гибридных фагов должен находиться в пределах 38-51 т.п.н.
Упаковка ДНК фага лямбда в капсид in vitro. При использовании фага лямбда в качестве вектора часто применяют способ искусственной упаковки первоначально голой ДНК в капсиды. При этом берется ДНК мутантов фага, не способных образовывать полноценные фаговые частицы, т.к. имеют дефекты генов, кодирующих белки капсида. Ее смешивают с белковыми экстрактами клеток, в которых развивался фаг. В результате этого происходит самосборка инфекционных частиц, при которой незадействованные (пустые) капсиды с помощью ферментов фага включают фаговую ДНК. Значение этого метода в том, что в капсид упаковываются только молекулы ДНК, размер которых приблизительно равен размеру фагового генома. Побочные генно-инженерные продукты в капсид не упаковываются.
Векторы на основе λ делят на векторы внедрения и векторы замещения.
Векторы внедрения имеют на ДНК одно место действия для данной рестриктазы. Если при встройке экзогенной ДНК в этот сайт происходит нарушение какого-нибудь исходого гена, отбор гибридных клонов идет как процесс выявления соответсвующих фаговых мутаций.
Пример: векторный фаг λplac5-1. При встройке экзогенной ДНк по единственному месту действия EcoRI нарушается ген β-галактозидазы (lacZ), и это легко детектируется в тесте титрования фагов на газоне E.coli lacZ- (штамм, не способный сбраживать лактозу) на чашках с индикаторным красителем. β-галактозидаза катализирует расщепление лактозы на глюкозу и галактозу, что приводит к закислению окружающей среды. Изменение pH выявляется на питательной среде с лактозой и краистелем бромкрезоловым пурпурным. Исходный фаг λplac5-1 сбраживает лактозу, и бляшки, образуемые им, имеют желтое окрашивание. Гибридные фаги на основе λplac5-1 теряют β-галактозидазную активность, и формируют бляшки без изменения цвета.
Векторы замещения имеют 2 или более мест действия рестриктаз на молекуле фаговой ДНК.
Векторы замещения 1-го поколения. Заключенный между местами рестрикции фрагмент векторной ДНК замещается экзогенной ДНК. При этом происходит удаление нескольких генов фага, что детектируетс генетическими методами. Удаляться могут только гены, несущественные для литического развития фага (область от J до N).
Пример: вариант фага λ, в который можно встраивать фрагменты размером до 24 т.п.н., что составляет примерно ½ всей гибридной фаговой ДНК.
Векторы замещения 2-го поколения. У них замещаемые фрагменты ДНК с двух сторон ограничены искусственными полилинкерами, содержащими участки узнавания нексольких различных рестриктаз. Например, широко используется в лабораториях векторный фаг λEMBL12, содержащий в полилинкерах места узнавания для 6 рестриктаз.
Векторы замещения 2-го поколения позволяют встраивать фрагменты размером до 23 т.п.н. (1 т.п.н. идет на полилинкеры). Это дает возможность создавать на их основе библиотеки генов (= клонотеки, = геномных библиотеки). При этом геном изучаемого организма расщепляется на фрагменты «средне» щепящими рестриктазами (обычно Sau3AI и MboI). Перед встройкой в ДНК фага полученных фрагментов, среди них отбирают только фрагменты протяженностью 15-20 т.п.н., путем электрофоретического фракционирования. Таким образом избегают встройки в ДНК фага двух или более несоседних в геноме фрагментов. При встройке 2 и более фрагментов размер гибридной ДНК будет превышать предельно допустимый: удобным инструментом при этом является упаковка ДНК в капсид. При упаковке ДНК в капсид in vitro произосходит отбор гибридных молекул размером от 38 до 51 т.п.н.
Фрагменты ДНК в клонотеке можно идентифицировать по их порядку расположения в геноме, и при условии последовательного покрытия всего генома, такое собрание штаммов фага лямбда называют энциклопедией генов. Для этого используют векторы замещения 2-го поколения типа λDASH. Как оказывается, число клонов гибридной ДНК в энциклопедии гораздо меньше, чем в библиотеке, т.к. исключены крупные участки перекрывания и разного рода посторы. Например, для создания полной энциклопедии генов E. coli пришлось проанализировать 3400 гибридных клонов, а уже сформированная энциклопедия содержит 381 клон. Тем не менее, хранение целых генов в фаговых векторах не всегда возможно, т.к. многие гены гораздо длиннее, чем 23 т.п.н.
26 Конструирование космид и клонирование в них длинных фрагментов чужеродной ДНК.
Фаговые векторы позволяют клонировать фрагменты ДНК длиной 15-25 т.п.о. этого недостаточно для клонирования генов животных и растений, длина которых превышает 35-40 т.п.о. Требуемой емкостью обладают векторные молекулы, называемые космидами
Космиды представляют собой небольшие плазмиды, в которые in vitro введены cos-сайты ДНК фага лямбда. Отсюда происходит название всего типа данных векторов (cosmid). В ДНК нормальных фаговых частиц cos-сайты расположены на концах молекул, они разделяют мономеры фаговой ДНК в конкатемерах, объединяющих несколько соединенных "голова к хвосту" мономеров, которые являются предшественниками зрелых фаговых ДНК перед упаковкой в фаговые частицы. В таких конкатемерах соседние cos-сайты располагаются на расстоянии 35-45 т.п.о. друг от друга и заключают между собой весь фаговый геном. В процессе упаковки cos-сайты узнаются компонентами ферментативной системы и по ним происходит последовательное отрезание упакованной в фаговую частицу лямбда-ДНК от остальной неупакованной ДНК конкатемера.
Наличие cos-сайтов в ДНК является единственным необходимым условием упаковываемости ДНК в фаговые частицы. Это означает, что последовательность нуклеотидов лямбда-ДНК, расположенная между двумя cos-сайтами, которая заключает в себе весь фаговый геном (35-45 т.п.о.), может быть замещена in vitro на аналогичный по длине фрагмент чужеродной ДНК и упакована в фаговые частицы. Такая искусственная фаговая частица оказывается нежизнеспособной. Однако после адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30-40 т.п.о. Поскольку такая плазмида (космида) содержит в своем составе селектируемые маркеры в виде генов устойчивости к антибиотикам, ее поддерживают в бактериальных клетках путем выращивания бактерий на среде с соответствующими антибиотиками. Несмотря на то, что емкость космидных векторов значительно выше фаговых, эффективность клонирования в космидах ниже, хотя и достигает в ряде случаев 105-106 колоний на 1 мкг клонируемой ДНК. При такой эффективности упаковки требуется всего лишь 2-4 мкг клонируемой ДНК для получения полной клонотеки большинства эукариотических геномов.
Стадия упаковки ДНК космид в фаговые частицы используется лишь для облегчения процесса введения рекомбинантных ДНК большого размера внутрь бактериальных клеток. Такой процесс имитирует проникновение фаговой хромосомы в бактерии во время фаговой инфекции. В случае космид сходство между их проникновением в бактериальные клетки и фаговой инфекцией на этом заканчивается.
27 Синтез и клонирование комплементарных ДНК (кДНК) с помощью фермента обратная транскриптаза.
Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК) (рис. 9). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли (А)-содержащих мРНК используют олигo (dT), а для молекул РНК, не имеющих 3'-поли (А) концов,
— химически синтезированные олигонуклеотиды, комплементарные 3'-концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера. Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E . c oli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи.

Рис. 9. Схема синтеза двухцепочечных ДНК- копий молекул РНК.
Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми. Для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований
28 Использование приема «прогулок по хромосомам» для клонирования и анализа длинных фрагментов ДНК.
«Прогулка» по хромосоме (chromosome walking)— метод анализа протяженных нуклеотидных последовательностей вокруг секвенированных участков генома с использованием «блуждающих» праймеров, который заключается в последовательном отборе клонов, содержащих частично перекрывающиеся фрагменты ДНК из определенного района генома. На первом этапе проводят скрининг библиотеки генов с помощью маркерной ДНК, сцепленной с определенным геном. После нахождения положительных клонов последние сами служат зондами для изоляции других клонов, содержащих перекрывающиеся нуклеотидные последовательности ДНК. Т. обр., каждый раз отобранный фрагмент используется в качестве скринирующего ДНК-зонда для последующего поиска. В результате получают набор клонированных фрагментов ДНК, полностью перекрывающих область поиска гена. Группа подобных клонов носит название «контигов». С помощью физического картирования инсерционных ДНК в разных клонах удается точно установить степень перекрывания между соседними фрагментами и соответственно упорядочить положение клонов в контигах. В результате прогулок по хромосомам с помощью перекрывающихся нуклеотидных последовательностей анализируются неизвестные протяженные участки генома, прилегающие друг к другу. Одним из вариантов метода прогулок по хромосомам является метод «прыжков по хромосоме»
Векторы на основе фага М13.
Этот фаг совсем не похож на λ (рис. 8) и на образ фага вообще — он нитчатый, его ДНК кольцевая и одноцепочечная. Векторы на его основе не участвуют в ёмкостной гонке, а служат для других целей. Распознав подходящего хозяина по половым пилям на клетке, М13 «раздевается», и по матрице его ДНК синтезируется копия — формируется двухцепочечная, репликативная форма (RF) фага. Но в состав вириона потом войдет лишь одноцепочечная ДНК, причем в отношении ее размера М13 не капризен. Другой вопрос, что ему нужно абсолютно всё, что он кодирует, поэтому только небольшие вставки не нарушат репликацию этого фага. М13-векторы содержат типичные для плазмид системы селекции — например, lacZα со всем необходимым. От лямбды М13 отличается деликатностью в отношении хозяина: фаг немного замедляет его развитие, но «одевается» тихонько и уходит по-английски. Одноцепочечную рекомбинантную ДНК выделяют из фагов, которых находят в слабо выраженных бляшках на газоне E. coli, а двухцепочечную — как обычную плазмиду из расположенных там же клеток.
Одноцепочечные векторы удобны для приготовления меченых зондов, олигонуклеотид-направляемого мутагенеза и секвенирования дидезоксиметодом. Последняя цель уходит в историю, потому что и секвенировать сейчас стараются иначе, и приспособленных для этого плазмид уже немало. Сайт-специфический мутагенез с помощью олигонуклеотидов, напротив, набирает обороты: его быстрота и прецизионность немыслимы для классического, случайного мутагенеза. Он активно применяется в фундаментальных исследованиях, производстве ГМО и белковой инженерии. Другой вопрос, что олигонуклеотид-направляемый мутагенез сейчас реже опирается на М13-векторы и чаще сочетается с ПЦР и техниками редактирования генома in vivo.
(Ответ вариант-4)
Зайдите через браузер хром и переведите страницу, здесь очень хорошо показана структура данного фага и вообще все про него, включая +/– цепи и применение !!! http://www.wwnorton.com/college/biology/microbiology2/ch/11/etopics.aspx
Ход реакции ПЦР
Обычно при проведении ПЦР выполняется 20—35 циклов, каждый из которых состоит из трёх стадий.
Денатурация
Двухцепочечную ДНК-матрицу нагревают до 94—96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0,5—2 мин, чтобы цепи ДНК разошлись. Эта стадия называется плавлением (денатурацией ), так как разрушаются водородные связи между двумя цепями ДНК. Обычно перед первым циклом проводят длительный прогрев реакционной смеси в течение 2—5 мин для полной денатурации матрицы и праймеров.
Отжиг
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 5 градусов меньше, чем температура плавления праймеров. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Время стадии отжига — 30 сек, одновременно, за это время полимераза уже успевает синтезировать несколько сотен нуклеотидов. Поэтому рекомендуется подбирать праймеры с температурой плавления выше 60 °C и проводить отжиг и элонгацию одновременно, при 60—72 °C.
Элонгация
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы, синтезируя новую цепь в направлении от 5'- к 3'-концу. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7—10 мин.
Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2n — 2n, где n — число циклов реакции[17]. На самом деле эффективность каждого цикла может быть меньше 100 %, поэтому в действительности P ~ (1+E)n, где P — количество продукта, Е — средняя эффективность цикла.
Число «длинных» копий ДНК тоже растет, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент.
Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато».
Применение
ОТ-ПЦР используется для обнаружения молекул РНК в образце с заранее известным участком последовательности, комплементарным праймеру. Экспоненциальная амплификация при помощи ОТ-ПЦР является чувствительной методикой, с помощью которой может быть обнаружено малое количество молекул РНК.
Примером являются РНК-вирусы, такие как вирус иммунодефицита человека (ВИЧ), который является ретровирусом и поэтому использует фермент обратную транскриптазу ВИЧ (англ. HIV- Reverse Transcriptase) для синтеза вирусной ДНК, которая затем встраивается в геном хозяина.
Также ОТ-ПЦР широко используется для диагностики генетических заболеваний и полуколичественного определения специфических молекул РНК в клетке или ткани как индикатор экспрессии соответствующих генов.
Общая структура молекул антител и модель раздельного генетического кодирования вариабельных (V) и константных (C) сегментов. Организация и количество V- и C-генов в эмбриональных клетках
. 



44 Роль J-сегментов, сочлененных с геномными С-сегментами, а также D-сегментов в увеличении числа различных вариантов цепей иммуноглобулинов. Вклад альтернативного сплайсинга и мутаций в обеспечении разнообразия иммуноглобулинов.
прошлый вопрос
По расчетам некоторых авторов вариабельность может составлять 102 сочетаний. В геноме человека и животных просто не хватило бы генетического материала, если каждый Ig кодировался бы уникальным геном. Поэтому эволюционно возникло и закрепилось отбором несколько механизмов, обеспечивающих бесконечное генетическое разнообразие антител при «минимальных затратах» ДНК. Основные из них следующие:
1. Соматические рекомбинации;
2. Соматические мутации;
3. Неточность сплайсинга.
Повышение эффективности трансформации плазмидами дрожжей с помощью дополнительных точек начала репликации (элементов автономной репликации, ЭАР). Стабилизация дрожжевых плазмид введением центромерной (CEN) ДНК дрожжей.
У дрожжей известны три вида плазмид, которые можно использовать в качестве векторов. Это 2m (мю) и 3m (мю, я не нашёл символ просто) (длина соответственно 2 и 3 мкм), а также митохондриальная (длина 24 мкм) ДНК.
В 1967 г. опубликовали статью, в которой сообщили, что при электронно-микроскопическом анализе препарата общей дрожжевой ДНК выявляется кольцевая двухцепочечная ДНК с контурной длиной около 2 мкм. Дальнейшие исследования в разных лабораториях показали, что большинство (около 75 %) лабораторных штаммов S. сerevisiae содержат этот класс внехромосомных молекул ДНК. Обнаруженная кольцевая ДНК была названа двухмикронной плазмидой, а в дальнейшем — Scpl. На гаплоидную клетку приходится в зависимости от штамма от 30 до 200 копий Scpl. Плавучая плотность Scpl в градиенте концентрации хлорида цезия такая же, как и у хромосомной ДНК.
Плазмида Scpl является прекрасной модельной системой для изучения контроля экспрессии эукариотических генов и репликации хромосом. Зная молекулярно-биологическую организацию данной плазмиды, можно эффективно использовать ее для создания молекулярных векторов, последующего конструирования гибридных ДНК и введения их в клетки дрожжей. В 1979 г. обнаружили, что в ядре клеток дрожжей-сахаромицетов находится небольшое число молекул кольцевой двухцепочечной ДНК с контурной длиной около 3 мкм. Как выяснилось, данная плазмида представляет собой автономно реплицирующуюся полную копию одного хромосомного набора генов рибосомной РНК. В зависимости от штамма S. Cerevisiae плазмида Iμ присутствует в ядре в количестве от 1 до 19 копий. Полагают, что внехромосомные гены рибосомной РНК в виде автономной кольцевой ДНК могут быть промежуточной формой при амплификации генов рРНК дрожжей. Такая внехромосомная форма генов рРНК выявлена также у целого ряда других низших эукариот. Обнаружение внехромосомных плазмид и подробное исследование их структурно-функциональной организации дало мощный толчок работам по созданию молекулярных векторов и использованию S. cerevisiae для клонирования генов. Данная эукариотическая система предоставляет экспериментаторам принципиально новые возможности по сравнению с бактериальными клетками. Генно-инженерные манипуляции на S. Cerevisiae стали реальны лишь после того, как экспериментально была доказана возможность генетической трансформации дрожжевых клеток. Трансформирующая ДНК может сохраняться в дрожжевых клетках либо путем интеграции с хромосомой, либо путем автономной репликации в виде эписомы. Судьба введенной в клетки ДНК определяется присутствием или отсутствием в ней элементов автономной репликации (ЭАР). Высокоэффективная эписомная трансформация достигается включением в кольцевую плазмиду сегмента ДНК, содержащего точку начала репликации, что обусловливает независимую репликацию эписомы в дрожжевых клетках. Включение в плазмиду ЭАР во многих случаях позволяет довести эффективность трансформации популяции сферопластов дрожжей до 1%. Последовательности ЭАР были выделены из эндогенной дрожжевой плазмиды (2µ-кольца) и из клонированных сегментов дрожжевой хромосомы. Они состоят, по крайней мере, из 60 нуклеотидных пар, обогащены АТ парами и содержат каноническую последовательность АААС/ТАТААА. Интересно, что в качестве ЭАР в дрожжевых плазмидах функционируют также определенные клонированные сегменты ДНК кукурузы, дрозофилы и других организмов. Во всех случаях последовательности служат сигналом для экстрахромосомной репликации ДНК, введенной в дрожжевые клетки, однако пока нет четких доказательств того, что они инициируют репликацию хромосомной ДНК у дрожжей или других организмов.
Плазмиды, содержащие центромерные области, предложено называть векторами YCp-типа. Главным преимуществом этих векторов является их высокая митотическая и мейотическая стабильность. К недостаткам следует отнести низкую копийность в клетке и соответственно низкую дозу клонированного гена.
Разработанный метод клонирования и отбора центромерных участков хромосом в клетках дрожжей позволил впервые изолировать центромеры эукариотических хромосом и изучить их структурную организацию.
Центромера -- участок хромосомы, обеспечивающий правильное расхождение хромосом в митозе и мейозе в результате взаимодействия с элементами аппарата веретена клетки. Используя описанный выше метод, удалось клонировать в составе плазмид центромеры всех хромосом S. cerevisiae.
(В след. вопросе дополнение к вказанному).
Общие принципы строения нуклеиновых кислот как носителей генетической информации. Укажите различия в структуре и функционировании ДНК и РНК.
НУКЛЕИНОВЫЕ КИСЛОТЫ – биологические полимерные молекулы, хранящие всю информацию об отдельном живом организме, определяющие его рост и развитие, а также наследственные признаки, передаваемые следующему поколению.Впервые они были описаны в 1869 году швейцарским биохимиком Фридрихом Мишером. Из остатков клеток, содержащихся в гное, он выделил вещество, в состав которого входят азот и фосфор. Ученый назвал это вещество нуклеином (лат. nucleus– ядро), полагая, что оно содержится лишь в ядрах клеток. Позднее небелковая часть этого вещества была названа нуклеиновой кислотой.
В природе существуют нуклеиновые кислоты двух типов – ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). Дезоксирибонуклеи́новая кислота́ (ДНК) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков.
Рибонуклеи́новые кисло́ты (РНК) — одна из трех основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.ДНК и РНК полимеры. А если они полимеры, то должны существовать мономеры или мономерные звенья. Этими мономерными звеньями являются нуклеотиды.
Строение ДНК. ДНК является первичным носителем наследственной информации. Это означает, что вся информация о структуре, функционировании и развитии отдельных клеток и целостного организма записана в виде нуклеотидных последовательностей ДНК.Обычно молекула ДНК рассматривается как двойная правозакрученная спираль, которая состоит из двух нитей (или цепей), связанных между собой водородными связями. Каждая нить представлена чередующимися остатками дезоксирибозы и фосфорной кислоты, причем, к дезоксирибозе ковалентно присоединяется азотистое основание. При этом азотистые основания двух нитей ДНК направлены друг к другу и за счет образования водородных связей образуют комплементарные пары: А=Т (две водородных связи) и Г≡Ц (три водородных связи). Поэтому нуклеотидные последовательности этих цепей однозначно соответствуют друг другу. Такая способность к избирательному соединению нуклеотидов, в результате чего формируются пары А – Т; Г – Ц, называется комплементарностью. Толщина спирали равна 20 Å (2 нм); шаг спирали составляет 34 Å (3,4 нм), на один виток спирали приходится 10,5 пар нуклеотидов. Длина одной молекулы ДНК колеблется от нескольких тысяч пн (сокращ. – тпн) до нескольких миллионов пн (мпн). Например, у наиболее простых вирусов длина ДНК составляет примерно 5 тпн, у наиболее сложных вирусов – свыше 100 тпн, у дрожжей – 13,5 мпн, у мушки дрозофилы – 105 мпн, у человека – 2900 мпн (размеры ДНК даны для минимального набора хромосом – гаплоидного).Рибонуклеиновые кислоты (РНК) – это нуклеиновые кислоты, мономерами которых являются рибонуклеотиды. В пределах одной молекулы РНК имеется несколько участков, которые комплементарны друг другу. Между такими комплементарными участками образуются водородные связи. В результате в одной молекуле РНК чередуются двуспиральные и односпиральные структуры, и общая конформация молекулы напоминает клеверный лист на черешке. Азотистые основания, входящие в состав РНК, способны образовывать водородные связи с комплементарными основаниями и ДНК, и РНК. При этом азотистые основания образуют пары А=У, А=Т и Г≡Ц. Благодаря этому возможна передача информации от ДНК к РНК, от РНК к ДНК и от РНК к белкам.
РАЗЛИЧИЯ ДНК И РНК
ДНК (дезоксирибонуклеиновая кислота) – это макромолекула, которая хранит в себе и передает из поколения в поколение наследственную информацию. В клетках же основная функция молекулы ДНК – это сохранение точной информации о строении белков и РНК. У животных и растений молекула ДНК содержится в составе ядра клетки, в хромосомах. В пространстве она представлена как две спирально закрученные нити. Азотистые основания – это аденин, гуанин, цитозин и тимин, причем соединяются они между собой только по принципу комплиментарности – гуанин с цитозином, а аденин с тимином. Расположение нуклеотидов в различной последовательности позволяет кодировать различную информацию о типах РНК, участвующих в процессе синтеза белка.
Молекула РНК известна нам под названием «рибонуклеиновая кислота». РНК бывают трёх видов: и-РНК – отвечает за передачу информации, р-РНК – является составляющей рибосом, т-РНК – отвечает за доставку аминокислот к рибосомам. Помимо всего прочего, так называемая матричная РНК используется всеми клеточными организмами для синтеза белка. У отдельных молекул РНК можно отметить собственную ферментативную активность. Проявляется она способностью как бы “разрывать” другие молекулы РНК или же соединять два РНК-фрагмента. РНК так же является составной частью геномов большинства вирусов, у которых она выполняет ту же функцию что и у высших организмов макромолекула ДНК.
РНК занимается переносом биологической информации, записанной в молекулах ДНК, которая в свою очередь отвечает за сохранение информации и передаёт её по наследству. Молекула РНК такой же полимер, как и ДНК, только более короткий. Кроме того ДНК представляет собой двойную цепь, РНК – это одноцепочная структура.
1. В состав ДНК входят дезоксирибонуклеотиды, в состав РНК – рибонуклеотиды.
2. Азотистые основания в молекуле ДНК – тимин, аденин, цитозин, гуанин; в РНК вместо тимина участвует урацил.
3. ДНК является матрицей для транскрипции, она хранит генетическую информацию. РНК участвует в синтезе белка.
4. У ДНК двойная цепь, закрученная по спирали; у РНК – одинарная.
5. ДНК есть в ядре, пластидах, митохондриях; РНК – образуется в цитоплазме, в рибосомах, в ядре, собственная РНК есть в пластидах и митохондриях.
Опишите структурные особенности ДНК как основного носителя генетической информации. Укажите особенности РНК как важнейших молекул в реализации генетической информации. Каталитические свойства РНК (рибозимы).
Молекула ДНК – это двухцепочечная спираль, закрученная вокруг собственной оси.
В полинуклеотидной цепочке соседние нуклеотиды связаны между собой ковалентными связями, которые образуются между фосфатной группой одного нуклеотида и З’-спиртовой группой пентозы другого. Такие связи называются фосфодиэфирными. Фосфатная группа образует мостик между З’-углеродом одного пентозного цикла и 5’-углеродом следующего.
Остов цепей ДНК образован, таким образом, сахарофосфатными остатками.
Полинуклеотидная цепь ДНК закручена в виде спирали, напоминая винтовую лестницу и соединена с другой, комплементарной ей цепью с помощью водородных связей, образующихся между аденином и тимином (две связи), а также гуанином и цитозином (три связи). Нуклеотиды А и Т, Г и Ц называются комплементарными. В результате у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гуаниловых — числу цитидиловых. Эта закономерность получила название «правило Чаргаффа». Благодаря этому свойству последовательность нуклеотидов в одной цепи определяет их последовательность в другой. Такая способность к избирательному соединению нуклеотидов называется комплементарностъю, и это свойство лежит в основе образования новых молекул ДНК на базе исходной молекулы.
Цепи в молекуле ДНК противоположно направлены, т. е., если одна цепь имеет направление от З’-конца к 5’-концу, то в другой цепи З’-концу соответствует 5’-конец и наоборот. Это свойство биспирали ДНК называется антипараллельностью.
Впервые двухцепочечная модель молекулы ДНК была предложена в 1953 г. американским ученым Дж. Уотсоном и англичанином Ф. Криком. Он объединил данные Э. Чаргаффа о соотношении пуриновых и пиримидиновых оснований молекул ДНК и результаты рентгеноструктурного анализа, полученные М. Уилкинсом и Р. Франклин. За разработку двухспиральной модели молекулы ДНК Уотсон, Крик и Уилкинс были удостоены в 1962 г. Нобелевской премии. Диаметр молекулы ДНК – 2 нм, шаг спирали – 3,4 нм; каждый виток спирали содержит 10 пар нуклеотидов. Спиральная структура поддерживается многочисленными водородными связями, возникающими между комплементарными азотистыми основаниями, и гидрофобными взаимодействиями. Молекулы ДНК эукариотических организмов линейны. У прокариот ДНК, напротив, замкнута в кольцо и не имеет ни 3’-, ни 5’-концов.
Рибонуклеиновая кислота (РНК) — линейный полимер, состоящий из одной цепочки нуклеотидов. Мономеры РНК состоят из пятиуглеродного сахара — рибозы, остатка фосфорной кислоты и азотистого основания. Три азотистых основания в молекулах РНК такие же как и у ДНК — аденин, гуанин, цитозин, а четвертым является урацил. Образование полимера РНК происходит (также, как и у ДНК) через ковалентные связи между рибозой и остатком фосфорной кислоты соседних нуклеотидов. Функции РНК различаются в зависимости от вида рибонуклеиновый кислоты. Нуклеотиды РНК состоят из сахара - рибозы, к которой в положении 1 'присоединена одна из основ: аденин, гуанин, цитозин или урацил. Фосфатная группа объединяет рибозы в цепочку, образуя связи с 3 'атомом углерода одной рибозы и в 5' положении другого. Фосфатные группы при физиологическом рН отрицательно заряжены, поэтому РНК - можно назвать полианионом. РНК транскрибируется как полимер четырех оснований (аденина (A), гуанина (G), урацила (U) и цитозина (C)), но в «зрелой» РНК есть много модифицированных оснований и сахаров. Всего в РНК насчитывается около 100 различных видов модифицированных нуклеозидов, из которых:
- 2'-О-метилрибоза наиболее частая модификация сахара;
- Псевдоуридин - наиболее часто модифицированная основа, которая встречается чаще всего. В псевдоуридине (Ψ) связь между урацилом и рибозой не C - N, а C - C, этот нуклеотид встречается в разных положениях в молекулах РНК. В частности, псевдоуридин важен для функционирования тРНК. Важная структурная особенность РНК, отличающая ее от ДНК - наличие гидроксильной группы в 2 'положении рибозы, которая позволяет молекуле РНК существовать в А, а не В-конформации, которая наиболее часто наблюдается в ДНК. В А-форме глубокая и узкая большая бороздка и неглубокая и широкая малая бороздка. Второе последствие наличия 2 'гидроксильной группы состоит в том, что конформационно пластичные, то есть, не принимающие участие в образовании двойной спирали, участки молекулы РНК могут химически атаковать другие фосфатные связи и их расщеплять.
Рибозим (сокращение от «рибонуклеиновая кислота» и «энзим»), также называемая ферментативной РНКили каталитической РНК это молекула РНК, обладающая каталитическим действие. Многие рибозимы естественного происхождения катализируют расщепление самих себя или
других молекул РНК, кроме тогообразование пептидной связи в белках происходит при помощи рРНК рибосомы. В рамках исследований, посвященных происхождению жизни, удалось создать искусственные рибозимы типа РНКполимеразы, способные при определенных условиях катализировать свою собственную сборку. Лабораторные образцы, однако, показали невысокую каталитическую способность: они успевают собрать в цепочку не более 14нуклеотидов за 24 часа, по истечении которых они разлагаются за счет гидролиза фосфодиэфирных связей. Несмотря на то, что большинство рибозимов достаточно редко встречаются в клетках, иногда они очень важны для их существования. Например, активная часть рибосомы — молекулярной машины, осуществляющей трансляцию белков из РНК — является рибозимом.В качестве кофакторов некоторые рибозимы часто содержат двухвалентные ионы металлов, например, Mg2+.То обстоятельство, что РНК может содержать наследственную информацию, позволило Уолтеру Гилберту выдвинуть предположение, что в древности РНК использовалась как в качестве генетического материала, так и в качестве катализаторов и структурных компонентов клетки, а впоследствии эти роли были перераспределены между ДНК и белками. Эта гипотеза сейчас известна как Гипотеза мира РНК.
Если РНК были первыми молекулярными машинами, использовавшимися в ранних живых клетках, то рибозимы, существующие сегодня (например, аппарат рибосомы), могут считаться живыми ископаемыми — образцами живых существ, состоящих из нуклеиновых кислот. Недавние исследования сворачивания прионов показывают, что РНК может катализировать сворачивание белка в патологические конфигурации подобно ферментам-шаперона.
Дата: 2019-05-28, просмотров: 544.