На 1 моль формальдегида расходуется 1 моль метанола, т.е. 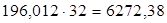 кг/ч.
кг/ч.
Расход метанола с учетом побочных реакций находим: 196,012/0,86 = 227,92 кмоль/ч или 7293,47 кг/ч;
где 0,86 – доля метанола, превращенного в формальдегид по 1ой и 2ой реакциям.
Подают метанол с учетом степени конверсии равной 0,567.
227,92/0,567 = 401,96 кмоль/ч или 12862,72 кг/ч;
401,96 – 227,92 = 174,04 кмоль/ч или 5569,28 кг/ч.
По реакции первой расходуется метанола:  кмоль/ч или 189632 кг/ч.
кмоль/ч или 189632 кг/ч.
Образуется:
формальдегида: 59,26 кмоль/ч или 1777,8 кг/ч;
водорода: 59,26 кмоль/ч или 118,52 кг/ч.
По реакции второй расходуется метанола:  кмоль/ч или 3882,56 кг/ч;
кмоль/ч или 3882,56 кг/ч;
кислорода:  кмоль/ч или 2188,16 кг/ч.
кмоль/ч или 2188,16 кг/ч.
Образуется:
формальдегида: 136,75 кмоль/ч или 4102,56 кг/ч;
воды: 136,752 кмоль/ч или 2461,54 кг/ч.
По реакции третьей расходуется метанола: 227,92 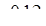 = 27,35 кмоль/ч или 875,21 кг/ч;
= 27,35 кмоль/ч или 875,21 кг/ч;
кислорода: 27,35  = 41,03 кмоль/ч или 1316,16 кг/ч.
= 41,03 кмоль/ч или 1316,16 кг/ч.
Образуется:
диоксида углерода: 27,35 кмоль/ч или 1203,4 кг/ч;
воды: 27,35 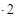 = 54,7 кмоль/ч или 984,6 кг/ч.
= 54,7 кмоль/ч или 984,6 кг/ч.
По реакции четвертой расходуется метанола: 227,92 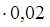 = 4,56 кмоль/ч или 145,92 кг/ч.
= 4,56 кмоль/ч или 145,92 кг/ч.
Образуется:
оксида углерода: 4,56 кмоль/ч или 127,68 кг/ч;
водорода: 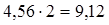 кмоль/ч или 18,24 кг/ч.
кмоль/ч или 18,24 кг/ч.
Всего образуется:
водорода: 9,12 + 59,26 = 68,38 кмоль/ч или 136,76 кг/ч;
воды: 136,752 + 54,7 = 191,452 кмоль/ч или 3446,14 кг/ч.
Общий расход кислорода: 68,38 + 41,03 = 109,41 кмоль/ч или 3501,12 кг/ч.
Расход сухого воздуха:
объемная доля кислорода в воздухе, %, 20,7;
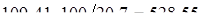 кмоль/ч.
кмоль/ч.
объемная доля водяных паров в воздухе:
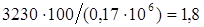 %;
%;
где, 3230 – парциальное давление водяных паров в воздухе, Па;
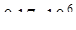 – общее давление воздуха, Па.
– общее давление воздуха, Па.
Количество водяных паров в воздухе: 528,55 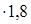 /100 = 9,51 кмоль/ч или 171,18 кг/ч.
/100 = 9,51 кмоль/ч или 171,18 кг/ч.
Количество воды в техническом («свежем») метаноле:
а) с учетом разбавления метанолом ректификатом
12862,72 – 4453,92 = 8408,8 кг/ч – количество метанола;
б) количество воды 8408,8 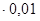 /99,9 = 8,42 кг/ч;
/99,9 = 8,42 кг/ч;
где, 0,1 – массовая доля воды «свежем» метаноле, %.
Суммарное количество водяных паров в спирто - воздушной смеси:
171,18 + 114,79 + 8,42 = 294,39 кг/ч.
Расход воздуха:
25302,74 – 4591,67 – 8417,22 = 12293,85 кг/ч;
где, 25302,74 кг/ч, 4591,67 кг/ч и 8417,22 кг/ч расход спирто-воздушной смеси, метанола - ректификата и «свежего» метанола, соответственно.
Количество азота в воздухе:
12293,85 – 3501,12 – 171,18 = 8621,55 кг/ч;
где, 3501,12 кг/ч и 171,18 кг/ч количество кислорода и воды в воздухе.
Содержание метанола в спирто- воздушной смеси:
25302,74 кг/ч или 840,71 кмоль/ч-1;
840,71 – 100%
401,96 – х%
х = 47,81%, что соответствует оптимальному технологическому режиму.
Материальный баланс стадии контактирования и спиртоиспарения в таблице 16.3.
Таблица 16.3 – Материальный баланс стадии контактирования и спиртоиспарения
| Приход | Расход | ||||||
| Состав | кг/ч | кмоль/ч | Массовая доля, % | Состав | кг/ч | кмоль/ч | Массовая доля, % |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Контактирование | |||||||
| [G3] 1. Смесь воздух – метанол, в т.ч.: формальдегид метанол вода азот кислород | 25302,74 22,96 12862,72 294,39 8621,55 3501,12 | 836,39 0,77 401,96 16,34 307,91 109,41 | 100 0,09 50,84 1,16 34,07 13,84 | [G4] 1 Контактные газы, в т.ч.: формальдегид метанол вода углекислый газ окись углерода водород азот | 25302,74 5880,36 5566,60 3228,63 807,16 83,50 146,76 9589,74 | 986,76 196,2 173,97 179,37 18,34 2,98 73,4 342,5 | 100 23,24 22 12,76 3,19 0,33 0,58 37,9 |
| Итого: | 25302,74 | 836,39 | 100 | Итого: | 25302,74 | 986,76 | 100 |
| Спиртоиспарение | |||||||
| [G2] 1. Метанол «свежий» в т.ч.: метанол вода 2. Метанол – ректиф., в т.ч.: метанол формальдегид вода [G1] 3. Воздух, в т.ч.: кислород азот вода | 8417,22 8408,80 8,42 4591,67 4453,92 22,96 114,79 12293,85 2544,83 9527,73 221,29 | 263,27 262,8 0,47 146,34 139,19 0,77 6,38 432,1 79,53 340,28 12,29 | 100 99,9 0,1 100 97 0,5 2,5 100 20,7 77,5 1,8 | [G3] 1. Смесь воздух – метанол, в т.ч.: формальдегид метанол вода азот кислород | 25302,74 22,96 12862,72 294,39 8621,55 3501,12 | 836,39 0,77 401,96 16,34 307,91 109,41 | 100 0,09 50,84 1,16 34,07 13,84 |
| Итого: | 25302,74 | 100 | Итого: | 25302,74 | 100 | ||
Сводная таблица материального баланса в таблице 16.4.
Таблица 16.4 – Сводная таблица материального баланса
|
Потоки | Приход | Расход | ||||
| G1 | G2 | G5 | G6 | G8 | G9 | |
| Компоненты | кг/ч | кг/ч | кг/ч | кг/ч | кг/ч | кг/ч |
| CH2O | 22,96 | 5858,33 | 22,96 | |||
| CH3OH | 12862,72 | 1108,33 | 4453,92 | |||
| H2O | 221,29 | 123,21 | 7234,81 | 1482,58 | 8866,66 | 114,79 |
| N2 | 9527,73 | 8461,83 | ||||
| O2 | 2544,83 | |||||
| CO2 | 591,09 | |||||
| CO | 96,90 | |||||
| H2 | 1480,15 | |||||
| ∑(комп.) | 12293,85 | 13008,89 | 7234,81 | 12112,55 | 15833,32 | 4591,67 |
| Итого: | 32537,55 | Итого: | 32537,55 | |||
Рассчитаем состав выхлопных газов в объемных долях и определим степень конверсии метанола в формальдегид по составу, пользуясь формулой:
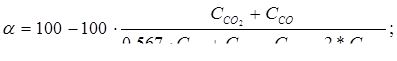 (16.7)
(16.7)
СO – 2,98 кмоль/ч 0,48 %;
CO2 – 18,34 кмоль/ч 2,97 %;
N2 – 342,5 кмоль/ч 55,55 %;
H2 – 73,4 кмоль/ч 11,9 %;
H2O – 179,37 кмоль/ч 29,1 %.
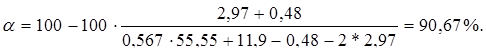
Расчет основных расходных коэффициентов
1. Расходный коэффициент по метанолу:
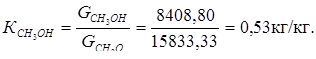
2. Расходный коэффициент по воде:
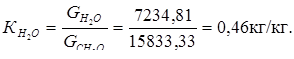
3. Расходный коэффициент по воздуху:
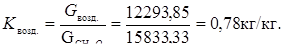
ТЕПЛОВОЙ РАСЧЕТ
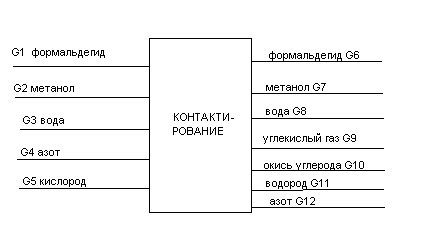
Рис.17.1 – Схема теплового баланса контактного аппарата.
Qпр = G1Cp1t + G2Cp2t + G3Cp3t + G4Cp4t + G5Cp5t; (17.1)
Qрасх = G6Cp6t + G7Cp7t + G8Cp8t + G9Cp9t + G10Cp10t + G11Cp11t + G12Cp12t 17.2)
1. Стадия синтеза
Приход:
а) теплота реакции дегидрирования;
б) теплота реакции окисления;
в) теплосодержание спирто-воздушной смеси.
Расход:
а) теплосодержание реакционных газов на входе из зоны контактирования;
б) теплопотери в окружающую среду.
Приход:
а) на реакцию дегидрирования расходуется CH3OH = 5787,88 кг/ч;
1) CH3OH → CH2O + H2.
б) на реакцию окисления расходуется CH3OH = 7074,84 кг/ч;
2) CH3OH + ½O2 → CH2O + H2O.
Тепловой эффект реакции при 20оС (293К):
реакции (1) – (-9791,18 Вт);
реакции (2) – 492840Вт [1 с. 448];
Определим тепловой эффект реакции при 650оС (923К):
Q923 = Q923 + ά (T – 293) + β (T2 – 2932) + j (T3 – 2933);(17.3)
где, Т – температура реакции;
β – алгебраическая сумма коэффициентов деленная пополам;
ά – алгебраическая сумма коэффициентов из выражений молярных теплоносителей веществ;
j – алгебраическая сумма коэффициентов деленная на три [1 с. 450].
Тепловой эффект реакции дегидрирования – (-12782,14 Вт).
Тепловой эффект реакции окисления – 24837901,83 Вт.
в) теплосодержание спирто-воздушной смеси при 100°С определяем из уравнения:
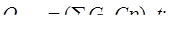 (17.4)
(17.4)
где, Ср – теплоемкость, [Дж/кг К] [1 с. 471];
G – массовый расход, кг/ч [таблица 13].
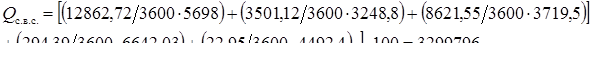 Qс.в.с. = 3299796 Вт.
Qс.в.с. = 3299796 Вт.
Расход:
а) теплосодержание контактных газов при 650оС
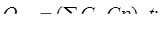 (17.5)
(17.5)
где, Ср – теплоемкость, Дж/кг К;
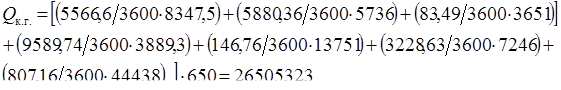
Qк.г. = 26505323 Вт.
б) материальный баланс стадии контактирования:
Qс.в.с. + Qp = Qк.г. + Qпот;(17.6)
Qp = -12782,14 + 24837901,83 = 24825119,69 Вт.
Теплопотери определяются по разности:
Qпот = Qс.в.с. + Qр – Qк.г;. (17.7)
Qпот = 3299796 + 24825119,69 – 26505323 = 1619592,69 Вт;
что, составит: 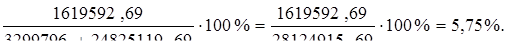
от прихода тепла.
2. Количество воды на охлаждение контактных газов в подконтактном холодильнике: теплосодержание газов на входе в холодильник, Qк.г. = 26505323 Вт.
Температуру газов на входе из холодильника принимаем 180оС, определяем теплосодержание газов при 180оС.
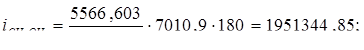
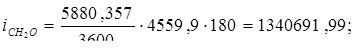
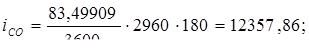
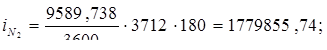
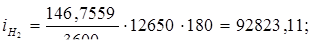
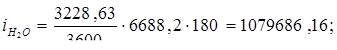
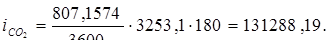
Всего: i = 5416347,534 Вт.
Количество теплоты, принятой водой в холодильнике составляет:
Qохл = 26505323 – 5416347,534 = 21088975,47 Вт.
Отсюда определяем расход воды на охлаждение:
tвх = 90оС (конденсат);
tвых = 123оС (пар Р = 0,2МПа).
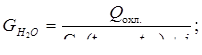 (17,8)
(17,8)
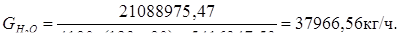
GH2O = 37966,56 кг/ч = 10,5 кг/с.
3. Абсорбция
Приход:
а) количество тепла приходящего с контактными газами:
Qк.г. = 5416347,53 Вт;
б) тепло приходящее с оросительной водой при 20°С:
 (17.9)
(17.9)
где, Ср – теплоемкость воды (кДж/кг К).
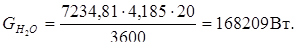
в) количество тепла процесса абсорбции:
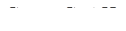 (17.10)
(17.10)
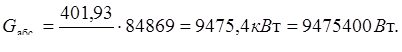
Расход
а) количество тепла, уходящее с выхлопными газами, при 20°С:
 (17.11)
(17.11)
где, G – массовый расход (кг/ч);
Ср – удельная теплоемкость (кДж/кг К); t – температура (° С).
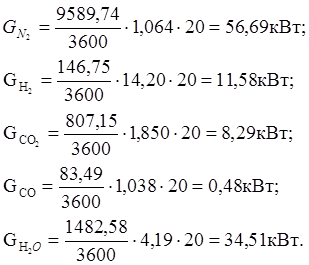
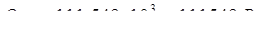
б) количество тепла, уходящее в окружающую среду (принимаем 2 % от прихода тепла):

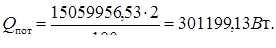
в) количество теплоты, принятое хладоагентом теплообменников (встроенных и выносных)
 (17.12)
(17.12)
где, Qф.с. – количество тепла, уходящее с формалином-″сырцом″ и рассчитывается по формуле:
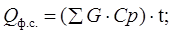 (17.13)
(17.13)
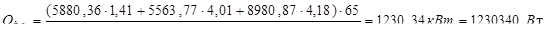
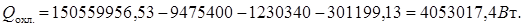
4. Ректификация
Тепловой баланс:
 (17.14)
(17.14)
где, Qф.с. – тепло формалина-″сырца″;
Q8 – тепло формалина стандартного;
Q9 – тепло формалина-″сырца″; Qрект. – тепло процесса ректификации.
Дата: 2019-05-28, просмотров: 344.