Кривые титрования представляют собой графические зависимости аналитического сигнала, в данном случае рН, от степени оттитрованности раствора, либо объема титранта. Зависимость рН от объема титранта строят на основании экспериментальных результатов с целью нахождения эквивалентного объема.
Кривые титрования имеют характерную S-образную форму. Конкретный вид кривой титрования, положение характерных точек на ней зависят, главным образом, от концентрации титранта и определяемого вещества, а также от константы диссоциации определяемого вещества.
Рассмотрим процесс построения кривых титрования по аналитическим данным на примере 0,1 и 0,001 моль/л раствора соляной кислоты и 0,1 моль/л раствора уксусной кислоты раствором гидроксида натрия. При этом будем полагать, что разбавления раствора в ходе титрования не происходит (концентрация титранта многократно превышает концентрацию определяемой кислоты).
Для расчета рН в растворах HCl при Х<100% можно использовать формулу:
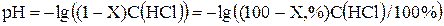 .
.
Это связано с тем, что сильная кислота в растворе при любой концентрации нацело диссоциирована и подавляет диссоциацию воды.
В точке эквивалентности при Х=100% исходной кислоты уже не остается, величина рН совпадает с рН чистой воды, т.е рН 7. Эта точка называется точкой нейтральности.
После ТЭ в растворе накапливается избыточный гидроксид натрия и его концентрация может быть рассчитана по формуле:
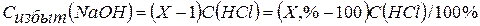
Тогда рН раствора будет равен:
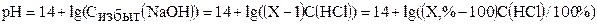 С помощью этих формул заполняем таблицу, полагая Ka=1,74∙10-5 (рKa=4,76):
С помощью этих формул заполняем таблицу, полагая Ka=1,74∙10-5 (рKa=4,76):
В растворе уксусной кислоты при Х=0 (т.е. в исходном растворе уксусной кислоты) рН рассчитывается по формуле:
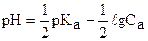
При 0% < Х < 100% титруемый раствор представляет собой буферную смесь:
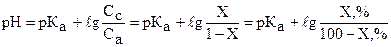
При Х = 100 % в растворе имеется ацетат натрия, концентрация которого совпадает с концентрацией исходной кислоты. Эта соль подвергается гидролизу и поэтому рН в ТЭ при титровании уксусной кислоты рассчитывается по формуле:
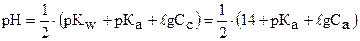
После точки эквивалентности раствор содержит избыток титранта и ацетат натрия. Причем, избыток щелочи подавляет гидролиз соли и поэтому ацетат натрия не оказывает влияния на величину рН раствора. Поэтому рН рассчитывается по той же формуле, что и при титровании соляной кислоты:
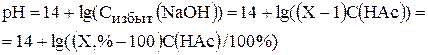
Теперь заполним последний столбец таблицы, учитывая, что Ka=1,74∙10-5 (рKa=4,76):
| Х,% | pH | ||
| 0,1 HCl | 0,001HCl | 0,1 HAc | |
| 0,0% | 1,0 | 3,0 | 2,9 |
| 10,0% | 1,0 | 3,0 | 3,8 |
| 20,0% | 1,1 | 3,1 | 4,2 |
| 30,0% | 1,2 | 3,2 | 4,4 |
| 40,0% | 1,2 | 3,2 | 4,6 |
| 50,0% | 1,3 | 3,3 | 4,8 |
| 60,0% | 1,4 | 3,4 | 4,9 |
| 70,0% | 1,5 | 3,5 | 5,1 |
| 80,0% | 1,7 | 3,7 | 5,4 |
| 90,0% | 2,0 | 4,0 | 5,7 |
| 99,9% | 4,0 | 6,0 | 7,8 |
| 100,0% | 7,0 | 7,0 | 8,9 |
| 100,1% | 10,0 | 8,0 | 10,0 |
| 110,0% | 12,0 | 10,0 | 12,0 |
| 120,0% | 12,3 | 10,3 | 12,3 |
| 150,0% | 12,7 | 10,7 | 12,7 |
| 200,0% | 13,0 | 11,0 | 13,0 |
По рассчитанным данным строим кривые титрования (показаны на диаграмме ниже). Их сравнение позволяет прийти к целому ряду важных выводов, посвященных особенностям кривых титрования и процессов титрования сильных и слабых кислот.
| Сильные кислоты | Слабые кислоты |
| Кривые титрования симметричны относительно ТЭ | Кривые титрования асимметричны относительно ТЭ |
| ТЭ совпадает с точкой нейтральности, рН 7 | ТЭ лежит выше точки нейтральности, рН > 7, так как продукт реакции – гидролизующаяся соль |
| Протяженность скачка на кривой титрования велика (6 единиц рН для 0,1 моль/л HCl) | Протяженность скачка на кривой значительно меньше (2,2 единицы рН для 0,1 моль/л HAc) |
| Крутизна скачка велика | Крутизна скачка меньшее |
| Начальный участок кривой титрования пологий | Начальный участок кривой титрования более крут |
| Для титрования пригодны и метилоранж, и ФФ, и лакмус | Наиболее подходящий индикатор – ФФ |
Другие характерные закономерности заключаются в следующем.
∙ Скачок титрования тем больше, чем больше концентрация кислоты и чем сильнее кислота. Следовательно, при очень низких концентрациях определяемой кислоты скачок титрования стремится к нулю, что делает невозможным выбор индикатора и проведение титрования с удовлетворительной точностью. Поэтому на практике титруют кислоты с концентрацией не ниже 10-2– -3 моль/л. Титрование очень слабых кислот в водном растворе также невозможно.
∙ Титрование смеси кислот возможно только в том случае, когда скачки на кривых их титрования не накладываются; это наблюдается, если константы диссоциации этих кислот различаются не менее чем на 3-5 порядков.
∙ Аналогично, титрование многоосновной кислоты по нескольким ступеням возможно, если ступенчатые константы диссоциации этой кислоты отличаются не менее чем на 3-5 порядков.
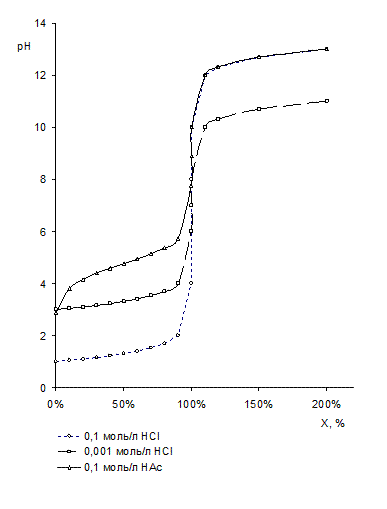
Интересной особенностью обладают кривые титрования слабых электролитов – когда Х = 50%, рН совпадает с рКа.
Кривые титрования оснований рассчитываются по аналогичным принципам. Их отличие заключается в том, что по сравнению с кривыми титрования кислот они начинаются в области больших рН и заканчиваются в области малых рН. При титровании слабых оснований ТЭ располагается при рН меньше 7, т.е. ниже точки нейтральности. Более подходящий индикатор в этом случае – метилоранж. Все остальные выводы, сделанные для кривых титрования кислот, распространимы и кривые титрования оснований.
Дата: 2019-05-28, просмотров: 300.