Индикаторы используют для установления точки эквивалентности. Как правило в качестве индикаторов в методе нейтрализации используют органические вещества, изменяющие окраску в зависимости от рН раствора. При этом эти вещества должны удовлетворять следующим требованиям:
1. Изменение цвета должно происходить резко в небольшом интервале изменений значений рН.
2. Окраска должна быть по возможности более интенсивной.
3. Изменение окраски должно быть вполне обратимым процессом.
4. Изменение окраски должно происходить от очень малого количества кислоты или щелочи.
Все эти требования существенно ограничивают выбор индикаторов. Несмотря на большое число известных веществ, обладающих индикаторными свойствами, число широко применяемых индикаторов не превышает 20.
Изменение цвета кислотно–основного индикатора. Теории индикаторов
Для объяснения перехода окраски кислотно-основных индикаторов используют ионную, хромофорную и ионно-хромофорную теории.
Ионная теория индикаторов
С точки зрения ионной теории, индикаторы в методе нейтрализации являются либо слабыми органическими кислотами, либо слабыми органическими основаниями, причем молекулярная и ионная формы индикатора имеют различную окраску. Индикаторы, способные присоединять протоны, называют основными индикаторами и обозначают IndOH. Такие индикаторы диссоциируют по схеме: IndOH + H+ = Ind+ + H2O. Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают HInd. Они диссоциируют по схеме: HInd = H+ + Ind–. Поскольку при кислотно-основном титровании кислотность раствора меняется, то меняется форма состояния индикатора в растворе и, следовательно, окраска титруемого раствора.
Индикатор меняет свою окраску при изменении кислотности раствора не мгновенно, а в пределах определенных диапазонов рН, называемых интервалами перехода. Рассмотрим это на примере двухцветного индикатора, являющегося слабой органической одноосновной кислотой HInd.
HInd = H+ + Ind–
красная желтая
Так как процесс диссоциации слабой кислоты – процесс обратимый и равновесный, то к нему применим закон действующих масс и можно записать выражение для константы диссоциации этого индикатора:
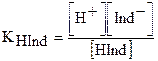 ,
,
где 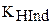 - константа диссоциации индикатора;
- константа диссоциации индикатора;
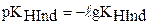 . Для индикаторов часто рKHInd обозначают рТ и называют показателем титрования.
. Для индикаторов часто рKHInd обозначают рТ и называют показателем титрования.
Цвет индикатора в каждом растворе определяется отношением концентраций молекулярной и ионной форм красителя, в данном случае Ind- и HInd. При любой концентрации ионов водорода раствор содержит обе формы. Считается, что окраска диссоциированной формы индикатора Ind-, наблюдается при условии, что ее концентрация превышает концентрацию молекулярной формы индикатора в 10 раз:
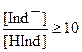 - окраска, обусловленная диссоциированной формой индикатора, в данном примере желтая.
- окраска, обусловленная диссоциированной формой индикатора, в данном примере желтая.
Окраска молекулярной формы индикатора HInd наблюдается при условии, что ее концентрация превышает концентрацию диссоциированной формы в 10 раз:
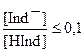 - окраска, обусловленная молекулярной формой индикатора, в данном примере красная.
- окраска, обусловленная молекулярной формой индикатора, в данном примере красная.
В интервале 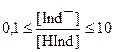 мы видим промежуточную окраску индикатора, в данном случае оранжевую. Индикатор не меняет цвет при точно определенной концентрации ионов водорода. Изменение окраски индикатора происходит постепенно в пределах определенных границ [H+].
мы видим промежуточную окраску индикатора, в данном случае оранжевую. Индикатор не меняет цвет при точно определенной концентрации ионов водорода. Изменение окраски индикатора происходит постепенно в пределах определенных границ [H+].
Из выражения константы диссоциации видно:
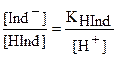 .
.
Тогда можно переписать выражение для интервала перехода следующим образом:
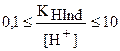 .
.
Прологарифмируем это неравенство и проведем некоторые преобразования:
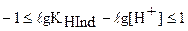
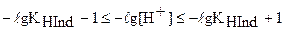
После замены 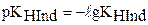 и
и 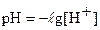 получаем следующее неравенство, показывающее интервал перехода индикатора:
получаем следующее неравенство, показывающее интервал перехода индикатора:
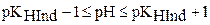 .
.
В компактной форме интервал перехода индикатора можно отобразить следующим равенством:
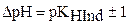 или
или 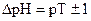
На практике, величина интервалов перехода часто несколько отличается от 2 единиц рН и середина этого интервала несколько не совпадает со значением рТ индикатора. Это связано с тем, что глаз человека обладает различной чувствительностью к разным цветам и поэтому переходы имеют различную контрастность. Если переход очень контрастен, то появление новой окраски будет замечено раньше того, как концентрация ионной формы станет равной 10% от концентрации молекулярной; если же переход малоконтрастен, то новая окраска будет замечена позднее.
Значения интервала перехода окраски индикаторов приводятся в справочниках, например, "Справочнике по аналитической химии " Ю.Ю. Лурье.
Интервалы перехода некоторых индикаторов
| индикатор | интервал перехода | рТ |
| метиловый оранжевый | 3,1-4,4 | 4,0 |
| метиловый красный | 4,2-6,2 | 5,5 |
| лакмус | 5,0-8,0 | 7,0 |
| фенолфталеин | 8,0-10,0 | 9,0 |
Из таблицы видно, что интервалы перехода окраски одних индикаторов лежат в кислой области (метилоранж), других – в нейтральной (лакмус), третьих – в щелочной (фенолфталеин). Чем больше константа диссоциации индикатора, тем меньше значение рН, при котором индикатор будет переходить из молекулярной формы в ионную и тем меньше значение рН, при котором он изменит окраску. Например, константа диссоциации метилового оранжевого (»10-4) значительно больше по сравнению с фенолфталеином (»10-9). Поэтому область перехода метилового оранжевого лежит при более низких рН раствора.
Дата: 2019-05-28, просмотров: 314.