При рассмотрении этого вопроса выделяют четыре типа солей:
1. соль, образованная слабым основанием и сильной кислотой;
2. соль, образованная сильным основанием и слабой кислотой;
3. соль, образованная слабым основанием и слабой кислотой;
4. соль, образованная сильным основанием и сильной кислотой.
Соль, образованная слабым основанием и сильной кислотой.
Примером такой соли является хлорид аммония NH4Cl. Гидролиз хлорида аммония:
NH4Cl + НОН ® NH4OH + НCl
В ионном виде:
NH4+ + НОН « NH4OH + H+
Такой случай гидролиза называется гидролизом по катиону. Водные растворы солей, гидролизующихся по катиону имеют кислую реакцию (это видно из уранения реакции гидролиза в ионной форме).
Выведем формулу для расчета рН водных растворов солей, образованных слабым основанием и сильной кислотой. Процесс гидролиза равновесный и обратимый и к нему применим закон действующих масс:
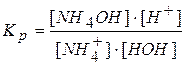
Постоянную концентрацию воды переносим в левую сторону:
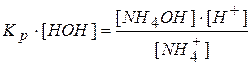
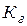
Произведение двух постоянных величин 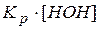 называют константой гидролиза
называют константой гидролиза 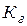 .
.
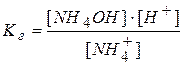
Умножим и разделим правую часть на концентрацию гидроксид-ионов:
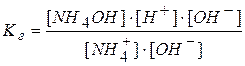
Учитывая, что 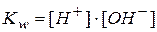 и
и 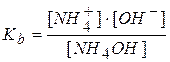 получаем:
получаем:
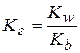
Таким образом, справедливо:
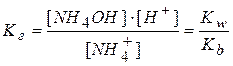
Из уравнения реакции видно, что 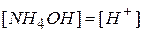 .
.
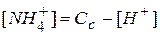 , т.е. равновесная концентрация ионов аммония равна разности общей или аналитической концентрации соли Сс и концентрации соли, подвергшейся гидролизу. В свою очередь, концентрация соли, подвергшейся гидролизу, равна концентрации образовавшихся ионов водорода. Как правило справедливо, что
, т.е. равновесная концентрация ионов аммония равна разности общей или аналитической концентрации соли Сс и концентрации соли, подвергшейся гидролизу. В свою очередь, концентрация соли, подвергшейся гидролизу, равна концентрации образовавшихся ионов водорода. Как правило справедливо, что 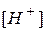 <<
<< 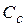 . В этом случае
. В этом случае 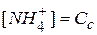 . С учетом этого получаем:
. С учетом этого получаем:
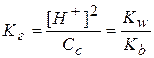
Отсюда выражаем концентрацию ионов водорода:
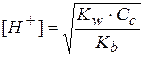
Прологарифмируем это выражение и домножим на -1:
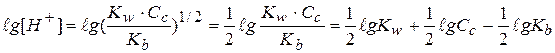
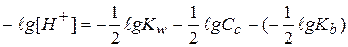
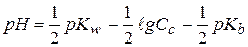 - это формула для расчета рН водных растворов солей, образованных слабым основанием и сильной кислотой (рН водных растворов таких солей всегда меньше 7!!!).
- это формула для расчета рН водных растворов солей, образованных слабым основанием и сильной кислотой (рН водных растворов таких солей всегда меньше 7!!!).
Степень гидролиза:
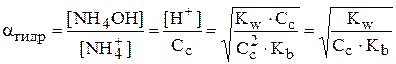
Соль, образованная сильным основанием и слабой кислотой. Примером такой соли является ацетат натрия СН3СООNа. Гидролиз ацетата натрия:
СН3СООNа + НОН ® СН3СООН + NаOH
В ионном виде:
СН3СОО- + НОН « СН3СООН + ОH-
Такой случай гидролиза называется гидролизом по аниону. Водные растворы солей, гидролизующихся по аниону имеют щелочную реакцию (это видно из уравнения реакции гидролиза в ионной форме).
Формула для расчета рОН водных растворов таких солей выводится также, как в предыдущем случае и имеет вид:
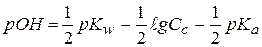
Учитывая, что 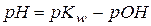 , получаем формулу для расчета рН таких растворов:
, получаем формулу для расчета рН таких растворов:
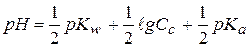 - рН таких растворов всегда больше 7
- рН таких растворов всегда больше 7
Степень гидролиза:
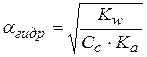
Соль, образованная сильным основанием и слабой кислотой.
Примером такой соли является ацетат аммония СН3СООNН4. Гидролиз ацетата аммония:
СН3СООNН4 + НОН ® СН3СООН + NН4OH
В ионном виде:
СН3СОО- + NH4+ + НОН « СН3СООН + NН4OH
Такой случай гидролиза называется гидролизом по катиону и по аниону. Водные растворы солей, гидролизующихся по катиону и аниону могут иметь кислую, нейтральную или щелочную реакцию, в зависимости от соотношения силы кислоты и силы основания, образующих соль. Если кислота сильнее основания, то среда кислая. Если основание сильнее кислоты, то среда щелочная. В данном примере сила кислоты и основания одинакова ( 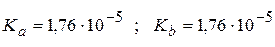 ) и водный раствор этой соли имеет нейтральную среду.
) и водный раствор этой соли имеет нейтральную среду.
рН водных растворов таких солей рассчитывается по формуле:
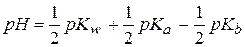
рН водных растворов таких солей не зависит от их концентрации.
Соль, образованная сильным основанием и сильной кислотой.
Примером такой соли является хлорид натрия. Такие соли гидролизу не подвергаются и водные растворы таких солей имеют нейтральную среду рН 7.
Пример: Рассчитать рН водных растворов следующих веществ:
а) 0,1 моль/л NH4Cl (Kb=1,76∙10-5, pKb=4,76)
б) 0,01 моль/л NH4Cl (Kb=1,76∙10-5, pKb=4,76)
в) 0,1 моль/л СН3СООNа (Kа=1,76∙10-5, pKа=4,76)
г) 0,1 моль/л СН3СООNа (Kа=1,76∙10-5, pKа=4,76)
д) 0,1 моль/л СН3СООNН4 (Kа=1,76∙10-5, pKа=4,76, Kb=1,76∙10-5, pKb=4,76)
е) 0,1 моль/л СН3СООNН4 (Kа=1,76∙10-5, pKа=4,76, Kb=1,76∙10-5, pKb=4,76)
Решение:
а) 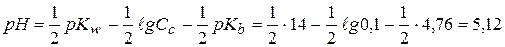
б) 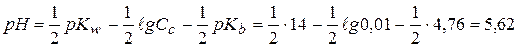
в) 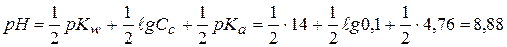
г) 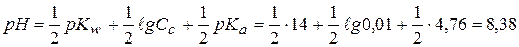
д) 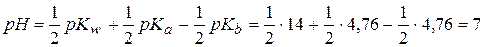
е) 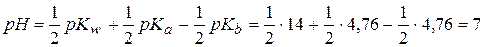
Дата: 2019-05-28, просмотров: 307.