Рассмотрим диссоциацию слабой кислоты:
HAn « H+ + An-
Диссоциация слабой кислоты – процесс обратимый и равновесный и для него можно записать закон действующих масс:
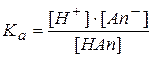
Из уравнения реакции видно, что [An-]=[H+]. Равновесная концентрация молекулярной формы кислоты [HАn] равна разности аналитической или общей концентрации кислоты Ca и концентрации продиссоциировавших молекул. Учитывая, что концентрация продиссоциировавших молекул 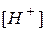 равна концентрации образовавшихся ионов водорода, можно записать:
равна концентрации образовавшихся ионов водорода, можно записать:
[HAn]=Ca – [H+].
Для слабых кислот при высоких концентрациях справедливо [H+] << Са, тогда
[HAn]=Ca.
Теперь подставим все равновесные концентрации, выраженные через [H+] и Са в выражение константы:
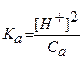
Отсюда выразим концентрацию ионов водорода и прологарифмируем полученное выражение:
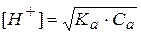
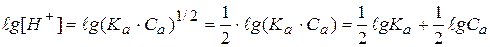
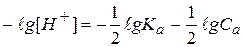
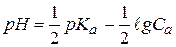 - это формула для расчета рН водных растворов слабых одноосновных кислот.
- это формула для расчета рН водных растворов слабых одноосновных кислот.
Аналогичным образом можно показать, что рОН водных растворов слабых оснований можно рассчитать по формуле:
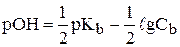
Так как рН + рОН=рKw=14, то формула для расчета рН водных растворов слабых оснований имеет следующий вид:
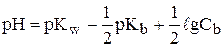
Пример. Рассчитать рН водных растворов а) 0,01 М раствора уксусной кислоты (Ка=1,76×10-5, рКа=4,76), б) 0,01 М раствора аммиака (Кb=1,76×10-5, рКb=4,76).
Решение:
a) 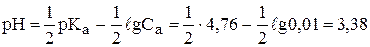
б) 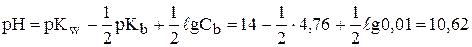 .
.
Буферные растворы
Буферные растворы – это растворы, которые не изменяют значение рН при добавлении небольших количеств кислоты, щелочи или при разбавлении. По химическому составу буферные растворы представляют собой смесь слабой кислоты и ее соли или смесь слабого основания и его соли.
Например:
ацетатный буферный раствор CH3COOH+CH3COONa, рН такого раствора меньше 7
аммиачный буферный раствор NH4OH + NH4Cl, рН этого раствора больше 7
Рассмотрим принцип действия буферных растворов на примере буферного раствора, содержащего слабую кислоту HA и ее соль NaA. В водном растворе этой смеси протекают следующие реакции:
НА « А- + H+
NaА ® А- + Na+
Диссоциация слабой кислоты процесс обратимый и равновесный, соль диссоциирует необратимо. рН этого раствора определяется наличием ионов водорода, образовавшихся в результате диссоциации кислоты. Действие буферных растворов основано на том, что отдельные компоненты буферных смесей связывают ионы водорода или гидроксид-ионы добавленных кислот или оснований с образованием слабых электролитов. Например, если к ацетатному буферному раствору прибавить щелочь, то произойдет реакция образования слабого электролита – воды:
Н+ +ОН- = Н2О
Следовательно, если к буферному раствору, содержащему кислоту, прибавить щелочь, то ионы водорода, образующиеся при электролитической диссоциации кислоты HА, связываются с гидроксид-ионами прибавленной щелочи, образуя слабый электролит – воду. Вместо израсходованных ионов водорода, вследствие последующей диссоциации слабой кислоты, появляются новые ионы водорода. В результате концентрация Н+ в буферном растворе восстанавливается до ее первоначального значения. Если к указанной буферной смеси прибавить сильную кислоту, то произойдет реакция Н+ + А- ® НА, т.е. ионы А-, образующиеся при электролитической диссоциации соли NaА, соединяясь с ионами водорода прибавленной кислоты, образуют молекулы слабой кислоты. Поэтому концентрация ионов водорода от прибавления сильной кислоты к буферной смеси тоже практически не изменяется.
Дата: 2019-05-28, просмотров: 333.