В соответствии с законом эквивалентов, число моль эквивалентов реагирующих веществ одинаково. Для реакции между анализируемым раствором и титрантом, выражение закона эквивалентов имеет вид:
n( fэкв X)∙= n (fэкв Т).
Число моль эквивалентов вещества в растворе равно произведению эквивалентной концентрации на объем раствора, поэтому
C(fэкв Т)∙VТ = C(fэкв X)∙VХ,
Это уравнение получило название основного уравнения титриметрического анализа, в нем:
C(fэкв Т) – нормальная концентрация стандартного раствора (раствор реагента известной концентрации), моль/л;
C(fэкв X) – нормальная концентрация определяемого вещества в анализируемом растворе, моль/л;
fэкв – фактор эквивалентности;
VТ – объем стандартного раствора, необходимого для завершения реакции с определяемым веществом (эквивалентный объем), л;
VХ – объем анализируемого раствора, взятый для титрования, л (точно измеренный объем анализируемого раствора называют "аликвотой").
Из основного уравнения выводится расчетная формула для определения концентрации определяемого вещества:
C(fэкв X)∙= C(fэкв Т)∙VТ/ VХ.
В том случае, если требуется рассчитать массу вещества в пробе, выражение закона эквивалентов примет вид:
m(Х)/M(fэкв X)∙= C(fэкв Т)∙VТ, откуда m(X)∙= M(fэкв X)C(fэкв Т)∙VТ.
Эту формулу используют в методе отдельных навесок. При использовании способа пипетирования для расчета массы вещества во всей пробе надо использовать формулу:
m(X)∙= M(fэкв X)C(fэкв Т)∙VТ Vпробы/Vаликвоты.
Реакции в титриметрии
В титриметрическом анализе могут быть использованы только те химические реакции, которые отвечают следующим требованиям:
∙ протекают строго стехиометрично;
∙ протекают количественно, т.е. константа равновесия достаточно велика;
∙ протекают со значительной скоростью;
∙ существует способ установления окончания реакции.
В зависимости от типа реакции, используемой при титровании, методы титриметрии подразделяют на четыре группы: кислотно-основные (нейтрализации), окислительно-восстановительные (редокс), комплексометрические и осадительные. Они отличаются друг от друга природой используемых равновесий и, как следствие, реагентами, индикаторами, первичными стандартами, а также способом расчета эквивалента вещества.
МЕТОД НЕЙТРАЛИЗАЦИИ
Эта группа методов основана на применении реакции нейтрализации:
Н+ + ОН- « Н2О
В зависимости от природы титранта и определяемых веществ различают две разновидности метода нейтрализации: ацидиметрия и алкалиметрия.
В ацидиметрии титрантами являются растворы сильных минеральных кислот – серной, соляной. Азотную кислоту в качестве титранта не используют. Она является сильным окислителем и поэтому может реагировать с определяемым веществом не только по механизму нейтрализации, но и окислять его, что приведет к погрешности определения. Слабые кислоты также не используются. Ацидиметрия пригодна для определения неорганических и органических оснований, гидролизующихся солей, образованных слабой кислотой и сильным основанием, и других веществ, реагирующих с кислотами. Первичными стандартами в методе ацидометрии являются следующие вещества:
а) бура 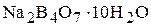 . Ее водный раствор имеет щелочную среду вследствии протекания следующей реакции:
. Ее водный раствор имеет щелочную среду вследствии протекания следующей реакции:
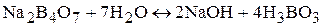
б) безводный карбонат натрия Na2CO3.
Na2CO3 + 2H2O « 2NaOH + H2CO3.
В алкалиметрии наиболее часто титрантом выступает раствор гидроксида натрия. Иногда возможно применение и других сильных оснований, но они, как правило, дороже. Алкалиметрия применяется для определения кислот различной природы, солей, образованных слабым основанием и сильной кислотой, и вообще любых веществ, реагирующих с основаниями.
Первичными стандартами в методе алкалиметрии являются:
а) бензойная кислота
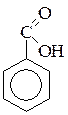
б) янтарная кислота
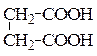
в) щавелевая кислота H2C2O4×2H2O или ее соли.
Ионное произведение воды
Состояние динамического равновесия электролитической диссоциации воды можно представить уравнением:
Н2О = Н+ + ОН-.
Диссоциация воды является процессом обратимым и равновесным и к нему применим закон действующих масс:
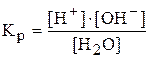 .
.
Кр – константа электролитической диссоциации воды.
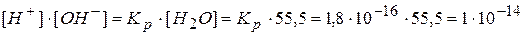 .
.
Величину произведения [H+]∙[OH-] называют ионным произведением воды и обозначают Kw. Эта зависит от температуры. Для температуры 18°С эта величина определена экспериментально. Она равна 1∙10-14
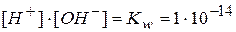
Ионное произведение воды остается постоянным в водных растворах кислот, щелочей, солей и других соединений. При повышении температуры эта величина сильно возрастает. При температуре кипения воды (100°С) ионное произведение увеличивается приблизительно в 100 раз по сравнению с его значением при 18°С и становится равным 1∙10-12.
Равновесие Н+ и ОН- в водных растворах
Кислотные и щелочные свойства электролитов определяются величиной концентрации ионов водорода и гидроксид-ионов. Ионное произведение воды при 18°С равно 1∙10-14, а в воде [H+]=[OH-], следовательно:
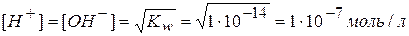
Увеличение или уменьшение [H+] или [OH-] сказывается на характере среды.
В нейтральных растворах [H+]=[OH-]=1∙10-7 моль/л;
В кислых растворах [H+]>[OH-], [H+]>1∙10-7 моль/л, [OH-]<1∙10-7 моль/л;
В щелочных растворах [H+]<[OH-], [H+]<1∙10-7 моль/л, [OH-]>1∙10-7 моль/л.
Например, если концентрация ионов водорода равна 1×10-3 моль/л, то реакция раствора кислая. Концентрация гидроксид-ионов в таком растворе меньше концентрации ионов водорода, что можно вычислить по ионному произведению воды:
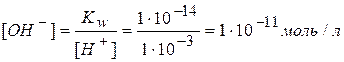
Необходимо всегда помнить, что в водных растворах различных веществ независимо от их природы всегда сосуществуют ионы водорода и гидроксид-ионы. В водных растворах щелочей присутствуют ионы водорода, а в водных растворах кислот присутствуют гидроксид-ионы.
Дата: 2019-05-28, просмотров: 545.