ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ
Титриметрическим методом анализа называют метод количественного анализа, основанный на измерении объема раствора реагента известной концентрации, необходимого для взаимодействия с определяемым веществом. Титриметрия - один из классических и наиболее распространенных методов аналитической химии, который до сих пор не утратил своего значения, несмотря на большое внимание, уделяемое новым методам. По совокупности положительных свойств (простота аппаратуры и операций, высокая точность и экспрессность определения, широчайший круг определяемых веществ) титриметрия занимает одно из первых мест среди многочисленных методов количественного анализа.
В основе титриметрического анализа лежит так называемое титрование. По способу выполнения различают прямое, обратное и косвенное титрование (титрование заместителя). Наиболее распространенным способом является прямое титрование, заключающееся в следующем. К определенному объему анализируемого раствора небольшими порциями прибавляют стандартный раствор, содержащий вещество, реагирующее с определяемым. Стандартным называется раствор, концентрация которого точно известна. Применяемый при титровании стандартный раствор называют титрантом. Добавление титранта необходимо продолжать до того момента, при котором определяемое вещество и активное вещество титранта будут слиты в эквивалентных количествах. Этот момент соответствует точке эквивалентности. В точке эквивалентности в случае необратимой реакции все определяемое вещество без остатка прореагирует с титрантом. В соответствии с законом эквивалентов, в точке эквивалентности число моль эквивалентов определяемого вещества во взятой для анализа пробе равно числу моль эквивалентов активного вещества титранта. На этом основываются все расчеты в титриметрическом анализе. Поэтому правильное установление точки эквивалентности при титровании – исключительно важная составляющая получения достоверных результатов титриметрического анализа. Наступление точки эквивалентности можно установить различными способами, например, по изменению окраски индикатора – специального вещества, либо вводимого в анализируемый раствор (внешний индикатор), либо образующегося в нем в процессе титрования (внутренний индикатор). В тот момент, при котором происходит наблюдаемое изменение цвета индикатора, титрование прекращают – это конечная точка титрования. Иногда конечная точка титрования не совпадает с точкой эквивалентности. Причиной этого может быть, например, несовпадение момента изменения окраски индикатора с моментом эквивалентности (индикаторная погрешность). В этом случае для определения эквивалентного объема вводят поправку, которую вычисляют с учетом результатов контрольного опыта (подробнее об этом говорится ниже) или аналитически.
При косвенном титровании (иначе титровании заместителя) определяемое вещество стехиометрически реагирует со вспомогательным реагентом, а получающийся продукт оттитровывают. Например, при косвенном определении кальция его осаждают в виде оксалата, осадок растворяют в серной кислоте и оттитровывают связанную с кальцием щавелевую кислоту раствором пермангатата калия. При обратном титровании к анализируемому раствору добавляют точно известное заведомо избыточное количество титранта, и затем его избыток оттитровывают другим титрантом. Обратное титрование применяют, если реакция между определяемым веществом медленная, обратимая, нельзя подобрать подходящие индикаторы.
Для снижения погрешности при титриметрическом определении титрование проводят несколько раз. При этом по способу отбора титруемой пробы различают способ пипетирования и способ отдельных навесок. В случае способа пипетирования навеску пробы растворяют в мерной колбе и отбирают из нее мерной пипеткой несколько проб, называемых аликвотами. Каждую аликвоту затем титруют. В способе отдельных навесок взвешивают несколько порций анализируемого вещества, каждую независимо растворяют в воде или подходящем растворителе, не фиксируя точно его объем, и титруют приготовленные пробы.
Реакции в титриметрии
В титриметрическом анализе могут быть использованы только те химические реакции, которые отвечают следующим требованиям:
∙ протекают строго стехиометрично;
∙ протекают количественно, т.е. константа равновесия достаточно велика;
∙ протекают со значительной скоростью;
∙ существует способ установления окончания реакции.
В зависимости от типа реакции, используемой при титровании, методы титриметрии подразделяют на четыре группы: кислотно-основные (нейтрализации), окислительно-восстановительные (редокс), комплексометрические и осадительные. Они отличаются друг от друга природой используемых равновесий и, как следствие, реагентами, индикаторами, первичными стандартами, а также способом расчета эквивалента вещества.
МЕТОД НЕЙТРАЛИЗАЦИИ
Эта группа методов основана на применении реакции нейтрализации:
Н+ + ОН- « Н2О
В зависимости от природы титранта и определяемых веществ различают две разновидности метода нейтрализации: ацидиметрия и алкалиметрия.
В ацидиметрии титрантами являются растворы сильных минеральных кислот – серной, соляной. Азотную кислоту в качестве титранта не используют. Она является сильным окислителем и поэтому может реагировать с определяемым веществом не только по механизму нейтрализации, но и окислять его, что приведет к погрешности определения. Слабые кислоты также не используются. Ацидиметрия пригодна для определения неорганических и органических оснований, гидролизующихся солей, образованных слабой кислотой и сильным основанием, и других веществ, реагирующих с кислотами. Первичными стандартами в методе ацидометрии являются следующие вещества:
а) бура 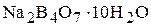 . Ее водный раствор имеет щелочную среду вследствии протекания следующей реакции:
. Ее водный раствор имеет щелочную среду вследствии протекания следующей реакции:
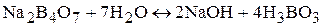
б) безводный карбонат натрия Na2CO3.
Na2CO3 + 2H2O « 2NaOH + H2CO3.
В алкалиметрии наиболее часто титрантом выступает раствор гидроксида натрия. Иногда возможно применение и других сильных оснований, но они, как правило, дороже. Алкалиметрия применяется для определения кислот различной природы, солей, образованных слабым основанием и сильной кислотой, и вообще любых веществ, реагирующих с основаниями.
Первичными стандартами в методе алкалиметрии являются:
а) бензойная кислота
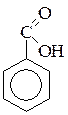
б) янтарная кислота
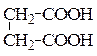
в) щавелевая кислота H2C2O4×2H2O или ее соли.
Ионное произведение воды
Состояние динамического равновесия электролитической диссоциации воды можно представить уравнением:
Н2О = Н+ + ОН-.
Диссоциация воды является процессом обратимым и равновесным и к нему применим закон действующих масс:
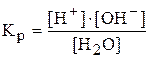 .
.
Кр – константа электролитической диссоциации воды.
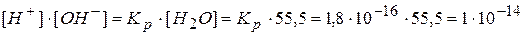 .
.
Величину произведения [H+]∙[OH-] называют ионным произведением воды и обозначают Kw. Эта зависит от температуры. Для температуры 18°С эта величина определена экспериментально. Она равна 1∙10-14
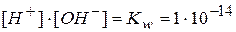
Ионное произведение воды остается постоянным в водных растворах кислот, щелочей, солей и других соединений. При повышении температуры эта величина сильно возрастает. При температуре кипения воды (100°С) ионное произведение увеличивается приблизительно в 100 раз по сравнению с его значением при 18°С и становится равным 1∙10-12.
Равновесие Н+ и ОН- в водных растворах
Кислотные и щелочные свойства электролитов определяются величиной концентрации ионов водорода и гидроксид-ионов. Ионное произведение воды при 18°С равно 1∙10-14, а в воде [H+]=[OH-], следовательно:
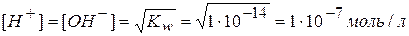
Увеличение или уменьшение [H+] или [OH-] сказывается на характере среды.
В нейтральных растворах [H+]=[OH-]=1∙10-7 моль/л;
В кислых растворах [H+]>[OH-], [H+]>1∙10-7 моль/л, [OH-]<1∙10-7 моль/л;
В щелочных растворах [H+]<[OH-], [H+]<1∙10-7 моль/л, [OH-]>1∙10-7 моль/л.
Например, если концентрация ионов водорода равна 1×10-3 моль/л, то реакция раствора кислая. Концентрация гидроксид-ионов в таком растворе меньше концентрации ионов водорода, что можно вычислить по ионному произведению воды:
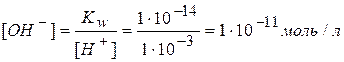
Необходимо всегда помнить, что в водных растворах различных веществ независимо от их природы всегда сосуществуют ионы водорода и гидроксид-ионы. В водных растворах щелочей присутствуют ионы водорода, а в водных растворах кислот присутствуют гидроксид-ионы.
Буферные растворы
Буферные растворы – это растворы, которые не изменяют значение рН при добавлении небольших количеств кислоты, щелочи или при разбавлении. По химическому составу буферные растворы представляют собой смесь слабой кислоты и ее соли или смесь слабого основания и его соли.
Например:
ацетатный буферный раствор CH3COOH+CH3COONa, рН такого раствора меньше 7
аммиачный буферный раствор NH4OH + NH4Cl, рН этого раствора больше 7
Рассмотрим принцип действия буферных растворов на примере буферного раствора, содержащего слабую кислоту HA и ее соль NaA. В водном растворе этой смеси протекают следующие реакции:
НА « А- + H+
NaА ® А- + Na+
Диссоциация слабой кислоты процесс обратимый и равновесный, соль диссоциирует необратимо. рН этого раствора определяется наличием ионов водорода, образовавшихся в результате диссоциации кислоты. Действие буферных растворов основано на том, что отдельные компоненты буферных смесей связывают ионы водорода или гидроксид-ионы добавленных кислот или оснований с образованием слабых электролитов. Например, если к ацетатному буферному раствору прибавить щелочь, то произойдет реакция образования слабого электролита – воды:
Н+ +ОН- = Н2О
Следовательно, если к буферному раствору, содержащему кислоту, прибавить щелочь, то ионы водорода, образующиеся при электролитической диссоциации кислоты HА, связываются с гидроксид-ионами прибавленной щелочи, образуя слабый электролит – воду. Вместо израсходованных ионов водорода, вследствие последующей диссоциации слабой кислоты, появляются новые ионы водорода. В результате концентрация Н+ в буферном растворе восстанавливается до ее первоначального значения. Если к указанной буферной смеси прибавить сильную кислоту, то произойдет реакция Н+ + А- ® НА, т.е. ионы А-, образующиеся при электролитической диссоциации соли NaА, соединяясь с ионами водорода прибавленной кислоты, образуют молекулы слабой кислоты. Поэтому концентрация ионов водорода от прибавления сильной кислоты к буферной смеси тоже практически не изменяется.
Ионная теория индикаторов
С точки зрения ионной теории, индикаторы в методе нейтрализации являются либо слабыми органическими кислотами, либо слабыми органическими основаниями, причем молекулярная и ионная формы индикатора имеют различную окраску. Индикаторы, способные присоединять протоны, называют основными индикаторами и обозначают IndOH. Такие индикаторы диссоциируют по схеме: IndOH + H+ = Ind+ + H2O. Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают HInd. Они диссоциируют по схеме: HInd = H+ + Ind–. Поскольку при кислотно-основном титровании кислотность раствора меняется, то меняется форма состояния индикатора в растворе и, следовательно, окраска титруемого раствора.
Индикатор меняет свою окраску при изменении кислотности раствора не мгновенно, а в пределах определенных диапазонов рН, называемых интервалами перехода. Рассмотрим это на примере двухцветного индикатора, являющегося слабой органической одноосновной кислотой HInd.
HInd = H+ + Ind–
красная желтая
Так как процесс диссоциации слабой кислоты – процесс обратимый и равновесный, то к нему применим закон действующих масс и можно записать выражение для константы диссоциации этого индикатора:
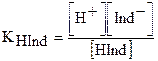 ,
,
где 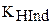 - константа диссоциации индикатора;
- константа диссоциации индикатора;
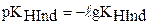 . Для индикаторов часто рKHInd обозначают рТ и называют показателем титрования.
. Для индикаторов часто рKHInd обозначают рТ и называют показателем титрования.
Цвет индикатора в каждом растворе определяется отношением концентраций молекулярной и ионной форм красителя, в данном случае Ind- и HInd. При любой концентрации ионов водорода раствор содержит обе формы. Считается, что окраска диссоциированной формы индикатора Ind-, наблюдается при условии, что ее концентрация превышает концентрацию молекулярной формы индикатора в 10 раз:
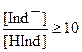 - окраска, обусловленная диссоциированной формой индикатора, в данном примере желтая.
- окраска, обусловленная диссоциированной формой индикатора, в данном примере желтая.
Окраска молекулярной формы индикатора HInd наблюдается при условии, что ее концентрация превышает концентрацию диссоциированной формы в 10 раз:
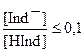 - окраска, обусловленная молекулярной формой индикатора, в данном примере красная.
- окраска, обусловленная молекулярной формой индикатора, в данном примере красная.
В интервале 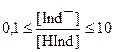 мы видим промежуточную окраску индикатора, в данном случае оранжевую. Индикатор не меняет цвет при точно определенной концентрации ионов водорода. Изменение окраски индикатора происходит постепенно в пределах определенных границ [H+].
мы видим промежуточную окраску индикатора, в данном случае оранжевую. Индикатор не меняет цвет при точно определенной концентрации ионов водорода. Изменение окраски индикатора происходит постепенно в пределах определенных границ [H+].
Из выражения константы диссоциации видно:
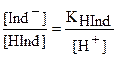 .
.
Тогда можно переписать выражение для интервала перехода следующим образом:
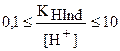 .
.
Прологарифмируем это неравенство и проведем некоторые преобразования:
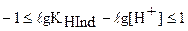
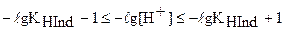
После замены 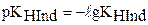 и
и 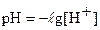 получаем следующее неравенство, показывающее интервал перехода индикатора:
получаем следующее неравенство, показывающее интервал перехода индикатора:
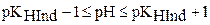 .
.
В компактной форме интервал перехода индикатора можно отобразить следующим равенством:
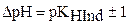 или
или 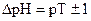
На практике, величина интервалов перехода часто несколько отличается от 2 единиц рН и середина этого интервала несколько не совпадает со значением рТ индикатора. Это связано с тем, что глаз человека обладает различной чувствительностью к разным цветам и поэтому переходы имеют различную контрастность. Если переход очень контрастен, то появление новой окраски будет замечено раньше того, как концентрация ионной формы станет равной 10% от концентрации молекулярной; если же переход малоконтрастен, то новая окраска будет замечена позднее.
Значения интервала перехода окраски индикаторов приводятся в справочниках, например, "Справочнике по аналитической химии " Ю.Ю. Лурье.
Интервалы перехода некоторых индикаторов
| индикатор | интервал перехода | рТ |
| метиловый оранжевый | 3,1-4,4 | 4,0 |
| метиловый красный | 4,2-6,2 | 5,5 |
| лакмус | 5,0-8,0 | 7,0 |
| фенолфталеин | 8,0-10,0 | 9,0 |
Из таблицы видно, что интервалы перехода окраски одних индикаторов лежат в кислой области (метилоранж), других – в нейтральной (лакмус), третьих – в щелочной (фенолфталеин). Чем больше константа диссоциации индикатора, тем меньше значение рН, при котором индикатор будет переходить из молекулярной формы в ионную и тем меньше значение рН, при котором он изменит окраску. Например, константа диссоциации метилового оранжевого (»10-4) значительно больше по сравнению с фенолфталеином (»10-9). Поэтому область перехода метилового оранжевого лежит при более низких рН раствора.
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ
Титриметрическим методом анализа называют метод количественного анализа, основанный на измерении объема раствора реагента известной концентрации, необходимого для взаимодействия с определяемым веществом. Титриметрия - один из классических и наиболее распространенных методов аналитической химии, который до сих пор не утратил своего значения, несмотря на большое внимание, уделяемое новым методам. По совокупности положительных свойств (простота аппаратуры и операций, высокая точность и экспрессность определения, широчайший круг определяемых веществ) титриметрия занимает одно из первых мест среди многочисленных методов количественного анализа.
В основе титриметрического анализа лежит так называемое титрование. По способу выполнения различают прямое, обратное и косвенное титрование (титрование заместителя). Наиболее распространенным способом является прямое титрование, заключающееся в следующем. К определенному объему анализируемого раствора небольшими порциями прибавляют стандартный раствор, содержащий вещество, реагирующее с определяемым. Стандартным называется раствор, концентрация которого точно известна. Применяемый при титровании стандартный раствор называют титрантом. Добавление титранта необходимо продолжать до того момента, при котором определяемое вещество и активное вещество титранта будут слиты в эквивалентных количествах. Этот момент соответствует точке эквивалентности. В точке эквивалентности в случае необратимой реакции все определяемое вещество без остатка прореагирует с титрантом. В соответствии с законом эквивалентов, в точке эквивалентности число моль эквивалентов определяемого вещества во взятой для анализа пробе равно числу моль эквивалентов активного вещества титранта. На этом основываются все расчеты в титриметрическом анализе. Поэтому правильное установление точки эквивалентности при титровании – исключительно важная составляющая получения достоверных результатов титриметрического анализа. Наступление точки эквивалентности можно установить различными способами, например, по изменению окраски индикатора – специального вещества, либо вводимого в анализируемый раствор (внешний индикатор), либо образующегося в нем в процессе титрования (внутренний индикатор). В тот момент, при котором происходит наблюдаемое изменение цвета индикатора, титрование прекращают – это конечная точка титрования. Иногда конечная точка титрования не совпадает с точкой эквивалентности. Причиной этого может быть, например, несовпадение момента изменения окраски индикатора с моментом эквивалентности (индикаторная погрешность). В этом случае для определения эквивалентного объема вводят поправку, которую вычисляют с учетом результатов контрольного опыта (подробнее об этом говорится ниже) или аналитически.
При косвенном титровании (иначе титровании заместителя) определяемое вещество стехиометрически реагирует со вспомогательным реагентом, а получающийся продукт оттитровывают. Например, при косвенном определении кальция его осаждают в виде оксалата, осадок растворяют в серной кислоте и оттитровывают связанную с кальцием щавелевую кислоту раствором пермангатата калия. При обратном титровании к анализируемому раствору добавляют точно известное заведомо избыточное количество титранта, и затем его избыток оттитровывают другим титрантом. Обратное титрование применяют, если реакция между определяемым веществом медленная, обратимая, нельзя подобрать подходящие индикаторы.
Для снижения погрешности при титриметрическом определении титрование проводят несколько раз. При этом по способу отбора титруемой пробы различают способ пипетирования и способ отдельных навесок. В случае способа пипетирования навеску пробы растворяют в мерной колбе и отбирают из нее мерной пипеткой несколько проб, называемых аликвотами. Каждую аликвоту затем титруют. В способе отдельных навесок взвешивают несколько порций анализируемого вещества, каждую независимо растворяют в воде или подходящем растворителе, не фиксируя точно его объем, и титруют приготовленные пробы.
Приготовление стандартных растворов
Концентрация титранта в количественном анализе должна быть известна с высокой точностью. Точность, с которой известна концентрация стандартного раствора, ограничивает точность метода в целом, поэтому приготовлению растворов уделяют много внимания.
По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точной навески вещества – первичного стандарта – в определенном объеме растворителя. Первичные стандарты должны удовлетворять следующим требованиям:
∙ в выбранных условиях эксперимента химическая формула соединения должна быть точно известна;
∙ вещество должно иметь высокую степень чистоты и должны существовать доступные и надежные методы, подтверждающие его чистоту;
∙ вещество должно быть устойчиво при комнатной температуре (непригодны вещества гигроскопичные, легко окисляющиеся кислородом воздуха или поглощающие углекислый газ);
∙ молярная масса эквивалента вещества должна быть по возможности велика, чтобы уменьшить влияние погрешности взвешивания.
Если вещество не удовлетворяет вышеперечисленным требованиям, из него можно приготовить только вторичный стандартный раствор. Для этого готовят раствор с концентрацией вещества, близкой к желаемой, и определяют его истинную концентрацию (стандартизируют) по подходящему первичному стандарту.
Удобным способом приготовления стандартных растворов является использование фиксаналов. Фиксанал – запаянная стеклянная ампула, изготовленная в соответствующих сертифицированных лабораторных условиях, которая содержит точно измеренное количество вещества. Выпускаются фиксаналы как твердых веществ (дихромат калия, тиосульфат натрия), так и жидких веществ и растворов (кислоты, раствор иода). Для приготовления стандартного раствора из фиксанала необходимо количественно перенести его в мерную колбу указанного на ампуле объема и довести до метки водой.
Дата: 2019-05-28, просмотров: 335.