Таутомерия пятичленных ароматических гетероциклических соединений является прототропной таутомерией и осуществляется обратимым переносом протона внутри молекулы из ее кислотного центра в основный. Перенос протона сопровождается перераспределением электронной плотности.
Для осуществления таутомерных превращений необходимо присутствие в молекуле достаточно активных как кислотного, так и основного центров. Поэтому среди незамещенных пятичленных ароматических гетероциклов прототропная таутомерия возможна для азотсодержащих циклов с двумя и более гетероатомами, например, для имидазола. Скорость переноса протона чрезвычайно велика и разделить таутомеры невозможно.
Схема прототропной таутомерии имидазола.
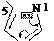
 основный кислотный
основный кислотный
 R 4 3
R 4 3
N
R H
 5 2 4 2
5 2 4 2
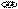 N 1 N 3
N 1 N 3
H
кислотный основный
4-алкилимидазол 5-алкилимидазол
Важным производным имидазола является α-аминокислота гистидин. Из-за прототропной таутомерии гистидин может быть представлен как 2- амино-3-[4(5)-имидазолил]- пропановая кислота.
Таутомерия гистидина:

 H3N
H3N
CH COO-

 H3N
H3N
CH COO-



 CH2
CH2
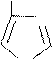 4 N 3
4 N 3
CH2 H
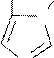 5 N 1
5 N 1

 5 2 4 2
5 2 4 2
 N 1 N 3
N 1 N 3
H
 |
В переносе протона в процессах таутомерии имеет значение межмолекулярная ассоциация, которая осуществляется образованием водородных связей между кислотным центром одних молекул и основным других:
N N H N N H N N H
8. 









 Реакции электрофильного замещения у пятичленных ароматических гетероциклов.
Реакции электрофильного замещения у пятичленных ароматических гетероциклов.
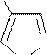
Реакции электрофильного замещения у пятичленных ароматических гетероциклов в общем аналогичны этому типу реакций у аренов. Они осуществляются по механизму SE через последовательное образование π- и σ- комплексов, а затем – продукта. У гетероциклов с одним гетероатомом электрофильное замещение происходит преимущественно в α-положение к гетероатому, поскольку α-замещению соответствует более устойчивый σ- комплекс. Однако замещение возможно и в β-положение, особенно, если α- положения уже заняты.
В молекулах имидазола электрофильное замещение происходит в положения 5(4), у пиразола – в положение 4, т.е. в положения, наиболее удаленные от пиридинового гетероатома.
Схемы электрофильного замещения в общем виде:
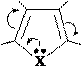
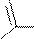
 H H b E
H H b E
E
H H a
-H+
E +
 X X
X X
образуется
преимущественно
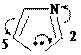 4 3
4 3

 N 1 H
N 1 H
 5 H
5 H
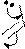
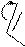 N 1
N 1
4 2
E+

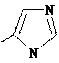 -H+ E
-H+ E

H
N
3
 4 3
4 3
N 2

 N 1 E
N 1 E
H E+
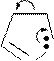 4
4
 3 N H
3 N H
N 2 1
-H+ N

 N
N
H
Механизм SE:
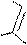 H H
H H
H H


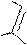

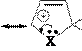


 E E+ a E E E
E E+ a E E E
H X H
H X H
замещение H
H X H
 p-комплекс
p-комплекс
b-замещение
a-s-комплекс более устойчив
 E
E
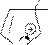
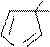 E E преимущественный продукт реакции
E E преимущественный продукт реакции
 H H
H H
 |
X X
a-s-комплекс менее устойчив
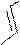 H
H
 X
X
Реакции электрофильного замещения у пятичленных ароматических гетероциклических соединений с одним гетероатомом (π-избыточные соединения) протекают с более высокой скоростью и более глубоко, чем у бензола. Но для проведения реакций нитрования, сульфирования и галогенирования ацидофобных гетероциклов необходимы, обычно, условия, исключающие присутствие сильной кислоты. Поэтому в качестве реагентов в реакциях, например, с фураном и пирролом используют: для нитрования -
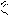 O
O
CH3-C
O-NO2 ацетилнитрат; для сульфирования – С5Н5N·SO3
пиридинсульфотриоксид; галогенирование проводят в присутствии пиридина или диоксана для связывания выделяющегося галогеноводорода.
Примеры реакций электрофильного замещения у ацидофобных гетероциклов:
реагент
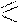
 O
O
CH3-C
O-NO2
-CH3COOH
NO2

 N
N
нитрование
субстрат
H 2-нитропиррол

 C5H5N SO3 -
C5H5N SO3 -
H SO3
сульфирование
 N -C5H5NH N
N -C5H5NH N
H H
анион
пиррол-2-сульфо -
кислота
 Br2, C6H5N
Br2, C6H5N
Br
 -[C5H5NH] Br N H
-[C5H5NH] Br N H
галогенирование


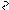
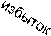 Br Br
Br Br
 Br N Br H
Br N Br H
2,3,4,5-тетрабромпиррол
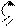 +d O
+d O
 CH3-C
CH3-C
 O
O
, SnCl4

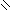

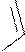
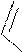 H3C C O
H3C C O

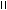 O
O
-CH3COOH C-CH3
O O
2-ацетилфуран
ацилирование
 Тиофен неацидофобен, поэтому в реакциях электрофильного замещения, обычно, не требует особых реагентов. Например, тиофен сульфируется концентрированной серной кислотой при комнатной температуре:
Тиофен неацидофобен, поэтому в реакциях электрофильного замещения, обычно, не требует особых реагентов. Например, тиофен сульфируется концентрированной серной кислотой при комнатной температуре:
 H2SO4 конц. SO3H
H2SO4 конц. SO3H
S S
тиофен-2-сульфокислота
Имидазол и пиразол – гетероциклические соединения с двумя гетероатомами – также неацидофобны. Их нитрование и сульфирование осуществляется обычными нитрующими и сульфирующими реагентами. Но для реакций необходимы условия более жесткие, чем у бензола, потому что
замещению предшествует образование катиона (положительно заряженный азот является сильным электроноакцептором).
Примеры реакций:
 H2SO4
H2SO4
|
 N
N
H
H
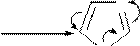

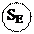 N
N
 H2SO4 конц.
H2SO4 конц.
N to
 H -H2O
H -H2O
H
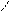

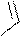
 N
N
HO3S

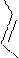 N H
N H
Br 2, NaOH
 N -NaBr,
N -NaBr,
H -H2O
Br
 |
N

 N H
N H
Ацилирование и алкилирование имидазола и пиразола происходят преимущественно по пиридиновому атому азота и осуществляются обычными ацилирующими и алкилирующими субстратами. В этих реакциях имидазол и пиразол являются нуклеофильными реагентами (реакции SN).
Примеры реакций:
 +d
+d
 CH3 I
CH3 I
 |
-I-
H
CH3
 N
N
 N -H+
N -H+
H
CH3

 N
N
N
 +d O
+d O
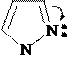

 CH3-C O O
CH3-C O O
Cl
 |
-Cl-
H
C-CH3

 N H
N H
-H+

 N C-CH3
N C-CH3
N
Реакции электрофильного замещения низкоароматичных пятичленных ароматических гетероциклов, таких как фуран, конкурируют с реакциями электрофильного присоединения АЕ, в ходе которых гетероцикл ведет себя как сопряженный диен. Часто продукты замещения образуются через стадию присоединения с последующим элиминированием. Например, в реакции галогенирования фурана возможны продукты как присоединения, так и замещения:

 H H
H H
Br Br 2
 Br Br
Br Br
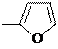

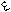 H O H
H O H
H H H H
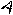
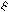 Br 2
Br 2
H H
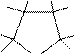 Br Br
Br Br
 H H
H H
Br O Br
Br O
Br
 -2HBr
-2HBr
 Br Br
Br Br
O
Дата: 2019-05-28, просмотров: 415.