1.1.3. Співвідношення невизначеностей. Межі використання
Законів класичної фізики.
1.1.1. Ядерна модель атома. Теорія Бора і її затруднення
До кінця 19-го сторіччя атом вважали неподільним. Однак відкриття цілого ряду нових фізичних явищ поставили це ствердження під сумнів. На початку 20-го сторіччя було висунуто кілька моделей будови атома. При допомозі цих моделей вчені пробували пояснити ряд незрозумілих експериментальних фактів - лінійність спектрів випромінювання газів при високій температурі, електричну нейтральність і стійкість атомів.
Першу спробу побудувати теорію будови атома в межах класичної фізики зробив у 1903 р. англійський фізик Д.Томсон. За гіпотезою Томсона атом уявлявся у вигляді сфери, яка рівномірно заповнена позитивним зарядом, в середині якої містяться електрони. Проте ця модель була неспроможна пояснити спектральні закономірності атомів. За цією гіпотезою число ліній у спектрі не повинно було перевищувати число електронів в атомі, тоді як в дійсності навіть у спектрі атома водню число ліній перевищувало 30. Крім того гіпотеза Томсона не спиралась на будь які дослідні дані.
Вирішальне значення для теорії будови атома мали досліди Резерфорда, який у 1913 році вивчав розсіяння пучка a - частинок при проходженні їх через тонку металеву фольгу. Ці досліди показали, що при проходженні через фольгу переважна більшість a- частинок зазнає дуже незначних відхилень, але знаходиться чимале число і таких частинок, які зазнають дуже великих відхилень на кут, більший 150°. Таке значне розсіяння a- частинок могло статися тільки під дією позитивного заряду атома. Електрони, маса яких майже у 8000 разів менша від a - частинки, не могли помітно вплинути на її рух. Проходження переважної більшості a- частинок вказували на те, що розміри позитивного заряду атома повинні бути значно меншими від розмірів атома. Знаючи заряд атома q = Ze можна було визначити для різних кутів розсіювання так звані прицільні відстані a - частинок від центрів атомів. Виявилося, що для золотої фольги для кутів розсіювання 150° прицільна відстань дорівнює 10-14м. Якщо на такій відстані a- частинка і атом не взаємодіють, то це може означати лише одне - розміри позитивно зарядженої частини атома не перевищують 10-15м.
Ці дослідні факти дали можливість Резерфорду описати ядерну модель атома: в центрі атома міститься позитивно заряджене ядро атома, розміри якого мають величину порядку 10-15м, навколо ядра по замкнутих орбітах в об’ємі сфери радіусом порядку 10-10м обертаються електрони, причому їх кількість дорівнює порядковому номеру елемента.
В такому вигляді ядерна модель атома зберегла своє значення і до нашого часу, хоч і зазнала багатьох уточнень.
На кожний рухомий електрон в атомі діє доцентрова сила ядра, яка дорівнює кулонівській силі притягання електрона до ядра. Ця сила забезпечує стійкий орбітальний рух електрона в атомі, подібно орбітальному руху планет в сонячній системі.
Однак планетарна модель атома незабаром виявилась неприйнятною. Дійсно, електрони рухаючись в атомі з доцентровими прискореннями, згідно теорії Максвелла повинні випромінювати енергію у вигляді електромагнітних хвиль, що робить атоми не стійкими. Насправді атоми досить стійкі і при невисоких температурах енергії не випромінюють і не поглинають. В той же час при високих температурах будь-які атоми, перебуваючи у газоподібному стані, випромінюють електромагнітні хвилі у вигляді лінійчатих спектрів.
Вихід із затруднень знайшов датський фізик Нільс Бор. В основу нової моделі атома була покладена планетарна модель Резерфорда. Бор висунув припущення, що рух електронів в атомі, випромінювання і поглинання атомами електромагнітних хвиль підпорядковуються не класичним законам, а квантовим.
Ці закони Бор сформулював у вигляді наступних постулатів:
1. Електрони, які рухаються в атомі на окремих стаціонарних рівнях, не випромінюють і не поглинають електромагнітних хвиль. В стаціонарних станах атома електрони рухаються вздовж колових орбіт, які мають дискретні значення моменту імпульсу.
m u rn= n 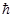 , (1.1)
, (1.1)
де m - маса електрона; u  - лінійна швидкість орбітального руху; rn - радіус n-ї колової орбіти; n - порядковий номер стаціонарного рівня - головне квантове число;
- лінійна швидкість орбітального руху; rn - радіус n-ї колової орбіти; n - порядковий номер стаціонарного рівня - головне квантове число; 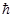 - стала Планка поділена на 2 p (
- стала Планка поділена на 2 p ( 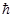 = h / 2 p ).
= h / 2 p ).
2. При переході електрона з однієї стаціонарної орбіти на іншу випромінюється або поглинається квант енергії
hn = En2 - En1 , (1.2)
який дорівнює різниці енергій двох стаціонарних рівнів атома .
Зміст формули (1.2) має принципове значення. Він виражає два нових фундаментальних ствердження:
а) енергетичний c спектр атома дискретний;
б) частоти атомного випромінювання пов’язані з атомними рівнями.
Величезна заслуга Нільса Бора перед наукою полягає в тому, що він вперше усвідомив дискретність енергетичного спектра атома. Історичний дослід Франка і Герца був першою дослідною перевіркою цих передбачень.
Однак теорія Бора має ряд внутрішніх протиріч:
З одного боку в ній використовуються закони класичної фізики, а з іншого боку вона базується на квантових постулатах. Так результати теорії вивчення випромінювання атома водню і воднево подібних атомів блискуче співпали з експериментом. Теорія Бора також пояснила причину випромінювання лінійчатих спектрів складними атомами, періодичний закон Менделєєва і закон Мозлі. Однак залишалось не виясненим: Чому рух електронів в атомах підпорядкований двом постулатам Бора? Чому одні лінії спектра досить інтенсивні, а інші ні? Чому здійснюються лише певні переходи електронів в атомах при випромінюванні і поглинанні ними енергії?
Досить значним недоліком теорії Бора була неможливість описати з її допомогою будову атома гелію, наступного за атомом водню елемента.
Відповіді на поставлені запитання дала квантова механіка, в якій на принципово новій основі установлені закономірності руху електронів в атомах і будь-яких частинок в інших системах.
Дата: 2019-05-28, просмотров: 311.