Сукупність електронів, які перебувають у всіх можливих станах з однаковим значенням головного квантового числа n, утворює електронну оболонку (електронний шар). Енергетичні шари прийнято позначати великими латинськими літерами відповідно до значень головного квантового числа.
Найближче до ядра в будь-якому атомі розташований К-шар, для якого n=1. Далі йдуть L- шар (n=2), M- шар (n=3), N- шар (n=4) тощо. Кількість електронів в шарі визначається формулою
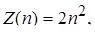 (2.2.1)
(2.2.1)
де n - головне квантове число.
Згідно формули (2.2.1), в К-шарі міститься не більше двох електронів (два s- електрони); в L- шарі не більше восьми електронів (з них два в s- стані і шість в p-стані); в М-шарі не більше вісімнадцяти електронів (з яких два в s-стані, шість в р-стані і десять в d-стані) і т. д. Число електронів в тому чи іншому квантовому стані визначається за формулою
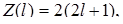 (2.2.2)
(2.2.2)
де l- орбітальне квантове число.
Згідно формули (2.2.2), в s-стані перебуває не більше двох електронів (l=0); в p-стані перебуває не більше шeсти електронів (l=1); в d- стані перебуває не більше десять електронів (l=2); в f- стані не більше чотирнадцяти електронів (l =3), тощо.
Для станів з фіксованими квантовими числами n і l використовують позначення типу 1s,2s,2p і т.д.: значення n вказується цифрою, яка стоїть зліва від букви, що вказує значення числа l. Як уже було відмічено в кожній такій групі є 2(2l+1) станів. Вони відрізняються один від одного значеннями магнітного квантового числа ml - значення спінового квантового числа можуть бути лише ms=1/2 і ms=-1/2.
Наприклад, у кожного стану із групи 1s орбітальне квантове число l=0, так що група 1s містить лише два окремі квантові стани. В цих станах
n=1, l=0, ml=0, ms=1/2,
n=1, l=0, ml=0, ms=-1/2.
Група 2s також містить два стани, оскільки в ній також l=0; група 2p містить уже 2(21+1)=6 станів. В цих станах:
n=2, l=1, ml=1, ms=1/2,
n=2, l=1, ml=1, ms=-1/2,
n=2, l=1, ml=0, ms=1/2,
n=2, l=1, ml=0, ms=-1/2,
n=2, l=1, ml=-1, ms=-1/2,
n=2, l=1, ml=-1, ms=-1/2.
Аналогічно можна показати, що в d- стані число електронів не може перевищувати 10 електронів; в f- стані - не більше 14 електронів.
Розподіл електронів за одночастинковими станами називається електронною конфігурацією. Електронні конфігурації позначаються символами типу 1s2 2s2 2p6 3s2. Тут цифрою над s i p справа, указують число електронів в станах 1s, 2s, 2p i 3s.
Якщо шар повністю заповнений то він називається замкнутим.
Кожен період таблиці Менделєєва починається елементом, який перебуває в стані 1s1, 2s1, 3s1, і т.д. Закінчується період елементом з повністю заповненим зовнішнім електронним шаром.
Процес забудови електронних оболонок у елементів перших двох періодів таблиці Менделєєва показано нижче:
1H - 1s1
2He - 1s2
3Li - 1s22s1
4Be – 1s22s2
5B - 1s22s22p1
6C - 1s22s22p2
7N - 1s22s22p3
8O - 1s22s22p4
9F - 1s22s22p5
10Ne –1s22s22p6
18Ar – 1s22s22p63s23p6
36Kr – 1s22s22p63s23p63d104s24p6
Електронні оболонки в інертних газів є повністю заповненими.
Періодичність властивостей атомів пояснюється періодичністю заповнення їх електронних оболонок, яка випливає з принципу Паулі. Періодичність у фізичних властивостей окремих хімічних елементів виявляється насамперед в структурі лінійчатих спектрів, які випромінюють атоми цих елементів. Подібність спектрів лужних металів обумовлена подібністю забудови зовнішніх електронних оболонок. Це пояснюється тим, що оптичні лінійчаті спектри випромінюються електронами зовнішніх електронних оболонок. Періодичність властивостей хімічних елементів проявляється також і в електричних властивостях атомів.
В основі періодичного закону лежить не лише уявлення про періодичну залежність властивостей елементів, а й уявлення про закономірний зв’язок між властивостями елементів у кожному періоді і в кожній групі періодичної системи, а також всередині цієї системи по діагональних напрямках. Саме цей закономірний зв’язок між кількісними і якісними характеристиками елементів, вперше відкритий і досліджений Менделєєвим, дав змогу йому передбачити існування і властивості невідомих на той час хімічних елементів.
Періодичний закон став одним з основних законів природознавства, які становлять фундамент сучасного фізичного вчення про будову матерії.
2.2.4. Рентгенівські промені. Суцільний спектр і його межі. Характеристичний спектр. Закон Мозлі.
Випромінювання, яке було відкрите в 1895 році німецьким фізиком Рентгеном і пізніше назване на його честь рентгенівським відіграє велику роль у дослідженнях будови електронних оболонок і властивостей складних атомів, при вивченні будови молекул, а особливо твердих тіл.
Рентгенівське випромінювання виникає при гальмуванні речовиною швидких електронів внаслідок перетворення кінетичної енергії цих електронів в електромагнітне випромінювання. Довжини хвиль рентгенівського випромінювання перебувають в межах від 0.01 до 80 нм.
Для одержання рентгенівського випромінювання використовують рентгенівські трубки. Вони мають скляний або металевий корпус в якому вмонтовано катод і анод і створено глибокий вакуум. Катод рентгенівської трубки є джерелом електронів, а анод - джерелом рентгенівського випромінювання. Між катодом і анодом створюють електричне поле, яке здатне прискорювати електрони до 104 - 105 еВ.
Досліди показують, що при бомбардуванні високо енергетичними електронами тіло аноду виникають два типи рентгенівського випромінювання. Перший тип називають білим, власний спектр якого є суцільним, подібним до спектру білого світла. Біле рентгенівське випромінювання утворюється при гальмуванні швидких електронів тілом анода. Тому це випромінювання називають ще гальмівним. Гальмівний рентгенівський спектр має короткохвильову межу lmin, яка визначається величиною анодної напруги, прикладеної між катодом і анодом.
Завдяки випадковому характеру зіткнень електронів з атомними оболонками анода, втрати енергії електронів на теплоту і випромінювання розподіляються довільно. Тому енергія фотонів гальмівного випромінювання може бути різною, а його спектр - суцільним.
При підвищенні напруги на рентгенівській трубці інтенсивність випромінювання зростає. Примітним також є те, що спектр рентгенівського випромінювання при всякій напрузі в короткохвильовій частині різко обривається (рис.2.7).

Рис. 2.7
Для короткохвильової межі гальмівного спектра маємо
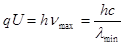 . (2.2.3)
. (2.2.3)
Звідки
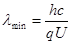 , (2.2.4)
, (2.2.4)
де h - стала Планка; с - швидкість світла; q - заряд електрона U - анодна напруга. Формула (2.2.4) добре узгоджується з дослідними даними. В свій час вона виявилась одним з найточніших методів експериментального визначення сталої Планка. Це співвідношення добре збігається з рівнянням Ейнштейна для фотоефекту, якщо в ньому знехтувати роботою виходу електрона з металу.
Другим типом випромінювання є характеристичне рентгенівське випромінювання. Його називають так через те, що воно характеризує речовину анода рентгенівської трубки. Спектр характеристичного рентгенівського випромінювання - лінійчатий. Особливість цих спектрів полягає в тому, що кожний хімічний елемент дає певний характеристичний рентгенівський спектр незалежно від того, чи збуджується атом у вільному стані, чи він входить до хімічної сполуки. Спектр характеристичного рентгенівського випромінювання істотно відрізняється від оптичних електронних спектрів тих же атомів. Вплив хімічного зв’язку на оптичні спектри досить значний, так як оптичні спектри випромінюються якраз валентними електронами. В той же час характеристичне рентгенівське випромінювання здійснюється електронами глибоких енергетичних рівнів.
В 1913р.Англійський фізик Мозлі встановив закон, який виражає частоти у характеристичних спектрах речовини залежно від її атомного номера, а саме:
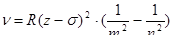 , (2.2.5)
, (2.2.5)
де R - стала Рідберга в,с-1; m і n - номери числа рівнів, між якими здійснюється перехід електрона; s - стала екранування, яка зберігає своє значення в межах даної серії для всіх елементів. Для К-серії s=1; для L- серії s=7.5 і т.д.
Інколи закон Мозлі пишуть в такій формі
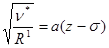 , (2.2.6)
, (2.2.6)
де n*=1/l - хвильове число; R1 - стала Рідберга в м-1; 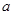 - стала величина; s - стала екранування.
- стала величина; s - стала екранування.
Для довжини хвиль, які характеризують переходи електронів на Кa рівень Мозлі дістав таке співвідношення
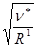 =
= 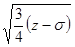 (2.2.7)
(2.2.7)
Співставляючи (2.2.6) і (2.2.7), маємо, що для цих ліній
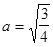 і s=1.
і s=1.
Застосування закону Мозлі до атомів хімічних елементів періодичної системи Менделєєва підтвердило закономірне зростання електричного заряду ядра на одиницю при послідовному переході від одного елемента до іншого.
Молекула
Дата: 2019-05-28, просмотров: 297.