Молекули складаються з однакових або різних атомів, сполучених між собою в одне ціле міжатомними зв’язками. Саме існування молекул як стійких систем показує, що хімічні зв’язки атомів у молекулах повинні бути зумовлені наявністю між атомами деяких сил взаємодії, що зв’язує атоми в молекулах один з одним. Для роз’єднання молекули на атоми слід виконати певну роботу. Це підтверджує факт виділення енергії при утворенні молекули. Так, наприклад, два атоми водню у вільному стані мають більшу енергію ніж ті самі атоми, сполучені в двохатомну молекулу. Це є доказом наявності сил, які зв’язують атоми в молекулах, причому енергія, яка виділяється при утворенні молекули, є мірою тих сил взаємодії.
Експерименти показують, що сили міжатомної взаємодії в молекулах виникають між зовнішніми, валентними електронами атомів. Про це свідчить різка зміна оптичного спектра атомів при утворенні ними молекул і, навпаки, збереження особливостей рентгенівського характеристичного спектра атомів незалежно від того чи атоми вільні чи утворюють молекулярні сполуки.
Важливо відмітити, що атоми на значних відстанях не взаємодіють один з одним. Із зменшенням відстані r між ядрами атомів зростають сили взаємного притягування. Проте ці сили не єдині. На малих відстанях між атомами виникають сили взаємного відштовхування, величина яких різко зростає в момент перекриття електронних оболонок. Сили відштовхування більш короткодіючі, ніж сили притягування. На рис.2.8 наведено криві залежності від відстані r сил притягування F2 ; відштовхування F1 і результуючої сили F взаємодії атомів у такій молекулі, причому сили відштовхування вважаються додатними.

Рис. 2.8
Bнаслідок протилежної дії сил F1 i F2 на деякій відстані r0 між атомами обидві сили врівноважуються і її геометрична сума стає рівною нулю. На цій відстані найменша взаємна потенціальна енергія W(r) атомів двохатомної молекули. На рис. 2.9 зображено криву залежності від r потенціальної енергії W(r) взаємодії двох атомів у молекулі.

Рис. 2.9
Величина D (на рис. 2.9) чисельно дорівнює роботі, яку потрібно виконати, щоб розірвати зв’язки атомів у молекулі, тобто роз’єднати молекулу на атоми. Цю роботу ще називають енергією дисоціації молекули або енергією зв’язку. Зрозуміло, що при утворенні молекули з окремих атомів така енергія повинна звільнитись.
Нехай один із атомів в результаті взаємодії приєднує до себе один або кілька електронів стає негативним іоном, а інший атом, віддає відповідну кількість електронів і перетворюється в позитивний іон. Такі атоми за рахунок електростатичного притягування утворюють молекулу. Молекули, в яких здійснюється такий тип зв’язку називають іонними або гетерополярними молекулами.
Однак більшість молекул в природі утворенні із електрично нейтральних атомів. Хімічний зв’язок, який здійснюється між електрично нейтральними атомами в молекулі називають ковалентним, або гемополярним. Природу ковалентного зв’язку вдалось з’ясувати лише на основі квантової механіки.
Зупинимось більш детально на механізмі утворення іонних молекул. Типовим прикладом такої молекули є кухонна сіль NaCl. Метали першої групи таблиці Менделєєва мають порівняно невеликі величини потенціалу іонізації. Так для натрію потенціал іонізації становить 5.1 еВ. З другого боку електронна спорідненість атома хлору має значну величину, порядку 3.8 еВ. Перехід електрона від атома Na до атома Cl приводить до утворення іонів Na+ i Cl-, які притягуючись між собою за допомогою електростатичних сил, утворюють стійку молекулу з іонним зв’язком. Електростатичне притягування між іонами Na+ i Cl- на певній відстані зрівноважується електростатичним відштовхуванням оболонок обох іонів. Іонний зв’язок не може бути насиченим.
Порівняння потенціалу іонізації атомів натрію і електронної спорідненості атомів хлору показує, що майже завжди величина еj енергії іонізації трохи перевищує електронну спорідненість. Для кухонної солі це перевищення становить 1.3 еВ. Отже електрон від атома натрію не може самочинно перейти до атома хлору. В той же час, при утворенні молекули NaCl енергія виділяється. Пояснити цей процес можна лише значним зближенням іонів, від чого виділяється електростатична енергія їх взаємодії. Утворення іонів і їх зближення - це єдиний процес, який відбувається одночасно і лише після того, як атоми так наблизилися, що разом з утворенням іонів виділяється потрібна для цього кількість енергії.
Ковалентний хімічний зв’язок здійснюється між нейтральними атомами. Цей зв’язок має властивість насичення. Атом водню може вступити у взаємодію лише з одним атомом водню. Атом вуглецю може при взаємодії зв’язати лише чотири атома водню і т.д.
Таким чином, насичення ковалентних зв’язків є істотно не класичним ефектом. Можливість його пояснення за допомогою гравітаційних сил в цьому випадку повністю виключається.
Кількісну теорію ковалентного зв’язку, стосовно молекули водню, розробили Гейтлер і Лондон у 1927р. на основі квантової механіки. Розглянемо два атоми водню, ядра яких перебувають у точках 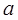 і
і 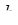 на відстані R. Якщо відстань R дуже велика, то атоми не взаємодіють і повна енергія системи із двох атомів водню дорівнюватиме подвійній енергії основного стану атома водню, тобто:
на відстані R. Якщо відстань R дуже велика, то атоми не взаємодіють і повна енергія системи із двох атомів водню дорівнюватиме подвійній енергії основного стану атома водню, тобто:
W=2W1,
де 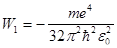 .
.
При наближенні атомів між ними виникає взаємодія, яка характеризується деякою енергією Wp( R ), що залежить від відстані між атомами. Загальна енергія тоді буде рівною
W=2W1+WP ( R ). (2.3.1)
Якщо R®¥, то Wp(R)®0. При наближенні двох атомів водню один до одного Wp(R) спочатку буде зменшуватись від 0 (при R=¥) до деяких від’ємних значень (при скінчених R), що відповідає притяганню атомів. Потім при зменшенні R Wp(R) буде зростати, що відповідає відштовхуванню атомів. Такий характер зміни Wp(R) не залежить від природи хімічного зв’язку і показаний на рис. 2.9.
На рис. 2.10 зображено електронні хмари двох атомів водню, які при скінченній відстані R між ядрами частково перекриваються.
Обидва електрони в молекулі водню є тотожні й нерозрізнені частинки. Згідно принципу Паулі при переміні місцями цих електронів система не зміниться.

Рис. 2.10
Однак стан такої системи в квантовій механіці може визначатись або симетричною або антисиметричною хвильовою функцією. В цьому випадку хвильова функція повинна бути обов’язково антисиметричною. При цьому енергія взаємодії Wp(R) буде визначатись з урахуванням обох можливих станів молекули водню за формулою:
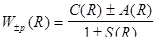 , (2.3.2)
, (2.3.2)
де знак плюс стосується випадку опису стану молекули симетричною координатною хвильовою функцією, а мінус - антисиметричною координатною функцією.
Безрозмірний інтеграл S(R) називають інтегралом перекривання; він характеризує перекривання електронних хмар при наближенні атомів один до одного. При R®¥, коли атоми не взаємодіють, інтеграл S(R) перетворюється в нуль. Найбільшого значення S(R)=1 цей інтеграл досягає при R=0, коли обидва атоми сумістяться своїми ядрами і оболонками. Зрозуміло, що таких випадків не буває. В молекулі водню Н2 інтеграл S(R) має додатне значення менше за одиницю. На знак енергії Wp(R) інтеграл S(R) не впливає.
Інтеграл C(R) називають кулонівським інтегралом. Він характеризує кулонівську взаємодію ядер і електронів у молекулі Н2. Найбільший інтерес становить інтеграл А(R) , який називають обмінним інтегралом. Наявність цього інтеграла пов’язана з нерозрізненістю електронів у молекулі і можливістю їх перестановки місцями. Інтеграл А( R ) має розмірність енергії і характеризує особливу квантово-механічну взаємодію, яка виникає між двома тотожними електронами, і яку умовно називають «обмінною взаємодією». «Обмінну взаємодію» електронів в молекулі водню розуміють так, що електрон кожного із її атомів періодично перебуває то біля одного атома, то біля іншого атома, здійснюючи тим самим зв’язок обох атомів. Сили, які проявляються при цьому, називають «обмінними».
Розрахунки показують, що на великих відстанях R C(R) i A(R) мають зникаюче мале значення. На великих відстанях взаємодія між окремими атомами водню відсутня. На середніх відстанях, співрозмірних з борівським радіусом водневого атома, обидва інтеграли C(R) i A(R) є від’ємні, причому çA(R)ç>çC(R)ç. Тому енергія в формулі (2.3.2) матиме такі два значення:
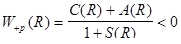 ;
; 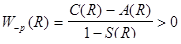 . (2.3.3)
. (2.3.3)
Перше з них W+p(R) відповідає притяганню і характеризує стійкий стан молекули водню. Друге W-p(R) відповідає відштовхуванню і визначає нестійкий стан молекули. Для стійкого стану молекули, координатна хвильова функція є симетричною, а спіни електронів повинні бути антипаралельними. Лише в такому випадку за принципом Паулі повна хвильова функція буде антисиметричною*. У нестійкому стані молекули водню координатні хвильові функції є антисиметричними. Для збереження антисиметричного характеру повної хвильової функції необхідно щоб спіни електронів в обох атомах молекули були паралельними.
*Y( r ) - координатна хвильова функція
Y( r,q,j ) - повна хвильова функція.
2.3.2. Енергетичні рівні молекул. Молекулярні спектри. Парамагнітний резонанс.
У попередніх лекціях були розглянуті спектри атомів, що складаються з окремих ліній, які утворюють серії. В середині кожної серії атомного спектра спектральні лінії розміщені на різніх відстанях одна від одної, при чому до межі кожної із серій вони зближуються. Молекулярні спектри вже за зовнішнім виглядом значно відрізняються від атомних. Молекулярні спектри являють собою широкі смуги, які утворені досить тісно розміщеними окремими лініями. Короткохвильовий край кожної із смуг має розмитий характер. Це пов’язано з тим, що окремі спектральні лінії так близько розміщені одна від одної, що сучасними спектральними приладами вже не розділяються.
Молекулярні спектри за їх характерний вигляд називають смугастими спектрами. Смуги і групи смуг молекулярних спектрів розміщуються як в інфрачервоній, видимій, так і в ультрафіолетовій області довжин електромагнітних хвиль. З ускладненням молекул ускладнюються і їх молекулярні спектри. В досить складних молекул в різних областях довжин хвиль спостерігаються суцільні широкі смуги поглинання або випромінювання.
Розглянемо механізм утворення молекулярних спектрів. Повна енергія молекули W може бути розглянута, як суперпозиція: Wпост - енергії поступального руху центра інерції молекули; Wел - енергії руху електронів в атомах молекули; Wкол - енергії коливального руху ядер атомів, що входять до складу молекули, біля їх положення рівноваги; Wоб - енергії обертального руху молекули як цілого; Wяд - енергія ядер атомів у молекулі. Тобто
W = Wпост+ Wел+ Wкол+ Wоб+ Wяд. (2.3.4)
Енергія Wпост не квантується, тому її зміна на молекулярні спектри не впливає. Енергія, пов’язана з впливом ядра Wяд на процеси в молекулі, досить мала й істотної ролі не відіграє. Тому надтонка структура в молекулярних спектрах пов’язана з впливом ядра, практично нехтується. Тому енергія молекули, яка визначає її оптичні властивості, складається з суми трьох доданків:
W1=Wел+Wкол+Wоб (2.3.5)
За правилом Бора частота n кванта, який випускає молекула при зміні її енергетичного стану дорівнює:
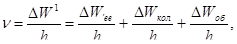 (2.3.6)
(2.3.6)
де DWел, DWкол, DWоб - зміни відповідних частин енергії молекули.
Оскільки кожний з доданків (2.3.5) набуває ряду дискретних квантових значень, тобто їх зміни також мають дискретні значення і тому спектр молекул складається з густо розміщених спектральних ліній. Як показують досліди і теоретичні розрахунки, зміни енергій DWел, DWкол, i DWоб мають різну величину
DWоб<<DWкол<<DWел.
Для виділення частот, які відповідають змінам різних видів енергії в молекулі зручніше розглянути її спектр поглинання. Припустимо, на речовину, яка складається з молекул, що не взаємодіють між собою, падає довгохвильове випромінювання з мало енергетичними квантами hn. До тих пір, доки енергія кванта hn не стане рівною найменшій різниці енергії між двома найближчими енергетичними рівнями молекул, поглинання не буде. Поглинання настане при довжинах хвиль зовнішнього опромінення порядку (0.1-1) мкм, тобто в далекій інфрачервоній області спектра. Кванти енергії таких хвиль можуть перевести молекулу з одного обертального енергетичного рівня на інший, вищий. А це призведе до виникнення спектра поглинання.
Довжини хвиль в кілька мікрон мають енергію, з допомогою якої можна збуджувати відповідні переходи коливальних рівнів. В цьому випадку будуть також збуджуватись відповідні обертальні рівні. Виникне коливально-обертальний спектр (рис.2.11).

Рис. 2.11
У видимій і ультрафіолетовій області енергії квантів достатньо для збудження в молекулах переходів між відповід-ними електронними рівнями.

Рис. 2.12
Одночасно з цими переходами будуть збуджуватись коливальні і обертальні енергетичні рівні. Це дасть можливість одержати електронно-коливальний спектр, який показано на (рис.2.12).
Отже, кожному електронно-коливальному переходу відповідатиме певна смуга, тому весь електронно-коливальний спектр у видимій і близькій до неї області є системою з кількох груп смуг, розміщених в цих ділянках спектра.
У 1996р. Зеєман знайшов, що коли джерело світла помістити між полюсами електромагніту, відбувається розчеплення спектральних ліній, а відповідно і атомних рівнів речовини джерела, на ряд компонентів. Цей ефект було названо на честь Зеємана - зеєманівським.
Якщо направити промінь світла перпендикулярно до напрямку силових ліній магнітного поля, то спектральні лінії частотою n0 симетрично розчеплюються на три компоненти n0+Dn, n0 і n0-Dn.
Ефект Зеємана (нормальний) спостерігається лише у парамагнітних атомів, так як лише ці атоми мають нульовий орбітальний магнітний момент і можуть взаємодіяти із зовнішнім магнітним полем.
Відстань між середньою і крайніми лініями зеєманівського розчеплення виявляється рівною
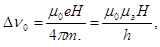
де 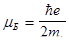 - магнетон Бора; m0 - магнітна стала; h - стала Планка.
- магнетон Бора; m0 - магнітна стала; h - стала Планка.
Нормальний ефект Зеємана пов’язаний з розчепленням атомних рівнів і відповідно спектральних ліній завдяки взаємодії орбітальних магнітних моментів з зовнішнім магнітним полем. У випадку слабих магнітних полів можна спостерігати розчеплення пов’язане із взаємодією спінових магнітних моментів електронів. В цьому випадку ефект Зеємана називається аномальним. З ним пов’язана тонка структура спектральних ліній.
При типічних для лабораторних умов значеннях магнітного поля в 1 Тл енергія зеєманівського розчеплення рівнів DЕ»0.5.104 еВ. Цій енергії відповідає частота
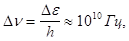
яка перебуває в мікрохвильовому діапазоні радіохвиль. Тому в магнітних полях порядку 1Тл зеєманівські рівні можна збуджувати за допомогою радіочастотного випромінювання.
В парамагнітному середовищі такі переходи приводять до електронного парамагнітного резонансу, який вперше спостерігався Завойським у 1944р.
Електронний парамагнітний резонанс полягає в поглинанні парамагнітною речовиною, яка перебуває в магнітному полі, енергії радіочастотного випромінювання.
Використання електронного парамагнітного резонансу пов’язане з вивченням властивостей парамагнітних речовин. В цьому випадку визначаються магнітні моменти атомів, резонансні частоти, орбітальне квантове число. Якщо ці параметри відомі, то можна вимірювати величину індукції магнітного поля. Магнітометри, які працюють на явищі парамагнітного резонансу, широко використовуються.
2.3.3 Комбінаційне розсіювання світла.
Комбінаційне розсіювання світла було відкрите в 1928 р. індійськими фізиками Раманом і Кришнаном. Одночасно над цим явищем працювали російські фізики Ландсберг і Мандельштам. В сучасній зарубіжній літературі комбінаційне розсіювання називається раманівським.
Суть комбінаційного розсіювання полягає в тому, що в спектрі розсіяного монохроматичного світла, після проходження його через гази, рідини або прозорі кристалічні тіла, поряд незміщених спектральних ліній містяться нові лінії, частоти яких є комбінацією частот n0 і nі коливних або обертальних переходів розсіюванних молекул:
n=n0±nі.
Комбінаційне розсіювання, як і всі інші явища взаємодії світла з речовиною, має квантовий характер. Нехай молекула розсіюваної речовини може знаходитися в ряді коливальних енергетичних станів W0, W1, ... ,Wi,...,а нормальний стан молекули відповідає енергії W0. При взаємодії такої молекули з квантом зовнішнього випромінювання енергією e0=hn0, молекула може виявитись в більш високому енергетичному стані з енергією Wi. На цей перехід буде затрачена енергія DW=Wi-W0. Тому енергія фотона зменшиться на величину DW; в той же час появиться новий фотон (розсіяний) з енергією
e = h n =h n 0 - D W .
З останньої рівності видно, що
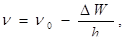 (2.3.7)
(2.3.7)
де 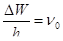 - частота, якій відповідає перехід між рівнями W0 i Wi. Тому n = n 0 - n і , що відповідає появі «червоного» супутника. Поява фіолетового супутника пояснюється взаємодією падаючого фотона частотою n0 з молекулою, яка перебуває у збудженому стані з енергією Wi. Взаємодія падаючого фотона з молекулою в збудженому стані стимулює її перехід в нормальний енергетичний стан. Тому:
- частота, якій відповідає перехід між рівнями W0 i Wi. Тому n = n 0 - n і , що відповідає появі «червоного» супутника. Поява фіолетового супутника пояснюється взаємодією падаючого фотона частотою n0 з молекулою, яка перебуває у збудженому стані з енергією Wi. Взаємодія падаючого фотона з молекулою в збудженому стані стимулює її перехід в нормальний енергетичний стан. Тому:
e = h n 0 + D W ,
звідки n = n 0 + n / - фіолетовий супутник.
Очевидно, що число молекул у збудженому стані буде зростати з підвищенням температури. А це сприяє зростанню інтенсивності фіолетових супутників. Указані висновки добре погоджуються з експериментом.
Комбінаційне розсіювання є важливим методом вивчення власних частот коливань в складних молекулах, особливо в органічних сполуках. В останні роки цей метод є невід’ємною частиною молекулярного спектрального аналізу.
Дата: 2019-05-28, просмотров: 313.