Результаты измерений
Таблица 1.
АДСОРБЕНТ
АДСОРБАТ
ДО АДСОРБЦИИ
ПОСЛЕ АДСОРБЦИИ
Со – расчетная концентрация кислоты до адсорбции, моль/л (считать по уравнению 7).
Сщ – концентрация титрующей щелочи, моль/л.
Сравн – расчетная концентрация кислоты после адсорбции, моль/л (считать по уравнению 7).
Vк – объем кислоты для титрования, мл.
Vщ – средний объем щелочи, пошедший на титрование, мл.
V’к – объем фильтрата кислоты для титрования, мл.
V’щ – средний объем щелочи, пошедшей на титрование, мл.
Результаты расчетов
Таблица 2.
|
№ | Со, моль/л | Сравн, моль/л | a, моль | в, моль | x, моль | (x/m)экс, моль/кг |
lg(x/m)экс |
lgCравн |
lg(x/m)теор |
lgCтеор |
| (ур-е 7) | (ур-е 7) | (ур-е 5) | (ур-е 6) | (ур-е 8) | (ур-е 9) | |||||
| 1 | ||||||||||
| 2 | ||||||||||
| 3 | ||||||||||
| 4 | ||||||||||
| 5 | ||||||||||
| 6 |
Используя данные таблицы 2 начертить на миллиметровой бумаге изотерму адсорбции уксусной кислоты в координатах (x/m)экс=f(Cравн) и lg(x/m)экс=f(lgCравн).
По графику lg(x/m)экс=f(lgCравн) определяют значение lgk, k, tga=1/n. При расчете tga катеты треугольника выражают в тех величинах, которые отложены на осях координат, т.е. lg(x/m) и lg(Cравн). Графически определенные константы lgk и 1/n подставляют в уравнение 3.
Для проверки применимости уравнения 3 к адсорбции органических кислот из растворов на угле строят график lg(x/m)теор=f(lgCтеор). Для его построения на графике lg(x/m)экс=f(lgCравн) выбирают несколько значений концентраций вне области исследования (т.е. по обе стороны от экспериментального графика). Выбранные значения lgCтеор подставляют в уравнение 3 и рассчитывают lg(x/m)теор. Строят график lg(x/m)теор=f(lgCтеор) и делают вывод о концентрационных пределах применимости уравнения Фрейндлиха к адсорбции уксусной кислоты на угле.
В отчете должны быть приведены названия ПАВ, температура опыта, примеры расчетов концентрации растворов ПАВ до и после адсорбции, удельной адсорбции х/m, коэффициентов уравнения Фрейндлиха k и n, таблицы 1 и 2. К отчету прилагают графики x/m=f(C), lg(x/m)эксп=f(lgCравн), lg(x/m)теор=f(lgCтеор).
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. Что такое адсорбция, адсорбент, адсорбат (адсорбтив)?
2. Что такое изотерма адсорбции?
3. Какова природа сил, обуславливающих адсорбцию? Виды адсорбции, привести примеры.
4. Как изменяется адсорбция в зависимости от концентрации разбавленных растворов в соответствии с законом Генри?
5. В каких случаях справедливо уравнение Фрейндлиха и как графически определить коэффициенты этого уравнения?
6. Проанализируйте уравнение Ленгмюра для различных концентраций адсорбтива.
7. Как рассчитать адсорбцию из раствора на твердом адсорбенте?
ЛАБОРАТОРНАЯ РАБОТА № 3
Измерение поверхностного натяжения и исследование поверхностной активности в гомологическом ряду
Цель работы
Исследовать влияние строения молекул ПАВ на их поверхностную активность.
Задачи работы
1. Определить зависимость поверхностного натяжения растворов ПАВ одного гомологического ряда от концентрации.
2. Построить изотермы поверхностного натяжения растворов: этанола, пропанола, бутанола.
3. Рассчитать коэффициент Траубе.
4. Определить размеры молекул ПАВ.
Приборы и материалы
· Приборы для измерения поверхностного натяжения.
· Конические колбы емкостью 50 мл - 15 штук.
· Растворы этилового, пропилового, бутилового спиртов.
· Пипетки на 5, 10 мл.
· Мерный цилиндр 10, 20 мл.
· Фильтровальная бумага.
ТЕОРЕТИЧЕСКОЕ ПОЯСНЕНИЕ
Границы раздела фаз характеризуются удельной энергией Гиббса поверхности. Удельной называют поверхностную энергию, приходящуюся на единицу поверхности фазовой границы. Эта величина численно равна поверхностному натяжению s. Поверхностное натяжение измеряют в Дж/м2 или Н/м. Способность веществ изменять при растворении поверхностное натяжение растворителя называют поверхностной активностью. Вещества, понижающие поверхностное натяжение жидкостей (ПАВ), имеют наибольшее практическое значение.
Для всех ПАВ характерно наличие в молекуле полярной и неполярной частей (дифильность), благодаря чему такие молекулы (или ионы) адсорбируются на границах раздела вода - воздух, вода - органическая жидкость, жидкость -твердое тело.
Количественно поверхностную активность выражают производной вида
G= -(ds/dC)C®0 (1)
Она численно равна понижению поверхностного натяжения раствора при изменении концентрации ПАВ на единицу. Символ «C®0» означает, что производная s по С должна быть взята в области бесконечно разбавленных растворов. При этом условии величина поверхностной активности максимальна.
Единицами измерения поверхностной активности являются Дж×м/моль и Н×м2/моль. Поверхностную активность обычно определяют графически по зависимости s=f(C), которую называют изотермой поверхностного натяжения (рис. 1). Для построения графика необходимы данные измерений s для растворов различной концентрации при постоянной температуре.
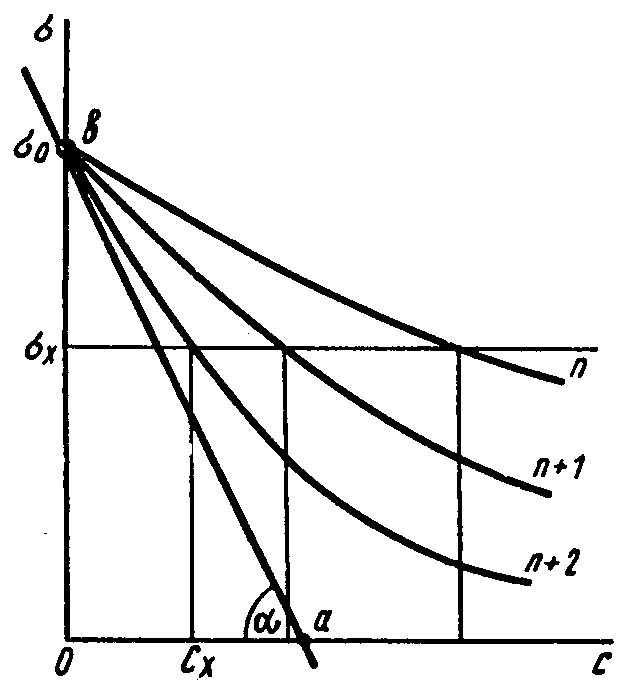
Рис.1. Изотермы поверхностного натяжения водных растворов трех гомологов с числом атомов углерода в молекуле n, n+1, n+2. Графическое определение поверхностной активности.
Поверхностная активность органических соединений зависит от размера и строения их углеводородного радикала. Отношение поверхностных активностей двух ближайших гомологов называют коэффициентом Траубе (b):
b=Gn+1/Gn (2)
Для каждой границы раздела величина b примерно постоянна в пределах ряда. Например, для системы вода-воздух b лежит в пределах 3-3,5, для системы вода- предельный углеводород b=4-4,2.
Для экспериментального определения величины b необходимо иметь изотермы поверхностью натяжения двух или трех гомологов. Расчет коэффициента b проводят различными способами: а) по формуле (2); б) по отношению равновесных концентраций низшего и высшего соседних членов ряда при одинаковом понижении поверхностного натяжения (Ds) в их растворах (3):
b=Cn/Cn+1 (3)
Расчет рекомендуется проводить для начального участка изотермы поверхностного натяжения в области разбавленных растворов, когда С®0 (рис. 1).
Максимальную поверхностную активность определяют как тангенс угла наклона касательной, проведенной к изотерме поверхностного натяжения через ее начальную точку s0.Тангенс угла a выражают отношением катетов ob/oa в соответственных масштабах:
G0=tga (4)
Поверхностная активность в данной точке изотермы равна отношению понижения поверхностного натяжения к той концентрации (СDs) ПАВ, которая его вызывает:
GDs=s0-sx/CDs=Ds/CDs (5)
При проведении расчетов важно, чтобы величина G всех исследуемых ПАВ была определена при одних и тех же условиях.
Дата: 2019-03-05, просмотров: 438.