Метод максимального давления в пузырьке основан на измерении давления, при котором происходит отрыв пузырька газа (воздуха), выдуваемого в жидкость через капилляр.
При медленном продавливании пузырька из капилляра в жидкость в нем возникает избыточное внутреннее давление Dp, которое согласно закону Лапласа определяется поверхностным натяжением и кривизной поверхности пузырька Dp=2s/rм.
Радиус кривизны rм изменяется по мере продавливания пузырька в жидкость. Из рисунка 6 видно, что в начальный момент пузырек имеет большой радиус кривизны и поверхность его почти плоская. Со временем радиус кривизны уменьшается, пузырек становится все более выпуклым и при rм=r избыточное давление внутри пузырька достигает максимального значения Dpmax. Это давление соответствует внешнему давлению в капилляре.
Для дальнейшего увеличения размера пузырька не требуется повышение внешнего давления, поскольку с ростом пузырька внутреннее давление в нем в соответствии с уравнением Лапласа уменьшается. В результате воздух, находящийся в трубке, устремляется к сформировавшемуся пузырьку и приводит к его отрыву от капилляра. Таким образом, определение поверхностного натяжение рассматриваемым методом сводится к измерению внешнего давления, равного Dpmax. При определении поверхностного натяжения методом максимального давления в пузырьке следует также учитывать гидростатическое давление слоя жидкости, находящейся над ним. Однако, если глубина погружения капилляра в жидкость незначительна и радиус r мал, поправкой на это давление можно пренебречь.
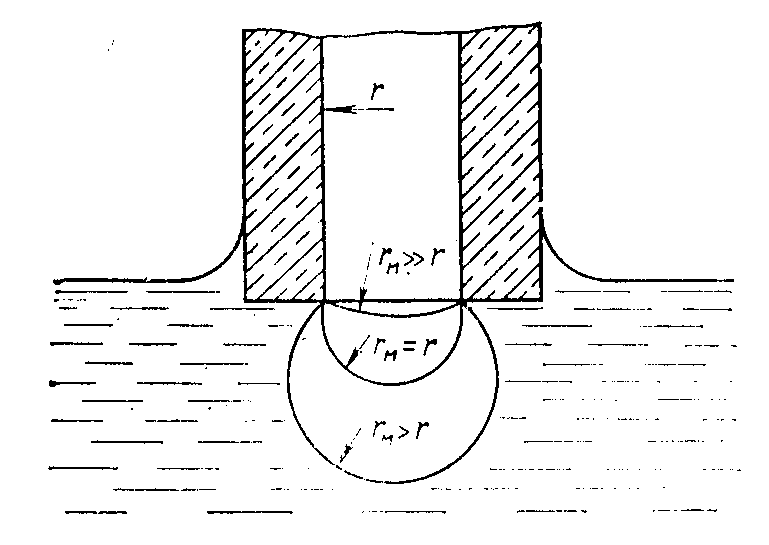
Рис. 6. Схема, иллюстрирующая формирование пузырька воздуха на выходе из капилляра.
Максимальное давление в пузырьке в простейшем варианте можно измерить с помощью прибора Ребиндера (рис. 7). Прибор состоит из стеклянного сосуда 1 с боковой трубкой 4, к которой припаян манометр 5. Верхнее отверстие сосуда 1 плотно закрывают пробкой 3, через которую проходит стеклянная трубка 2 с оттянутым капиллярным концом. Изогнутый конец трубки 4 пропускают через пробку, плотно закрывающую верхнее отверстие аспиратора 6.
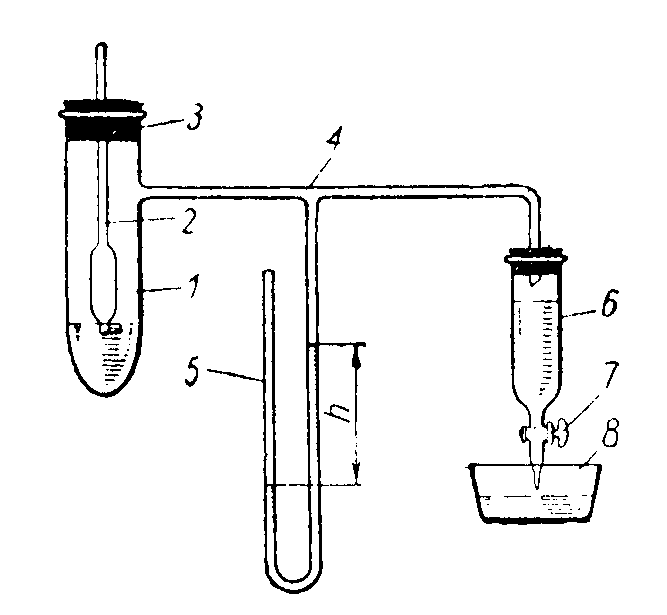
Рис. 7. Прибор для измерения поверхностного натяжения по методу Ребиндера.
ВЫПОЛНЕНИЕ РАБОТЫ
Работа состоит из двух частей:
1. Определяют зависимость поверхностного натяжения растворов ПАВ от концентрации и рассчитывают адсорбцию на поверхности раздела фаз: раствор-воздух.
2. Определяют по изменению поверхностного натяжения раствора ПАВ его адсорбцию из раствора на твердом адсорбенте и рассчитывают удельную поверхность адсорбента.
3. Прежде чем начать первую часть работы необходимо подготовить вторую часть работы, а именно, поставить опыт по адсорбции ПАВ активированным углем, так как равновесное значение концентрации в этом случае устанавливается через 1,5-2 часа после начала опыта.
Из исходного раствора ПАВ приготовить в колбах на (50 мл) растворы 6 концентраций по 40 мл каждого. Из каждой колбы отобрать 20 мл раствора в другие 6 колб (на 200 мл) и туда же внести по 1 г активированного угля, который предварительно измельчают в ступке. Растворы с углем тщательно перемешать и поместить на качалку на 30 минут. Оставшиеся растворы по 20 мл в каждой колбе используют для определения поверхностного натяжения. Исследуемую жидкость наливают в стеклянный сосуд 1 до уровня, при котором кончик капилляра 2 погружается в нее не более чем на 1 мм (избыток жидкости отбирают с помощью капилляра или пипетки). Стеклянный сосуд соединяют с аспиратором и манометром. Все соединения должны быть герметичными. Аспиратор наполняют водой и плотно закрывают пробкой. Открывают кран аспиратора. В установке создается разряжение, в результате чего манометрическая жидкость поднимается в трубке.
Сформировавшийся на конце капилляра пузырек воздуха при достижении Dpmax, пробивая поверхностный слой, лопается. В этот момент давление в системе снижается, и манометрическая жидкость начинает опускаться, но затем в результате образования нового пузырька она снова поднимается. Таким образом, уровень манометрической жидкости все время колеблется. Чтобы уменьшить пульсацию жидкости в измерительной трубке, добиваются равномерного проскока пузырьков, с интервалом 20-30 сек. Время образования и отрыва пузырьков воздуха регулируют путем изменения скорости вытекания воды из аспиратора. Если показание манометра Dpmax (суммарное значение уровней от нуля вверх и от нуля вниз) в течение 2-3 с не изменяется, то его считают установившимся и записывают. Чтобы исключить трудоемкую операцию по измерению радиуса капилляра, для определения поверхностного натяжения используют относительный метод.
Для этого находят константу ячейки R, которую рассчитывают по значениям максимального давления Dpст и поверхностного натяжения sст для стандартных жидкостей при данной температуре. Будем использовать в качестве стандартного раствора дистиллированную воду.
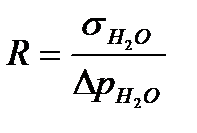 (12)
(12)
Определив коэффициент R и измерив давление Dpmax для исследуемой жидкости X, рассчитывают значения поверхностного натяжения
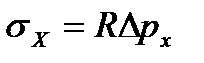 (13)
(13)
Обобщенная формула выглядит так:
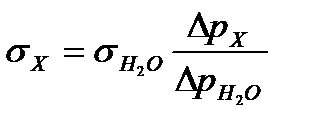 (14)
(14)
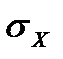 ,
, 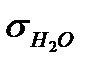 - поверхностное натяжение исследуемого раствора и чистой воды, при данной температуре.
- поверхностное натяжение исследуемого раствора и чистой воды, при данной температуре.
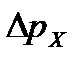 ,
, 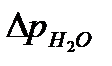 - показание манометра для исследуемого раствора и воды.
- показание манометра для исследуемого раствора и воды.
Таким образом, для 6 концентраций спирта рассчитывают поверхностное натяжение.
По истечении заданного времени адсорбции суспензию угля отфильтровывают через бумажные фильтры. Первые порции фильтратов
(5 мл) отбрасывают, так как в них концентрация кислоты может быть понижена за счет адсорбции фильтровальной бумагой. Поверхностное натяжение равновесных растворов спирта в фильтратах определяют так же, как и исходные растворы до адсорбции.
Таблица 1.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
До адсорбции
После адсорбции
СПАВ
Моль/л
D pmax
Показание манометра
D pmax
Сред.
S ,
Дж/м2
(14)
D pmax
Показание манометра
D pmax
Сред.
s 0 ,
Дж/м2
(14)
С0,
Моль/л
По данным таблицы 1 строят изотерму поверхностного натяжения s=f(C) на миллиметровой бумаге, откладывая по оси абсцисс значения концентрации С, а по оси ординат поверхностное натяжение 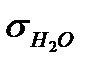 и σх (по данным до адсорбции). Зная поверхностное натяжение s0 растворов (после адсорбции) находят из графика изотермы поверхностного натяжения s=f(C) концентрации С0 (концентрации растворов после адсорбции) и записывают их в таблицу. Вычисляют удельную адсорбцию одним из указанных выше способов. Результаты расчетов записывают в таблицу 2 (или 3).
и σх (по данным до адсорбции). Зная поверхностное натяжение s0 растворов (после адсорбции) находят из графика изотермы поверхностного натяжения s=f(C) концентрации С0 (концентрации растворов после адсорбции) и записывают их в таблицу. Вычисляют удельную адсорбцию одним из указанных выше способов. Результаты расчетов записывают в таблицу 2 (или 3).
Таблица 2.
Результаты расчетов (для первого способа)
| № | C | s (14) | D C | D s | Сср (4) | Гx106 моль/м2 (3) | 1/Г | 1/С | Г ¥´106 моль/м2 (8) | S0, м2 (10) | d , м (11) |
Строят изотерму адсорбции в координатах Г=f(С). Для 4-5 точек изотермы рассчитывают величины 1/С и 1/Г и строят линейную форму изотермы адсорбции 1/Г=f(1/С). С помощью изотермы определяют величину предельной адсорбции Г¥ и адсорбционную константу Ленгмюра в.
Таблица 3.
Результаты расчетов (для второго способа)
| № | C | s | Z | Г·106, моль/м2 (5) | 1/C | 1/Г | Г ¥ ·106, моль/м2 (8) | S0, м2 (10) | d , м (11) |
Строят изотерму адсорбции в координатах Г=f(C). Рассчитывают в и Г¥ аналогично первому способу.
При поглощении растворенных веществ твердыми адсорбентами удельная адсорбция не может быть рассчитана по уравнению Гиббса, т.к. нет приемлемых методов измерения поверхностного натяжения на границе раздела твердое тело – жидкость. Количество адсорбированного вещества (адсорбата) определяют по изменению его концентрации в растворе. Зная исходные концентрации спирта С и равновесные концентрации С0 (определены графически) можно рассчитать величину адсорбции (х/m). Количество адсорбированного на угле спирта рассчитывается по формуле:
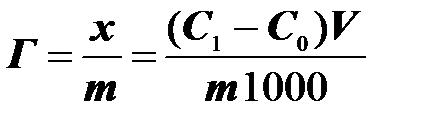 (15)
(15)
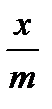 – удельная адсорбция, моль/г
– удельная адсорбция, моль/г
С1 – начальная концентрация спирта, моль/л
С0 – равновесная концентрация спирта, моль/л
V – объем раствора спирта, взятого для адсорбции, мл
m – масса угля, г
Результаты работы представить в виде таблицы 4:
Таблица 4.
| № | C | C0 | (x/m) |
Используя данные таблицы начертить на миллиметровой бумаге изотерму адсорбции спирта в координатах (х/m)=f(С0).
В отчете должны быть приведены названия ПАВ; состав системы; температура опыта; способ измерения поверхностного натяжения; примеры расчетов: постоянной прибора, поверхностного натяжения, Г, Г¥, S0, d, x/m; таблицы 2, 3, 5 или 1, 4, 5.
К отчету прилагают графики s=f(C), Г=f(C), 1/Г=f(1/C), x/m=f(C0), выполненные на миллиметровой бумаге.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. Что такое поверхностное натяжение, и в каких единицах оно измеряется?
2. Как зависит поверхностное натяжение от природы вещества, образующего поверхность?
3. На чем основано измерение поверхностного натяжения жидкостей методом наибольшего давления пузырька воздуха?
4. Что называется адсорбцией, и как количественно ее характеризуют?
5. Напишите фундаментальное адсорбционное уравнение Гиббса и его анализ.
6. Что такое предельная адсорбция?
7. Уравнение Ленгмюра.
8. Как найти постоянные в уравнении Ленгмюра?
9. Что такое поверхностная активность? Какие вещества называются поверхностно активными?
ЛАБОРАТОРНАЯ РАБОТА № 2
ИЗУЧЕНИЕ АДСОРБЦИИ ПОВЕРХНОСТНО-АКТИВНЫХ
ВЕЩЕСТВ НА УГЛЕ
Цель работы
Изучить адсорбцию уксусной кислоты на активированном угле статическим методом.
Задачи работы
1. Определить концентрацию уксусной кислоты до и после адсорбции.
2. Рассчитать удельную адсорбцию ПАВ на угле.
3. Построить изотерму адсорбции.
4. Графически определить константы уравнения Фрейндлиха и проверить его применимость к адсорбции органических кислот из растворов на угле.
Приборы и материалы
· Колбы конические емкостью 200 мл. – 12 шт.
· Стеклянные воронки – 6 шт.
· Пипетки вместимостью 10, 5, 2 мл.
· Бюретка для титрования – 25 мл.
· Технические весы.
· Аппарат для встряхивания растворов в колбах.
· Фарфоровая ступка.
· Активированный уголь БАУ.
· Раствор уксусной кислоты 0,4 моль/л.
· Раствор гидроксида натрия 0,1 и 0,02 моль/л.
· Раствор фенолфталеина спиртовой.
· Вода дистиллированная.
ТЕОРЕТИЧЕСКОЕ ПОЯСНЕНИЕ
Адсорбцией называют концентрирование веществ на поверхности раздела фаз. Вещество, которое адсорбирует другое вещество, называют адсорбентом. Название адсорбируемого вещества зависит от его положения по отношению к адсорбенту. Если вещество находится в объеме и может адсорбироваться, то его называют адсорбтивом. Это же вещество в адсорбционном состоянии будет называться адсорбатом. Иными словами для обозначения положения адсорбируемого вещества используют термины адсорбтив (до адсорбции) и адсорбат (после адсорбции).
Молекулы (атомы, ионы, радикалы) адсорбтива соприкасаются с поверхностью адсорбента и, вследствие нескомпенсированности молекулярного взаимодействия на границе фаз, молекулами адсорбента удерживаются на его поверхности. Поэтому концентрация молекул на поверхности становиться больше, чем в объеме соприкасающейся с ней жидкости или газа. Часть молекул с поверхности может перейти обратно в объем. Поверхностные атомы и молекулы любого тела заметно отличаются от атомов и молекул внутри фазы. На поверхности они энергетически ненасыщенны, поэтому поверхность любого тела обладает поверхностным натяжением и стремится уменьшить запас свободной энергии DF. Попадая на поверхность твердого тела, частица оказывается связанной с граничными атомами, теряя, по крайней мере, одну степень свободы. Следовательно, процесс адсорбции сопровождается уменьшением энтропии, т.е. DS<0. Поскольку DH=DF+TDS, то и величина энтальпии DH<0. Это означает, что любой адсорбционный процесс экзотермичен. Различают физическую адсорбцию, вызываемую в основном вандервaальсовыми силами, и хемосорбцию, сопровождающуюся химической реакцией. Поскольку поглощение вещества адсорбентом сопровождается выделением тепла, то в соответствии с принципом Ле-Шателье с повышением температуры количество адсорбированного вещества уменьшается. Процесс обратный адсорбции называют десорбцией. Адсорбционное равновесие характеризуется равенством скоростей адсорбции и десорбции.
На процесс адсорбции влияют такие факторы, как природа поглотителя и поглощаемого вещества, состояние поверхности, температура, давление газа или концентрация раствора. Твердые адсорбенты - это природные и искусственные материалы с большой наружной или внутренней поверхностью, на которой происходит адсорбция из граничащих с ней газов или растворов
Количество поглощенного вещества на единицу поверхности адсорбента называют удельной адсорбцией. Так как измерить поверхность адсорбента трудно, то на практике адсорбцию Г выражают в молях на единицу массы адсорбента (Г, моль/кг).
Для описания процесса адсорбции, в частности мономолекулярной, помимо фундаментального уравнения адсорбции Гиббса применяют ряд других аналитических уравнений, которые называют по имени их авторов.
При незначительном заполнении адсорбента адсорбатом отношение концентраций веществ в адсорбционном слое и в объеме стремится к постоянному значению, равному Кг. Эту закономерность можно выразить аналитически следующим образом,
Г=Кг С (1)
| Г |
| С |
| Г∞ |
| I |
| II |
| III |
Рис. 1. Изотерма адсорбции
Уравнение (1) характеризует изотерму адсорбции при малых концентрациях адсорбтива (рис. 1, участок I) и является аналитическим выражением закона Генри. Коэффициент Кг не зависит от концентрации и представляет собой константу распределения, характеризующую распределение вещества в адсорбционном слое по отношению к его содержанию в объемной фазе. Полученное на основе закона Генри уравнение (1) и, соответствующая ему линейная зависимость адсорбции от концентрации на начальном участке изотермы адсорбции (участке I), соблюдается лишь приближенно, но это приближение бывает достаточным для практики. В более общем виде зависимость адсорбции от концентрации адсорбтива можно определить при помощи уравнения Фрейндлиха (2):
Г=x/m=kС1/n, (2)
где x - количество адсорбированного вещества, моль; m - масса адсорбента, кг; k и n - коэффициенты.
Это уравнение было получено на основе результатов обработки опытных данных по адсорбции ПАВ при концентрации адсорбтива, равной единице, когда С=1, k=Г. Постоянная k зависит от природы адсорбента и адсорбата и колеблется в широких пределах. Ее физический смысл состоит в том, что она дает величину адсорбции при равновесной концентрации, равной единице. Коэффициент n характеризует отличие участка изотермы адсорбции (рис. 1, участок II.) от прямой. Значение адсорбционного показателя 1/n лежит в пределах 0,1–1 и зависит от температуры и природы адсорбата. Коэффициенты уравнения Фрейндлиха не трудно определить графически. Для этого логарифмируют уравнение (2), преобразуя его в уравнение прямой (3).
lg(x/m)= lgk+(1/n)lgC (3)
Определив экспериментально ряд значений x/m, строят график в координатах lg(x/m) – lgC (рис. 2).
| lg Г |
| lg C |
| lg k |
| α |
| tgα=1/n |
Рис. 2. Графическое определение коэффициентов k и n уравнения Фрейндлиха.
Отрезок прямой, отсекаемый на оси ординат, представляет собой величину lgk, а тангенс угла наклона прямой – величину 1/n.
Изотерма адсорбции, которая соответствует аналитическому выражению уравнения Фрейндлиха (3) не определяет предельного значения адсорбции (участок 3, на рис. 1).
· Аналитическое выражение адсорбции в зависимости от концентрации адсорбтива в виде изотермы адсорбции дано в теории Ленгмюра. В основу теории положены кинетические представления о процессе адсорбции, определяющие скорости адсорбции и десорбции в условиях равновесия.
Физическая адсорбция протекает практически мгновенно (10-12–10-6 с) продолжительность процесса хемосорбции значительно больше (>102 c).
Ленгмюр предложил молекулярно–кинетический вывод изотермы адсорбции для случая локализованной адсорбции на однородной поверхности в отсутствии сил притяжения между молекулами адсорбата (уравнение 4):
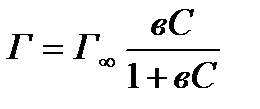 (4)
(4)
где Г – удельная адсорбция, (моль/м2); Г¥ – предельная адсорбция, т. е. величина адсорбции при мономолекулярном заполнении поверхности, (моль/м2); в – константа равновесия, равная отношению констант скоростей процессов адсорбции и десорбции, С – равновесная концентрация адсорбируемого вещества в растворе
Проведем анализ уравнения Ленгмюра (4) и сопоставим его с уравнениями Генри (1) и Фрейндлиха (2). В начале процесса адсорбции, когда С®0 и 1>>вС, в соответствии с уравнением (4) Г= Г¥вС. Произведение Г=Г¥вС –величина постоянная, что соответствует коэффициенту Кг в законе Генри, т. е. участку 1 изотермы адсорбции (рис. 1). Уравнение Фрейндлиха справедливо лишь для средней части изотермы адсорбции (участок 2). При С®¥, вС>>1 из уравнения (4) следует, что Г=Г¥, это соответствует участку 3 изотермы адсорбции. Таким образом, уравнение Ленгмюра определяет все участки изотермы мономолекулярной адсорбции, в том числе и предельную адсорбцию.
При расчетах по уравнению Фрейндлиха значение и размерность удельной адсорбции зависят от способа выражения равновесной концентрации. Для таких ПАВ, как органические кислоты, концентрацию в растворе обычно выражают в единицах молярности или молярной концентрации эквивалента (моль/л). У одноосновных кислот значения указанных концентраций совпадают, поэтому результат расчета не зависит от подстановки той или другой из этих величин. Для многоосновных кислот при переходе от одного способа выражения концентрации к другому необходимо вводить соответствующий коэффициент. Для определения количества адсорбированной кислоты х необходимо знать ее содержание в объеме раствора, взятого для адсорбции (моль), которое находят по формуле:
а=C0V, (5)
где C0 – исходная концентрация кислоты (до адсорбции), моль/л; V – объем раствора, взятый для адсорбции, л.
а также содержание кислоты в объеме раствора после адсорбции:
в=CравнV, (6)
где Cравн – концентрация кислоты после адсорбции, моль/л.
Концентрации кислот (моль/л) до и после адсорбции обычно вычисляют по данным титрования:
Ск=VщCщ/Vк, (7)
где Ск – концентрация кислоты, моль/л; Сщ – концентрация щелочи, моль/л; Vщ – объем щелочи, пошедший на титрование, мл; Vк – объем раствора кислоты, взятый для титрования, мл.
Количество адсорбированной кислоты:
х=а-в, (моль) (8)
Разделив х на массу угля m (кг), находят удельную адсорбцию для каждого раствора кислоты Г, моль/л:
Г=х/m (9)
На основе результатов опыта и расчетов строят график изотермы адсорбции x/m =f(Сравн). Для определения констант уравнения Фрейндлиха k и 1/n находят значения логарифмов x/m и С равн и строят график линейной формы изотермы в координатах: lgx/m – lgCравн. При проведении адсорбции на твердом адсорбенте определяют начальные и равновесные концентрации адсорбата в растворе. Выбор аналитического метода зависит от природы ПАВ. Для органических кислот, как правило, применяют титрование раствором щелочи в присутствии фенолфталеина. При наличии таких приборов, как потенциометры, кондуктометры, интерферометры, индикаторное титрование может быть заменено соответствующим физико-химическим методом анализа. Эти методы требуют построения кривых титрования или градуировочного графика по растворам известной концентрации, после чего определяют искомые концентрации путем прямых измерений. Кондуктометрия и потенциометрия применимы только для анализа ионогенных ПАВ, например кислот, оснований, солей. С помощью жидкостного интерферометра можно определять концентрации растворов ПАВ любой природы.
При изучении адсорбции уксусной кислоты можно не применять физико–химические методы, так как эта кислота титруется с достаточно большим скачком рН и определение конечной точки титрования не вызывает затруднений.
Для установления области применимости уравнения Фрейндлиха к данному виду адсорбции, подставляют найденные константы 1/n и lgk в линейную форму уравнения изотермы (уравнение 3) и вычисляют величину lg(x/m) для 5–6 значений равновесных концентраций кислоты. Последние берут из имеющегося графика (x/m)=f(C) в широком интервале концентраций. Наносят полученные расчетом величины lg(x/m) на график lg(x/m)=f(lgC). Для области, где найденные точки дают линейную зависимость, уравнение Фрейндлиха применимо.
ВЫПОЛНЕНИЕ РАБОТЫ
Из исходного раствора 0,4 моль/л уксусной кислоты (СН3СООН) готовят последовательным разбавлением вдвое 6 растворов по 50 мл каждого:
1. 50 мл 0,4 моль/л СН3СООН
2. 50 мл 0,4 моль/л СН3СООН + 50 мл Н2Одист – получили 0,2 моль/л СН3СООН
3. 50 мл 0,2 моль/л СН3СООН + 50 мл Н2Одист – получили 0,1 моль/л СН3СООН
4. 50 мл 0,1 моль/л СН3СООН + 50 мл Н2Одист – получили 0,05 моль/л СН3СООН
5. 50 мл 0,05 моль/л СН3СООН + 50 мл Н2Одист – получили 0,025 моль/л СН3СООН
6. 50 мл 0,025 моль/л СН3СООН + 50 мл Н2Одист – получили 0,0125 моль/л СН3СООН
Объемы растворов воды и кислоты отмеряют с помощью цилиндров. Из шести пронумерованных колб отбирают по 20 мл раствора каждой концентрации в другие пронумерованные колбы, соответствующего номера. В оставшиеся растворы (по 30 мл в каждой колбе) внести по 1 г (0,001 кг), предварительно растертого в ступке, активированного угля. Поставить для встряхивания на 15-20 мин до установления адсорбционного равновесия. Отобранные растворы (20 мл) используют для определения точной концентрации приготовленной уксусной кислоты. Точную концентрацию растворов уксусной кислоты устанавливают титрованием 0,1 моль/л раствором гидроксида натрия (NaOH) с фенолфталеином. Для этого в колбу для титрования отбирают по 5 мл пробы кислоты, вносят 1-2 капли фенолфталеина и титруют раствором щелочи. Титруют до появления устойчивой бледно-розовой окраски раствора, 2 или 3 раза. Концентрацию кислоты рассчитывают по формуле (7).
По истечении заданного времени адсорбции (более 30 мин), суспензию угля каждой колбы отфильтровывают через фильтры. Первые порции фильтратов (10-15 мл) отбрасывают, так как в них концентрация кислоты может быть понижена за счет адсорбции фильтровальной бумагой. Концентрацию равновесного раствора кислоты (Сравн) в фильтратах определяют так же, как и Сх по формуле (7).
Дата: 2019-03-05, просмотров: 864.