Значение темы: процесс изучения темы направлен на формирование у выпускника следующих компетенций: ОК-1; ОК-5; ОПК-1; ОПК-2; ОПК-7; ОПК-9; ПК-5.
Цель занятия: после изучения темы студент должен:
Знать: Зн. 1, Зн. 2, Зн. 3, Зн. 4, Зн. 5, Зн. 6, Зн. 7, Зн. 8, Зн. 9.
Уметь: Ум. 1, Ум. 2, Ум. 3, Ум. 4, Ум. 5; Ум. 6, Ум. 7, Ум. 8, Ум. 9.
Владеть: Вл. 1.
Основные фундаментальные положения
Биологические катализаторы – ферменты – являются по природе белками: простыми или сложными.
Ферменты высокоспецифичны по отношению к субстратам или катализируемым реакциям. Различают несколько типов специфичности.
Скорость ферментативных реакций зависит от ряда факторов (концентрации субстрата, количества фермента, рН-среды, температуры), что можно отобразить графически.
Об активности ферментов судят либо по степени убыли реагирующих веществ, либо по приросту содержания продуктов катализируемой реакции. Активность энзимов выражается в различных единицах измерения.
Номенклатура и классификация ферментов являются функциональными и основаны на типах катализируемых реакций.
Механизм ферментативной реакции включает несколько этапов. Специфичность реакций обеспечивается активным центром фермента, содержащим определенный набор аминокислот и состоящим из нескольких функциональных участков.
Непосредственное участие в реакциях сложных ферментов принимают небелковые группировки – кофакторы, в том числе из группы органических соединений (коферменты). Коферментами являются производные витаминов (в основном – водорастворимых), тетрапиррольных соединений или нуклеотидов.
Соединения, изменяющие скорость ферментативной реакции называются эффекторами и подразделяются на активаторы и ингибиторы. Основными типами ингибирования являются: конкурентное, неконкурентное, аллостерическое, путем фосфорилирования/дефосфорилирования, ингибирование субстратом.
Активация ферментов может осуществляться: активацией ионами, фосфорилированием/дефосфорилированием, воздействием на субъединицы, защитой фермента, частичным протеолизом.
Ферменты неравномерно распределены в организме и имеют различное функциональное назначение (ферменты жизнеобеспечения, проферменты, изоферменты, ассоциации ферментов).
Ферменты плазмы (сыворотки) крови с диагностической точки зрения классифицируются на плазмо- и органоспецифические.
Вопросы для изучения темы
1. Понятие о ферментах, свободной энергии, энергии активации и энергетической возможности протекания реакций.
2. Сходство и различие между ферментами и неорганическими катализаторами.
3. Классификация, номенклатура и свойства ферментов.
4. Структурно-функциональная организация ферментов. Коферменты и кофакторы.
5. Механизм действия ферментов. Теория промежуточных соединений. Кинетика ферментативных реакций.
6. Зависимость скорости реакции от концентрации субстрата, константа Михаэлиса.
7. Зависимость скорости реакции от количества фермента, рН-среды, температуры, продуктов реакции.
8. Специфичность.
9. Методы определения и единицы активности ферментов.
10. Регуляция активности ферментов, эффекторы, механизмы их действия, биологическая роль и практическое применение. Аллостерические ферменты.
11. Множественные молекулярные формы ферментов. Функции изоферментов. Виды организации отдельных ферментов в полиферментные цепи.
12. Локализация. Практическое применение ферментов. Энзимодиагностика, энзимотерапия.
Вопросы, вынесенные на самостоятельное изучение
1. Белковые ингибиторы ферментов. Ингибиторы ферментов как лекарственные препараты.
2. Изоферменты. Значение изоферментов в клинической диагностике.
Вопросы для самоконтроля
1. Дополните фразу: «Фермент ускоряет реакцию, но не входит в ______».
2. Перечислите отличительные свойства ферментов.
3. Что изучает кинетика ферментативных реакций?
4. Как судят о скорости ферментативной реакции?
5. Какими единицами принято выражать активность фермента?
6. Как по константе Михаэлиса судят о степени сродства энзима к субстрату? Дайте биологическую интерпретацию высокому и низкому значению константы Михаэлиса.
7. Перечислите виды специфичности ферментов. Приведите примеры.
8. Классификация ферментов основана на:
а) природе субстрата;
б) природе химических связей;
в) растворимости субстратов;
г) характере взаимодействия фермент-субстрат;
д) типе химической реакции, катализируемой ферментом;
е) молекулярной массе субстрата или фермента.
9. Перечислите классы химических реакций, протекающих в живом организме.
10. Энзим катализирует гидролитическое расщепление уксусного эфира масляной кислоты. Назовите класс, к которому он относится.
11. Энзим катализирует реакцию, в которой субстрат является донором водорода. Определите класс и дайте общее название.
12. Энзим катализирует окислительно-восстановительную реакцию. К какому классу он относится, какие дополнительные данные необходимы для определения подкласса?
13. Энзим катализирует перенос метильной группы от донора к акцептору. Назовите класс энзима и его общее наименование.
14. Назовите функцию карбоксилтрансфераз.
15. Энзим катализирует перенос остатка фосфорной кислоты от донора на молекулу акцептора. Назовите класс и общее наименование подкласса.
16. Энзим катализирует гидролитическое отщепление остатка фосфорной кислоты в молекуле глюкозо-6-фосфата. Назовите класс и дайте рабочее имя.
17. Энзим катализирует гидролитическое расщепление пептидной связи в белковых молекулах. Назовите класс фермента и рабочее имя.
18. Энзим катализирует расщепление пептидной связи в пептидах. Назовите класс и рабочее имя.
19. Энзим катализирует разрыв эфирных связей в триацилглицериде (нейтральный жир). Назовите класс и рабочее имя энзима.
20. Энзим катализирует гидролиз связи С-С. Назовите класс и подкласс.
21. Энзим катализирует негидролитический разрыв связи С-О. Назовите класс и подкласс.
22. Назовите класс энзима, катализирующего превращение D-аланина в L-аланин и его общее наименование.
23. Назовите класс и общее наименование энзима, катализирующего превращения УДФ-галактозы в УДФ-глюкозу.
24. Е-энзим, S-субстрат, P-продукт реакции. Используя эти символы, запишите ферментативную реакцию как трехэтапный процесс. Назовите этапы ферментативной реакции.
25. Сформулируйте понятие «активный центр» энзима.
26. Сформулируйте фразу, удалив лишнее: «В образовании активного центра участвуют остатки углеводов, альдегидов, аминокислот, далеко расположенные друг от друга в полипептидной цепи молекулы энзима. Они удалены, сближаются в пространстве за счет эфирных, гликозидных, пептидных связей, благодаря трехмерной структуре белка. Геометрическая форма пространства, ограниченного остатками липидов, аминокислот, углеводов, образующих активный центр, должна быть идентичной, комплементарной, зеркальной к форме молекулы субстрата».
27. Сформулируйте фразу: «Оптимальная пространственная форма активного центра возникает только в присутствии минеральных веществ, жиров, альдегидов, субстрата или активаторов».
28. Определите понятие «индуцируемая адаптация фермента».
29. Активный центр многих гидролаз включает остаток цистеина, глицина, серина, изолейцина, гистидина (выберите верное).
30. В активном центре большинства ферментов могут содержаться следующие аминокислоты: лейцин, серин, аланин, триптофан, гистидин, лейцин, цистеин, фенилаланин, валин, тирозин, пролин, лизин (выберите правильное).
31. Активный центр многих дегидрогеназ включает остаток:
а) лизина; б) цистеина; в) аланина; г) серина; д) лейцина; е) триптофана.
32. Ингибитором цистеиновых ферментов является глицерол, сульфаты, парахлормеркурибензоат, соединения, взаимодействующие с тиоловой группой цистеина (выберите правильное).
33. Что такое сложный фермент? Из чего он состоит?
34. Что такое «кофакторы» и «коферменты»? В чем их отличия?
35. Выберите соединения, образующие коферменты:
а) нуклеотиды; б) липиды; в) витамины; г) гормоны; д) пирокатехины; е) минеральные вещества; ж) тетрапиррольные соединения.
36. Эффекторы – соединения, которые тормозят, изменяют, ускоряют ферментативные реакции (выберите правильное).
37. В чем заключается основная особенность конкурентных ингибиторов?
38. Покажите с помощью символов (E-энзим, S-субстрат, I-ингибитор) как протекает реакция E+S в присутствии конкурентного ингибитора.
39. Какие ингибиторы называют антиметаболитами? В чем биологический смысл их существования?
40. В чем заключается основная особенность неконкурентных ингибиторов?
41. К неконкурентным ингибиторам относятся:
а) масла; б) стерины; в) фториды; г) производные глюкозы; д) этилендиаминтетраацетат; е) эфиры глицерина.
42. Как с помощью графического анализа результатов эксперимента отличить конкурентное торможение от неконкурентного?
43. Для каких ферментов характерен кооперативный эффект, в чем он состоит?
44. Какие ферменты обнаруживаются практически во всех клетках?
45. Что такое проферменты?
46. Изоферменты – это ферменты, отличающиеся по структуре, но ______.
47. Что такое «ассоциации» ферментов?
48. Дайте понятие «лимитирующий фермент» и предложите синонимы.
49. С какой целью используются ферменты в медицине?
50. Как подразделяются ферменты плазмы (сыворотки) крови с лабораторной точки зрения?
51. В чем заключается диагностическое значение определения активности ферментов в лабораторной практике?
Ситуационные задачи
1. Как доказать, что способность дрожжевых клеток расщеплять крахмал сохраняется и при их разрушении? Вы располагаете раствором крахмала, раствором Люголя, поваренной солью и льдом.
2. Скорость взаимодействия А+В увеличилась в 3 раза после добавления вещества К. В качестве конечных продуктов обнаружились вещества АК и ВК. Является ли К катализатором?
3. Оптимум рН исследуемого фермента 6,9-7,0; субстратом является высокомолекулярный природный полимер, обнаруживаемый по характерному окрашиванию в присутствии йода; продукты взаимодействия фермента с субстратом окрашиваются при нагревании в присутствии сульфата меди (II) в краснокирпичный цвет. Назовите фермент, субстрат, реактив, используемый для обнаружения субстрата, продукты гидролиза субстрата и определите принадлежность фермента к классу, подклассу.
4. Какую реакцию катализируют изомеразы?
а) H2N—CO—NH2 + H2O ® CO2 + 2NH3;
б) UDP-глюкоза ® UDP-галактоза;
в) лактат + NAD+ ® пируват + NADH + H+.
5. Скорость ферментативной реакции при температуре 8, 16, 25, 28, 37 и 44°C равна соответственно 2, 13, 17, 23, 28 и 3,5 катал. Изобразите графически зависимость скорости реакции (V) от температуры (t). Определите температурный оптимум.
6. Скорость химической реакции при постоянной температуре и изменяющемся рН такова: при рН 1,5; 4,0, 5,5, 7,0; 7,5 и 8,5 равна соответственно 35, 48, 29, 20, 14 и 4,8 катал. Изобразите графически зависимость скорости реакции от значения рН, найдите оптимум рН.
7. Для лечения длительно не заживающих ран используют мази, в состав которых входят трипсин, гиалуронидаза и некоторые другие протеолитические ферменты. На чем основано их лечебное действие?
8. Постройте график зависимости скорости (V) ферментативной реакции от концентрации субстрата ([S]) по следующим данным и определите концентрацию насыщения:
| [S], ммоль/л | [V], ммоль/л · с | Концентрация насыщения. |
| 2,5 3,7 4,5 5,8 8,0 9,5 12,0 14,5 16,5 | 3,0 5.5 6.5 6.6 6.1 5.5 4.5 3.5 2.0 |
9. Постройте график зависимости скорости (V) ферментативной реакции от концентрации субстрата ([S]) по следующим данным и определите концентрацию насыщения:
| [S], ммоль/л | [V], ммоль/л · с | Концентрация насыщения. |
| 1 2 4 10 15 20 25 30 | 0,5 0,7 0,9 1,2 1,6 1,7 1,8 1,8 |
10. Ферменты глюко- и гексокиназы катализируют одинаковую реакцию. Напишите реакцию, протекающую под действием этих ферментов; укажите различие в активности, регуляции и локализации этих ферментов. Объясните биологическое значение наличия в организме двух видов ферментов, катализирующих одинаковую реакцию.
11. Салицилат ингибирует каталитическое действие глутаматдегидрогеназы. Определите путем графического анализа приведенных ниже данных, является ли ингибирование конкурентным или неконкурентным. Вычислите Км для фермента.
| Концентрация субстрата, ммоль/л | 1,5 | 2,0 | 3,0 | 4,0 | 8,0 | 16,0 |
| V образования продукта в отсутствии салицилата, мг/мин | 0,21 | 0,25 | 0,28 | 0,33 | 0,44 | 0,40 |
| -//- присутствии салицилата, мг/мин | 0,08 | 0,10 | 0,12 | 0,13 | 0,16 | 0,18 |
12. Из приведенных ниже данных для ферментативной реакции определите, является ли действие ингибитора конкурентным или неконкурентным. Вычислите Км для фермента и Vmax.
| Концентрация субстрата, ммоль/л | 2,0 | 3,0 | 4,0 | 10,0 | 15,0 |
| Скорость образования продукта в отсутствии ингибитора, мкг/ч | 139 | 179 | 213 | 213 | 190 |
| -//- присутствии ингибитора, мкг/ч | 88 | 121 | 149 | 213 | 190 |
13. В основе какого кофермента содержится никотиновая кислота:
а) тиаминпирофосфат; б) никотинамидадениндинуклеотид; в) пиридоксальфосфат; г) флавинаденинмононуклеотид?
14. Для каких ферментов активатором являются ионы Mg:
а) фосфорилаз; б) амилаз; в) гексокиназ; г) креатинкиназ; д) карбоксипептидаз?
15. Для каких ферментов активатором являются ионы Zn:
а) карбоксипептидаз; б) лактатдегидрогеназ; в) алкогольдегидрогеназ; г) глутаматдегидрогеназ; д) карбоангидраз?
16. Изобразите, каким образом, избыток субстрата может вызывать торможение ферментативной реакции.
17. Изобразите графики зависимости [V] от [S] для аллостерического фермента в присутствии активатора и ингибитора порознь: как объясняет теория индуцируемой адаптации фермента к субстрату (теория Кошланда) сигмовидный характер кривых?
18. У пациента К. в сыворотке крови повышена активность ЛДГ, ЛДГ5, АЛТ и ЩФ. Выскажите предположение о том, какой орган вовлечен в патологический процесс.
19. У пациента Н., поступившего в приемное отделение, через 3 ч после острого начала заболевания в сыворотке крови в 1,5 раза повышена активность КФК. К исходу первых суток отмечалось двукратное повышение АСТ, ЛДГ и ЛДГ1. К 3-й неделе содержание названных ферментов вернулось к норме, но возросла активность g-ГТТП. О каком патологическом процессе идет речь, о чем свидетельствует рост активности g-ГТТП?
20. Пациента с жалобами на боль в груди в течение 3 дней госпитализировали с подозрением на инфаркт миокарда. Результаты биохимического анализа крови подтвердили диагноз. Опишите метод энзимодиагностики и объясните:
- какие особенности состава и распределения ферментов характерны для кардиомиоцитов?
- активность каких ферментов определяли в крови пациента, и для какого из этих ферментов она была наибольшей на третьи сутки болезни?
21. С какой целью у пациента с жалобами на резкую боль в груди определяют в крови количество и соотношение изоферментов КК?
22. У пациента при биохимическом анализе крови обнаружили резкое повышение активности ЛДГ, АСТ и АЛТ. Коэффициент де Ритиса равен 3,85. Нарушения со стороны какого органа можно предположить? Активность каких ещё ферментов сыворотки крови будет повышена? Укажите правильные ответы:
а) креатинфосфокиназы и ее изофермента МВ-формы
б) щелочной фосфатазы
в) γ-глутамилтранспептидазы
г) α-гидроксибутиратдегидрогеназы.
23. Протеолитические ферменты и дезоксирибонуклеазы используют для лечения гнойных ран. На чем основано их применение? Для ответа вспомните:
- какие реакции катализируют эти ферменты?
- как изменяется вязкость гнойного содержимого, если она зависит от концентрации макромолекул в его составе?
- можно ли в этих целях использовать пепсин, коллагеназу и гиалуронидазу?
24. Больной жалуется на боли за грудиной, отдающие в живот. В проведённом биохимическом исследовании крови выявлено повышение активности ферментов в следующих пропорциях: амилаза >> аланинаминотрансфераза > аспартатаминотрансфераза >> креатин(фосфо)киназа. Предположительный диагноз?
а) острый панкреатит;
б) хронический пиелонефрит;
в) инфаркт миокарда;
г) почечная колика;
д) острый вирусный гепатит.
25. Поставьте предварительный диагноз по следующим данным анализа крови и мочи больного:
Активность амилазы в крови и моче – резко повышена;
Активность липазы в крови и моче – резко повышена;
Активность трипсина в крови и моче – повышена.
26. Фермент лактатдегидрогеназа (ЛДГ) имеет 5 изоферментов и катализирует обратимую реакцию превращения пирувата в лактат. В культуре клеток показано, что при снижении парциального давления кислорода в тканях повышается синтез М-субъединиц, а синтез Н-субъедниц практически не меняется. Объясните роль изоферментов ЛДГ в регуляции метаболизма. Как меняется состав изоферментов ЛДГ при недостатке кислорода? В каком направлении идет лактатдегидрогеназная реакция в этих условиях?
27. Сравните структуру прозерина (антихолинэстеразного препарата) и ацетилхолина (медиатора, осуществляющего передачу нервных импульсов в холинергических нервах).
Прозерин:
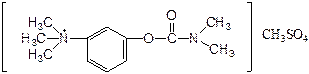
Ацетилхолин:
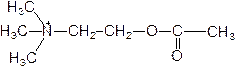
- наличие каких групп позволяет отнести эти вещества к структурным аналогам? Укажите вид ингибирования холинэстеразы прозерином.
- подтверждением диагноза миастении – заболевания, характеризующегося мышечноцй слабостью и патологической утомляемостью, служит улучшение внутримышечного введения прозерина. Почему состояние больного при этом улучшается?
Лабораторная работа
1. Влияние температуры на каталитическую активность амилазы слюны.
2. Специфичность действия ферментов.
3. Влияние рН на действие ферментов.
4. Количественное определение амилазы мочи.
6. Влияние активаторов и ингибиторов на активность амилазы слюны.
Тема №4
Дата: 2019-03-05, просмотров: 678.