Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей повреждённые участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка RecA.
Пострепликативная репарация была открыта в клетках E. coli, не способных выщеплять тиминовые димеры. Это единственный тип репарации, не имеющий этапа узнавания повреждения.
Полагают, что от 80 % до 90 % всех раковых заболеваний связаны с отсутствием репарации ДНК.
Повреждение ДНК под воздействием факторов окружающей среды, а также нормальных метаболических процессов, происходящих в клетке, происходит с частотой от нескольких сотен до 1000 случаев в каждой клетке, каждый час.
По сути ошибки в репарации происходят так же часто как и в репликации, а при некоторых условиях даже чаще.
В половых клетках сложная репарация, связанная с гомологичной рекомбинацией не происходит из-за гаплоидности генома этих клеток.
Раздел 3. Реализация генотипа в фенотип.
Лекция 7. Транскрипция.
Процесс воплощения генетической информации в живые работоспособные структуры связан с процессом биосинтеза белков. Если редупликация ДНК - это процесс копирования чертежей и инструкций по эксплуатации сложного прибора, то биосинтез белка - это его реальная сборка. Имея белки - ферменты, можно сделать и другие компоненты живого (липиды, углеводы и т.д.).
Транскрипция (от лат. transcriptio - переписывание) - процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК.
Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой. РНК-полимераза- движется по молекуле ДНК в направлении 3' → 5'.
Транскрипция состоит из стадий инициации, элонгации и терминации. Единицей транскрипции является оперон, фрагмент молекулы ДНК, состоящий из промотора, транскрибируемой части и терминатора.
Инициация транскрипции - сложный процесс, зависящий от последовательности ДНК вблизи транскрибируемой последовательности (а у эукариот также и от более далеких участков генома - энхансеров и сайленсеров) и от наличия или отсутствия различных белковых факторов.
Момент перехода РНК-полимеразы от инициации транскрипции к элонгации точно не определен. Три основных биохимических события характеризуют этот переход в случае РНК-полимеразы кишечной палочки: отделение сигма-фактора, первая транслокация молекулы фермента вдоль матрицы и сильная стабилизация транскрипционного комплекса, который кроме РНК-полимеразы включает растущую цепь РНК и транскрибируемую ДНК. Эти же явления характерны и для РНК-полимераз эукариот. Переход от инициации к элонгации сопровождается разрывом связей между ферментом, промотором, факторами инициации транскрипции, а в ряде случаев - переходом РНК-полимеразы в состояние компетентности в отношении элонгации (например, фосфорилирование CTD-домена у РНК-полимеразы II). Фаза элонгации заканчивается после освобождения растущего транскрипта и диссоциации фермента от матрицы (терминация).
На стадии элонгации в ДНК расплетено примерно 18 пар нуклеотидов. Примерно 12 нуклеотидов матричной нити ДНК образует гибридную спираль с растущим концом цепи РНК. По мере движения РНК-полимеразы по матрице впереди неё происходит расплетание, а позади - восстановление двойной спирали ДНК. Одновременно освобождается очередное звено растущей цепи РНК из комплекса с матрицей и РНК-полимеразой. Эти перемещения должны сопровождаться относительным вращением РНК-полимеразы и ДНК. Трудно себе представить, как это может происходить в клетке, особенно при транскрипции хроматина. Поэтому не исключено, что для предотвращения такого вращения двигающуюся по ДНК РНК-полимеразу сопровождают топоизомеразы.
Элонгация осуществляется с помощью основных элонгирующих факторов, необходимых, чтобы процесс не останавливался преждевременно.
В последнее время появились данные, показывающие, что регуляторные факторы также могут регулировать элонгацию. РНК-полимераза в процессе элонгации делает паузы на определенных участках гена. Особенно четко это видно при низких концентрациях субстратов. В некоторых участках матрицы длительные задержки в продвижении РНК-полимеразы, т. н. паузы, наблюдаются даже при оптимальных концентрациях субстратов. Продолжительность этих пауз может контролироваться факторами элонгации.
Терминация.
У бактерий есть два механизма терминации транскрипции:
ро-зависимый механизм, при котором белок Rho (ро) дестабилизирует водородные связи между матрицей ДНК и мРНК, высвобождая молекулу РНК.
ро-независимый, при котором транскрипция останавливается, когда только что синтезированная молекула РНК формирует стебель-петлю, за которой расположено несколько урацилов (…УУУУ), что приводит к отсоединению молекулы РНК от матрицы ДНК.
Терминация транскрипции у эукариот менее изучена. Она завершается разрезанием РНК, после чего к её 3' концу фермент добавляет несколько аденинов (…АААА), от числа которых зависит стабильность данного транскрипта.
Существует ряд экспериментальных данных, свидетельствующих о том, что транскрипция осуществляется в так называемых транскрипционных фабриках: огромных, по некоторым оценкам, до 10 МДа комплексах, которые содержат около 8 РНК-полимераз II и компоненты последующего процессинга и сплайсинга, а также корректирования новосинтезированного транскрипта. В ядре клетки происходит постоянный обмен между пулами растворимой и задействованной РНК-полимеразы. Активная РНК-полимераза задействована в таком комплексе, который в свою очередь является структурной организовывающей компактизацию хроматина единицей. Последние данные свидетельствуют о том, что транскрипционные фабрики существуют и в отсутствие транскрипции, они фиксированы в клетке (пока не ясно, взаимодействуют ли они с ядерным матриксом клетки или нет) и представляют собой независимый ядерный субкомпартмент. Комплекс транскрипционных фабрик, содержащих РНК полимеразу I, II или III, был проанализирован с помощью масс-спектрометрии.
Обратная транскрипция.
Некоторые вирусы (такие как вирус иммунодефицита человека, вызывающий ВИЧ-инфекцию), имеют возможность транскрибировать РНК в ДНК. ВИЧ имеет РНК-геном, который встраивается в ДНК. В результате, ДНК вируса может быть объединена с геномом клетки-хозяина. Главный фермент, ответственный за синтез ДНК из РНК, называется ревертазой. Одной из функций ревертазы является создание комплементарной ДНК (кДНК) из вирусного генома. Ассоциированный фермент рибонуклеаза H расщепляет РНК, а ревертаза синтезирует кДНК из двойной спирали ДНК. кДНК интегрируется в геном клетки-хозяина с помощью интегразы. Результатом является синтез вирусных протеинов клеткой-хозяином, которые образуют новые вирусы. В случае с ВИЧ так же программируется апоптоз (смерть клетки) Т-лимфоцитов. В иных случаях клетка может остаться распространителем вирусов.
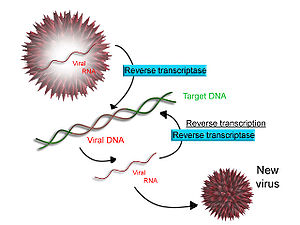 Схема обратной транскрипции
Схема обратной транскрипции
Некоторые клетки эукариот содержат фермент теломеразу, также проявляющую активность обратной транскрипции. С её помощью синтезируются повторяющиеся последовательности в ДНК. Теломераза часто активирутся в раковых клетках для бесконечной дупликации генома без потери кодирующей протеины последовательности ДНК. Некоторые РНК-содержащие вирусы животных при помощи РНК-зависимой ДНК-полимеразы способны синтезировать ДНК, комплементарную по отношению к вирусной РНК. Она встраивается в геном эукариотической клетки, где может многие поколения оставаться в скрытом состоянии. При определённых условиях (например, воздействии канцерогенов) вирусные гены могут активироваться, и здоровые клетки превратятся в раковые.
Лекция 8. Процессинг.
Новосинтезированные РНК еще неактивны
Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг. У эукариот процессингу подвергаются все виды пре-РНК, у прокариот - только предшественники рРНК и тРНК.
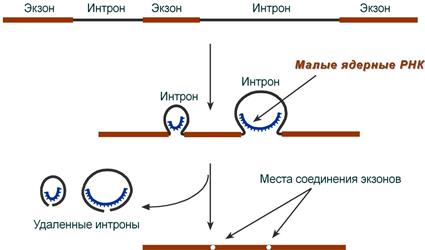
Посттранскрипционные модификации РНК - совокупность процессов в клетках эукариот, которые приводят к превращению первичного транскрипта в зрелую РНК. При транскрипции участков ДНК, несущих информацию о белках, образуются гетерогенные ядерные РНК, по размеру намного превосходящие мРНК. Дело в том, что из-за мозаичной структуры генов эти гетерогенные РНК включают в себя информативные (экзоны) и неинформативные (интроны) участки.
В зависимости от типа РНК (матричные, рибосомные, транспортные, малые ядерные) их предшественники подвергаются разным последовательным модификациям. Например, предшественники матричных РНК подвергаются кэпированию, сплайсингу, полиаденилированию, метилированию и иногда редактированию.
1. Кэпирование (англ. cap – шапка) – происходит еще во время транскрипции. Процесс состоит в присоединении к 5'-трифосфату концевого нуклеотида пре-мРНК 5'-углерода N7-метил-гуанозина.
"Кэп" необходим для защиты молекулы РНК от экзонуклеаз, работающих с 5'-конца, а также для связывания мРНК с рибосомой и для начала трансляции.
2. Сплайсинг (англ. splice – склеивать встык) – особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов.
3. Полиаденилирование – при помощи полиаденилат-полимеразы с использованием молекул АТФ происходит присоединение к 3'-концу РНК от 100 до 200 адениловых нуклеотидов, формирующих полиадениловый фрагмент – поли(А)-хвост. Поли(А)-хвост необходим для защиты молекулы РНК от экзонуклеаз, работающих с 3'-конца.
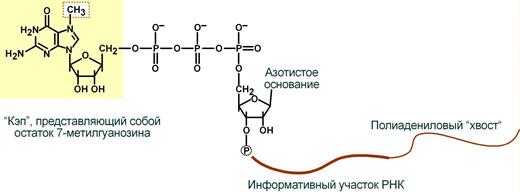
4. Метилирование.
Эукариотическая мРНК подвергаются посттранскрипционному метилированию. Наиболее распространённой модификацией является метилирование остатков аденина с образованием метиладенозина (m6A). Этот процесс метилируют ферменты аденозинметилтрансферазы, которые распознают остатки аденина в консенсусных* последовательностях GAC (70 % случаев) и AAC (30 % случаев). Соответствующие деметилазы ингибируют обратный процесс деметилирования. Учитывая обратимость и динамичность процесса метилирования мРНК, а также повышенную концентрацию m6A в длинных экзонах и вокруг стоп-кодонов, предполагают, что метилирование мРНК выполняет регуляторную функцию.
*Консе́нсусная после́довательность Ко́зак (последовательность Козак, англ. Kozak consensus sequence) - последовательность нуклеотидов в составе молекулы мРНК эукариот, окружающая старт-кодон и важная для инициации трансляции. Консенсусная последовательность была впервые описана Мэрилин Козак в 1986 году.
5. Редактирование РНК (англ. RNA editing) - молекулярно-биологический процесс, в ходе которого информация, содержащаяся в молекуле РНК изменяется путём химической модификации оснований. В настоящее время показано редактирование транспортных РНК, рибосомных РНК и матричных РНК эукариот. Редактирование РНК обычно происходит в ядре клетки, цитозоле, а также в митохондриях и пластидах, органоидах, которые произошли из прокариотических эндосимбионтов.
Дата: 2019-03-05, просмотров: 165.