Предшественники рРНК являются более крупными молекулами по сравнению со зрелыми рРНК. Их созревание сводится к разрезанию прерибосомной РНК на более мелкие формы, которые уже непосредственно участвуют в формировании рибосомы. У эукариот существуют четыре типа рРНК – 5S-, 5,8S-, 18S- и 28S-рРНК. При этом 5S-рРНК синтезируется отдельно, а большая прерибосомная 45S-РНК расщепляется специфичными нуклеазами с образованием 5,8S-рРНК, 18S-рРНК и 28S-рРНК.
У прокариот молекулы рибосомальной РНК совсем иные по своим свойствам (5S-, 16S-, 23S-рРНК), что является основой изобретения и использования ряда антибиотиков в медицине.
Процессинг предшественника транспортной РНК
1. Модификация нуклеотидов в молекуле путем дезаминирования, метилирования, восстановления. Например, образование псевдоуридина и дигидроуридина.
2. Формирование антикодоновой петли происходит путем сплайсинга и удаления интрона в средней части пре-тРНК.
3. Формирование на 3'-конце последовательности ЦЦА. Для этого у одних пре-тРНК с 3'-конца удаляются лишние нуклеотиды до "обнажения" триплета ЦЦА, у других идет присоединение этой последовательности.
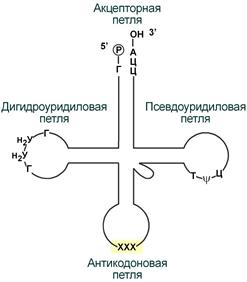
Внешний вид вторичной структуры тРНК после процессинга.
Лекция 9. Трансляция.
Процесс синтеза белка на основе молекулы мРНК называется трансляцией. У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду.
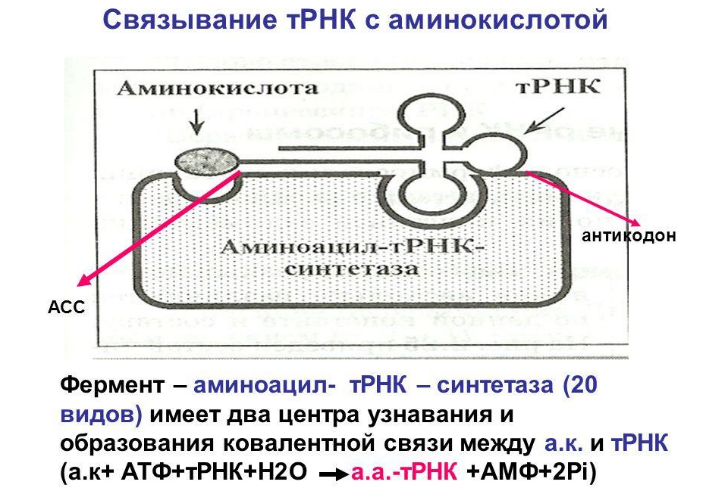 Рибосома содержит 2 функциональных участка для взаимодействия с тРНК: аминоацильный (акцепторный) и пептидильный (донорный). Аминоацил-тРНК попадает в акцепторный участок рибосомы и взаимодействует с образованием водородных связей между триплетами кодона и антикодона. После образования водородных связей система продвигается на 1 кодон и оказывается в донорном участке. Одновременно в освободившемся акцепторном участке оказывается новый кодон, и к нему присоединяется соответствующий аминоацил-т-РНК.
Рибосома содержит 2 функциональных участка для взаимодействия с тРНК: аминоацильный (акцепторный) и пептидильный (донорный). Аминоацил-тРНК попадает в акцепторный участок рибосомы и взаимодействует с образованием водородных связей между триплетами кодона и антикодона. После образования водородных связей система продвигается на 1 кодон и оказывается в донорном участке. Одновременно в освободившемся акцепторном участке оказывается новый кодон, и к нему присоединяется соответствующий аминоацил-т-РНК.
Три основные стадии трансляции.
Инициация - узнавание рибосомой стартового кодона и начало синтеза.
Элонгация - собственно синтез белка.
Терминация - узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белков присоединена метиониновая транспортная РНК.
После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции - элонгация. При каждом движении рибосомы от 5'- к 3'-концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомой. Можно сказать, что рибосома главный фермент трансляции. Рибосомальная РНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции.
Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C-концу.
Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства, безопасные для организма млекопитающих.
Поскольку каждый кодон содержит три нуклеотида, один и тот же генетический текст можно прочитать тремя разными способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания. За некоторыми интересными исключениями, значимой является информация, закодированная только в одной рамке считывания. По этой причине крайне важным для синтеза белка рибосомой является её правильное позиционирование на стартовом AUG-кодоне - инициация трансляции.
Синтез белка в большинстве случаев начинается с AUG-кодона, кодирующего метионин. Этот кодон обычно называют стартовым или инициаторным. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определённых нуклеотидных последовательностей в районе стартового кодона (последовательность Шайна - Дальгарно у прокариот и последовательность Козак у эукариот). Немаловажная роль в защите 5'-конца мРНК принадлежит 5'-кэпу. Существование последовательности, отличающей стартовый AUG от внутренних совершенно необходимо, так как в противном случае инициация синтеза белка происходила бы хаотично на всех AUG-кодонах.
Процесс инициации обеспечивается специальными белками - факторами инициации (англ. initiation factors, IF; инициаторные факторы эукариот обозначают eIF, от англ. eukaryotes).
Механизмы инициации трансляции у про- и эукариот существенно отличаются: прокариотические рибосомы потенциально способны находить стартовый AUG и инициировать синтез на любых участках мРНК, в то время как эукариотические рибосомы обычно присоединяются к мРНК в области кэпа и сканируют её в поисках стартового кодона.
Инициация у прокариот.
Начальная стадия предусматривает связывание малой рибосомной субъединицы (30S) с мРНК. Это может происходить двумя способами: либо сначала к мРНК присоединяется комплекс, содержащий рибосомную субчастицу, а затем к нему привлекается тРНК в комплексе с IF2 и ГТФ, либо 30S субъединица изначально связывается с тРНК, а уже потом садится на мРНК. К образовавшемуся комплексу приходит большая (50S) рибосомная субъединица, инициаторные факторы отсоединяются от 30S субчастицы. Собранная рибосома начинает элонгировать цепь.
Инициация у эукариот.
У эукариот существуют два основных механизма нахождения рибосомой стартового AUG: кэпзависимый (сканирующий) и кэпнезависимый (внутренняя инициация).
При сканирующем механизме рибосома (точнее, её малая субъединица) садится на 5'-конец мРНК в области кэпа и двигается вдоль молекулы мРНК, «сканируя» один кодон за другим, пока не наткнётся на инициаторный AUG. Для привлечения рибосомы к 5'-концу мРНК требуется специальная структура, кэп - 7-метилгуанин, прикреплённый к 5'-концевому нуклеотиду мРНК.
При механизме внутренней инициации, называемом у эукариот также IRES-зависимым механизмом, рибосома садится на внутренний участок мРНК, называемый IRES (англ. Internal Ribosomal Entry Site, участок внутренней посадки рибосомы) - участок мРНК, обладающий выраженной вторичной структурой, позволяющей ему направлять рибосомы на стартовый AUG. По IRES-зависимому механизму инициируется синтез лишь на небольшой части клеточных мРНК, а также на РНК некоторых вирусов.
Также у эукариот возможна реинициация трансляции, когда после окончания трансляции рибосома с белковыми факторами не диссоциирует от мРНК, а перескакивает с 3' на 5'-конец мРНК и начинает инициацию ещё раз. Это возможно благодаря т.н. циклизации мРНК в цитоплазме, то есть физическому сближению старт- и стоп-кодонов с помощью специальных белков.
Элонгация.
В процессе наращивания полипептидной цепи принимают участие два белковых фактора элонгации. Первый (EF1a у эукариот, EF-Tu - у прокариот) переносит аминоацилированную («заряженную» аминокислотой) тРНК в А (аминоацил)-сайт рибосомы. Рибосома катализирует перенос пептида, связанного с тРНК в Р-сайте, в А-сайт и образование пептидной связи с находящимся там аминокислотным остатком. Таким образом растущий пептид удлиняется на один аминокислотный остаток. Затем второй белок (EF2 у эукариот, EF-G - у прокариот) катализирует так называемую транслокацию. Транслокация - перемещение рибосомы по мРНК на один триплет (примерно 20 ангстрем), в результате которого пептидил-тРНК оказывается вновь в Р-сайте, а «пустая» тРНК из P-сайта переходит в Е-сайт (от слова exit). тРНК из E-сайта диссоциирует спонтанно, после чего рибосома готова к новому циклу элонгации.
Терминация.
Терминация - окончание синтеза белка, осуществляется, когда в А-сайте рибосомы оказывается один из стоп- кодонов - UAG, UAA, UGA. Из-за отсутствия тРНК, соответствующих этим кодонам, пептидил-тРНК остаётся связанной с Р-сайтом рибосомы. Здесь в действие вступают специфические белки RF1 или RF2, которые катализируют отсоединение полипептидной цепи от мРНК, а также RF3, который вызывает диссоциацию мРНК из рибосомы. RF1 узнаёт в А-участке UAA или UAG; RF-2 - UAA или UGA. С UAA терминация эффективнее, чем с другими стоп-кодонами.

Компартментализация у эукариот. В отличие от прокариот, у которых биосинтез белка происходит непосредственно во время транскрипции соответствующих мРНК, для эукариот характерна строгая компартментализация всех процессов, происходящих во время биосинтеза белка, в том числе и компартментализация трансляции.
Трансляция мРНК секреторных и мембранных белков (обычно они составляют 3-15 % от всех синтезируемых клеткой белков) происходит на рибосомах, связанных с гранулярной эндоплазматической сеткой. По классическим представлениям, ещё 35-45 % рибосом связаны с цитоскелетом, а оставшиеся 20-40 % рибосом находятся в несвязанном состоянии в цитозоле. Однако высказываются предположения, что свободные рибосомы являются артефактом, и в клетке они связаны с так называемой микротрабекулярной решеткой, образованной особым типом филаментов. Впрочем, по другим данным, само существование микротрабекулярной решетки ставится под сомнение, так что вопрос о существовании активных несвязанных рибосом остаётся открытым.
В настоящее время высказывается гипотеза, что трансляция у эукариот происходит не во всей цитоплазме клетки, а в отдельных областях цитоплазмы, условно называемых «трансляционными компартментами».
Компартментализация трансляции обеспечивает высокую скорость биосинтеза белка и широкие возможности регуляции этого процесса.
Лекция 10. Фолдинг.
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
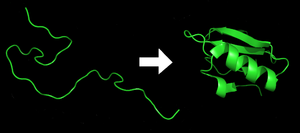
Переход первичной структуры полипептида (слева) в третичную структуру (справа).
Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура - конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостики между пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами. Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков (прионы).
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его аминокислотной последовательности.
Нарушения в процессе фолдинга и последующие нарушения третичной структуры белка связывают с конформационными (нарушение в 3D) болезнями и прионами.
Прио́ны (англ. prion от protein «белок» + infection «инфекция»; слово предложено в 1982 году Стенли Прузинером) - особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот. Это положение лежит в основе прионной гипотезы, однако насчёт состава прионов есть и другие точки зрения.
Прионы способны увеличивать свою численность, используя функции живых клеток (в этом отношении прионы схожи с вирусами). Прион - это белок с аномальной третичной структурой, способный катализировать конформационное превращение гомологичного ему нормального клеточного белка в себе подобный (прион). Как правило, при переходе белка в прионное состояние его α-спирали превращаются в β-слои. Появившиеся в результате такого перехода прионы могут в свою очередь перестраивать новые молекулы белка; таким образом, запускается цепная реакция, в ходе которой образуется огромное количество неправильно свёрнутых молекул. Прионы - единственные известные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот.
Все известные прионы вызывают формирование амилоидов - белковых агрегатов, включающих плотно упакованные β-слои. Амилоиды представляют собой фибриллы, растущие на концах, а разлом фибриллы приводит к появлению четырёх растущих концов. Инкубационный период прионного заболевания определяется скоростью экспоненциального роста количества прионов, а она, в свою очередь, зависит от скорости линейного роста и фрагментации агрегатов (фибрилл). Для размножения приона необходимо исходное наличие нормально уложенного клеточного прионного белка; организмы, у которых отсутствует нормальная форма прионного белка, не страдают прионными заболеваниями.
Прионная форма белка чрезвычайно стабильна и накапливается в поражённой ткани, вызывая её повреждение и, в конечном счёте, отмирание. Стабильность прионной формы означает, что прионы устойчивы к денатурации под действием химических и физических агентов, поэтому уничтожить эти частицы или сдержать их рост тяжело. Прионы существуют в нескольких формах - штаммах, каждый со слегка отличной структурой.
Прионы вызывают заболевания - трансмиссивные губчатые энцефалопатии (ТГЭ) у различных млекопитающих, в том числе губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). У человека прионы вызывают болезнь Крейтцфельдта - Якоба, вариант болезни Крейтцфельдта - Якоба (vCJD), синдром Герстмана - Штраусслера - Шейнкера, фатальную семейную бессонницу и куру. Все известные прионные заболевания поражают головной мозг и другие нервные ткани, в настоящее время неизлечимы и в конечном итоге смертельны.
Все известные прионные заболевания млекопитающих вызываются белком PrP. Его форма с нормальной третичной структурой называется PrPC (от англ. common «обычный» или cellular «клеточный»), а инфекционная, аномальная форма называется PrPSc (от англ. scrapie (скрейпи) «почесуха овец», одно из первых заболеваний с установленной прионной природой).
Первая открытая трансмиссивная губчатая энцефалопатия - почесуха овец (скрейпи). Первые её случаи были отмечены в Великобритании в 1700-х годах. При этом заболевании овцы страдали от сильнейшего зуда, из-за чего животным приходилось непрерывно тереться (англ. scrape) о деревья, откуда и пошло название болезни. Кроме этого, овцы испытывали боль при движении ногами и страдали от сильнейших припадков. Все эти симптомы являются классическими признаками повреждения мозга, и эта странная болезнь вводила учёных в заблуждение. Гораздо позже, в 1967 году, Чандлер (англ. Chandler) установил, что скрейпи могут болеть и мыши, что, несомненно, было прогрессом в изучении этого заболевания.
В двадцатом веке были описаны и прионные заболевания человека. В 1920-х годах Крейцфельдт и Якоб исследовали новое неизлечимое заболевание нервной системы человека, главным признаком которого было образование полостей в ткани мозга. Впоследствии эта болезнь была названа их именем.
В 1957 году Гайдузек и Зигас описали неврологический синдром, распространённый у народа форе, живущего в высокогорьях Папуа - Новой Гвинеи. Эта болезнь характеризовалась тремором, атаксией, на ранних стадиях - атетоидными движениями. К этим симптомам впоследствии прибавлялась слабость, деменция, болезнь неизбежно заканчивалась летальным исходом. На языке форе эта болезнь называется «куру», что в переводе означает «дрожь» или «порча»; под этим названием эта болезнь известна и сегодня. Оказалось, что причиной распространения куру был нередкий среди форе ритуальный каннибализм. В ходе религиозных ритуалов они поедали органы убитых родичей. Мозг при этом ели дети, поскольку считалось, что от него у детей «прибавлялось ума». Инкубационный период заболевания может составлять до 50 лет, однако у девушек, особенно подверженных куру, он может составлять всего лишь четыре года или менее
Развитие представлений о прионах.
В 1960-х годах, радиобиолог Альпер и математик Гриффит, выдвинули гипотезу, что некоторые трансмиссивные губчатые энцефалопатии вызываются патогенами, состоящими исключительно из белков. Они пытались объяснить тот факт, что таинственный инфекционный агент, вызывающий почесуху овец и болезнь Крейтцфельдта - Якоба, очень устойчив к ионизирующему излучению. Доза радиации, необходимая для уничтожения половины частиц инфекционного агента, зависит от их размера: чем меньше такая частица, тем меньше вероятность попадания в неё заряженной частицы. Так и было установлено, что прион слишком мал для вируса.
Объяснения распространения почесухи овец содержала противоречие с «Центральной догмой молекулярной биологии». Поток информации от белка к белку или от белка к ДНК или РНК невозможен.
В 1982 году Прузинер сообщил, что его группа выделила гипотетический инфекционный агент (прион) и что он состоит в основном из одного белка и в 1997 году был удостоен Нобелевской премии по физиологии или медицине.
Белок, из которого состоят прионы (PrP), можно найти во всех частях тела у здоровых людей и животных. Однако в поражённых тканях присутствует PrP, имеющий аномальную структуру и устойчивый к протеазам (ферментам, гидролизующим белки). Нормальная форма называется PrPC, а инфекционная - PrPSc.
PrPC - нормальный мембранный белок млекопитающих, который у человека кодируется геном PRNP. мРНК PRNP человека кодирует полипептид длиной 253 аминокислотных остатка (а. о.), который в процессе созревания укорачивается клеточными ферментами. Зрелая форма PrP состоит из 208 аминокислотных остатков и имеет молекулярную массу 35 - 36 кДа. Помимо ограниченного протеолиза, PrP подвергается и другим посттрансляционным модификациям: N-гликозилированию по положениям Asn-181 и Asn-197, присоединению гликозилфосфатидилинозитола к Ser-230 и образованию дисульфидной связи между Cys-179 и Cys-214. Аминокислотные остатки, вовлечённые во все перечисленные посттрансляционные модификации, высоко консервативны у млекопитающих. Образование PrPC происходит в ЭПР, дальнейшее созревание - в комплексе Гольджи, откуда он при помощи мембранных везикул доставляется к плазматической мембране. После этого он либо закрепляется на мембране после разрушения эндосомы, либо же подвергается эндоцитозу и разрушается в лизосомах.
В отличие от нормальной, растворимой формы белка, прионы осаждаются высокоскоростным центрифугированием, что является стандартным тестом на наличие прионов. PrPC обладает высоким сродством к катионам двухвалентной меди. Значение этого факта неясно, но, возможно, это имеет какое-то отношение к его структуре или функциям. Есть данные, что PrP играет важную роль в прикреплении клеток, передаче внутриклеточных сигналов, а потому может быть вовлечён в коммуникацию клеток мозга. Тем не менее, функции PrP исследованы недостаточно.
PrPSc - дефектный.
Инфекционная изоформа PrP - PrPSc - способна превращать нормальный белок PrPC в инфекционную изоформу, изменяя его конформацию (то есть третичную структуру); это, в свою очередь, изменяет взаимодействия PrP с другими белками. Хотя точная пространственная структура PrPSc неизвестна, установлено, что в ней вместо α-спиралей преобладают β-слои. Такие ненормальные изоформы объединяются в высокоструктурированные амилоидные волокна, которые, скапливаясь, формируют бляшки. Неясно, являются ли эти образования причиной повреждения клеток или всего лишь побочным продуктом патологического процесса. Конец каждого волокна служит своего рода затравкой, к которой могут прикрепляться свободные белковые молекулы, в результате чего фибрилла растёт. В большинстве случаев присоединяться могут только молекулы PrP, идентичные по первичной структуре PrPSc (поэтому обычно передача прионов видоспецифична). Однако, возможны и случаи межвидовой передачи прионов.
 Механизм размножения прионов.
Механизм размножения прионов.
Гетеродимерная модель размножения прионов
Согласно этой гипотезе, одна молекула PrPSc присоединяется к одной молекуле PrPC и катализирует её переход в прионную форму. После этого они расходятся и продолжают превращать другие. Однако, модель размножения (репликации) прионов должна объяснять не только механизм размножения прионов, но и то, почему спонтанное появление прионов столь редко. Гетеродимерная модель требует, чтобы PrPSc был фантастически эффективным катализатором: он должен повышать частоту обращения нормального белка в прионную форму в 1015 раз. Такой проблемы не возникает, если допустить, что PrPSc существует только в агрегированной (например, амилоидной) форме, где кооперативность выступает как барьер для спонтанного перехода в прионную форму. Вдобавок к этому, несмотря на приложенные усилия, выделить мономерный PrPSc так и не удалось.
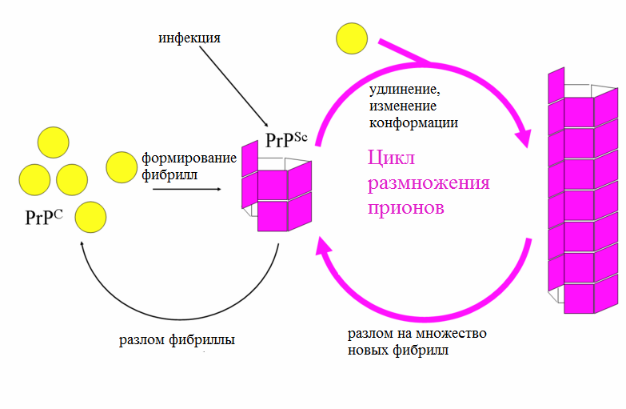 Фибриллярная модель размножения прионов
Фибриллярная модель размножения прионов
Альтернативная фибриллярная модель предполагает, что PrPSc существует только в виде фибрилл, при этом концы фибрилл связывают PrPС, где он превращается в PrPSc. Если бы это было только так, то численность прионов возрастала бы линейно. Однако по мере развития прионного заболевания наблюдается экспоненциальный рост количества PrPSc и общей концентрации инфекционных частиц. Это можно объяснить, если принять во внимание разлом фибрилл. В организме разламывание фибрилл осуществляется белками-шаперонами, которые обычно помогают очистить клетку от аггрегированных белков.
Механизм репликации прионов имеет значение для разработки лекарств. Поскольку инкубационный период прионных заболеваний чрезвычайно долог, эффективному лекарству вовсе необязательно уничтожить все прионы, достаточно лишь снизить скорость экспоненциального роста их количества. Моделирование предсказывает, что самым эффективным препаратом был бы такой, который связывается с концами фибрилл и блокирует их рост.
Одним из объяснений нейродегенерации, вызываемой прионами, может быть нарушение функционирования PrP. Однако нормальная функция этого белка изучена плохо. Данные in vitro указывают на множество разнообразных ролей, а эксперименты на мышах, «нокаутных» по этому гену, дали относительно немного информации, поскольку у этих животных наблюдались лишь малые отклонения от нормы. Недавние исследования, проведённые на мышах, показали, что расщепление PrP в периферических нервах активирует восстановление их миелинового слоя шванновскими клетками и что отсутствие PrP приводит к демиелинизации нервов, наблюдается изменённая гиппокампальная долговременная потенциация и проблемы с памятью, экспрессия гена Prnp в гемопоэтических стволовых клетках необходима для самоподдержания костного мозга.
Гипотезы о составе прионов.
«Чисто белковая» гипотеза.
До открытия прионов считалось, что все инфекционные агенты используют для размножения нуклеиновые кислоты. «Чисто белковая» гипотеза постулирует, что белковая структура может размножаться без участия нуклеиновых кислот. Первоначально считалось, что эта гипотеза противоречит центральной догме молекулярной биологии, согласно которой нуклеиновые кислоты служат единственным способом передачи наследственной информации, однако в настоящее время считается, что хотя прионы способны к переносу информации без участия нуклеиновых кислот, они неспособны передавать информацию на нуклеиновые кислоты.
Доказательства, говорящие в пользу «чисто белковой» гипотезы:
прионные заболевания не удалось достоверно связать ни с вирусными, ни с бактериальными, ни с грибковыми возбудителями;
инфективность прионов, насколько известно, не связана с нуклеиновыми кислотами; прионы устойчивы к нуклеазам и ультрафиолетовому излучению, губительно сказывающихся на нуклеиновых кислотах;
прионы не вызывают иммунного ответа;
у организма, заражённого прионом от другого вида, не обнаруживается PrPSc с аминокислотной последовательностью приона вида-донора, следовательно, репликации приона донора не происходит;
в семьях мышей с мутацией гена PrP имеют место наследственные прионные заболевания, несмотря на жёсткий контроль условий содержания, исключающий заражение извне;
животные, не имеющие белка PrPC, не подвержены прионным заболеваниям.
Дата: 2019-03-05, просмотров: 543.