Нейтральные белки в воде не имеют заряда и не изменяют рН среды. При изображении схемы нейтрального белка количество карбоксильных (-СООН) и аминогрупп (-NH2) должно быть одинаковым.
├ СООН HOH - ├ COO - + H + - ├ COO -
+ H 2 O
├ NH 2 + ├ NH 3 + + OH - +├ NH 3 +
| Схема нейтрального белка |
| pH = 7 pH среды, в которую помещен белок. Ион белка в данной среде имеет заряд = 0 |
| Среда, которую создает белок после диссоциации, нейтральна, т. к. количество ионов Н+ равно количеству ионов ОН- |
Кислые белки в воде заряжаются отрицательно и создают кислую среду. При изображении схемы кислого белка количество карбоксильных (-СООН) групп преобладает над количеством аминогрупп (-NH2).
├ СООН HOH - ├ COO - + H + - ├ COO - + Н+
├ COOH - ├ COO - + H + - ├ COO - + H 2 O
| Схема кислого белка |
| pH = 7 pH среды, в которую помещен белок. Ион белка в данной среде имеет заряд ( ─ ) |
| Среда, которую создает белок после диссоциации, кислая, т. к. количество ионов Н+ больше, чем количество ионов ОН- |
├ NH 2 + ├ NH 3 + + OH - + ├ NH 3 +
Основные белки в воде заряжаются положительно и создают щелочную среду. При изображении схемы основного белка количество аминогрупп (-NH2) преобладает над количеством карбоксильных (-СООН) групп.
├ СООН HOH - ├ COO - + H + - ├ COO -
├ NH 2 + ├ NH 3 + + О H - + ├ NH 3 + + H 2 O
| Схема основного белка |
| pH = 7 pH среды, в которую помещен белок. Ион белка в данной среде имеет заряд ( + ) |
| Среда, которую создает белок после диссоциации, щелочная, т. к. количество ионов ОН- больше, чем количество ионов Н+ |
├ NH 2 + ├ NH 3 + + OH - +├ NH 3 + + ОН-
Для решения задачи необходимо
1. По ИЭТ определить тип белка (кислый, основной, нейтральный).
2. Изобразить схему белка.
3. Написать уравнение диссоциации белка при рН = 7.
4. Определить, какую среду создает белок при диссоциации.
5. Показать влияние ионов Н+ и 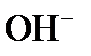 на белок и изменение его заряда.
на белок и изменение его заряда.
ПРИМЕРЫ Решения задач
Задача №1
ИЭТ = 5. Какой это белок? Как будет заряжен белок при рН = 4, при рН = 6, при рН = 7,5? Показать на схеме.
Решение
1. ИЭТ ниже 7, значит белок кислый.
2. Изображаем схему белка с преобладанием карбоксильных групп - СООН .
3. Показываем диссоциацию данного белка при рН = 7.
4. Смотрим, как заряжается ион белка и какую среду создает белок.
├ СООН HOH -├ COO - + H + -├ COO - + Н+
├ СООН -├ COO - + H + -├ COO - + Н+
├ СООН -├ COO - + H + -├ COO - + H 2 O
├ NH 2 +├ NH 3 + + OH - +├ NH 3 +
| pH = 7 pH среды, в которую помещен белок. Ион белка в данной среде имеет заряд (- 2) |
| Белок создает кислую среду, так как количество ионов Н+ больше, чем количество ионов ОН- |
5. При помещении белка в кислую среду с рН = 6: ионы Н+ данной среды частично понижают диссоциацию белка по карбоксильной группе (-СООН).
Понижение диссоциации на схеме можно изобразить стрелочкой. По схеме надо добавить столько ионов Н+, чтобы создать концентрацию ионов Н+ больше прежней.
├ СОО- + Н+ - ├ COO - + H + - ├ COO - + Н+ + Н+
├ СОО- + Н+ - ├ COO - + Н+ + Н+ 0 ├ COO Н + Н+
├ СОО- + Н+ + Н+ 0├ COO Н + H + 0 ├ COO Н + H +
| pH = 6 Отрицательный заряд понижается. По нашей схеме до (- 1) |
| pH = 5 = ИЭТ Заряд равен 0 |
├ NH 3 + + H 2 O + ├ NH 3 + + H 2 О +├ NH 3 + + H 2 O
6. При помещении белка в среду с рН = ИЭТ = 5 происходит дальнейшее подавление диссоциации белка по карбоксильной (–СООН) группе, т.к. при данном значении рН концентрация ионов Н+ больше, чем при рН = 6.
По схеме надо добавить столько ионов Н+, чтобы при понижении диссоциации белок потерял заряд и перешел в изоэлектрическое состояние. По условию задачи белок надо поместить еще в среду с рН = 4, где концентрация ионов Н+ еще больше, чем при рН = 5. Следовательно, по схеме надо добавить еще ионов Н+.
0 ├ COO Н + Н+
0 ├ COO Н + Н+
0 ├ COO Н + Н+
| pH = 4 Заряд положительный. По нашей схеме (+1) |
+ ├ NH 3 + + Н2О
7. Для того чтобы показать, как заряжен белок при рН = 7,5, удобнее использовать схему белка при рН = 7.
- ├ COO - + Н+ + ОН- -├ COO - + НОН
- ├ COO - + Н+ + ОН- -├ COO - + НОН
- ├ COO - + H 2 O -├ COO - + H 2 O
+├ NH 3 + + ОН- + ОН- 0├ NH 2 + H ОН + ОН-
| pH = 7,5 Заряд отрицательный. По нашей схеме (- 3) |
При помещении белка в щелочную среду происходит нейтрализация ионов Н+ и понижение диссоциации аминогруппы (-NH2). По схеме надо добавить столько ионов ОН-, чтобы их хватило для нейтрализации ионов Н+ и создания повышенной концентрации.
Задача №2
ИЭТ = 7,5. Какой это белок? Как заряжен при рН = 8, при рН = 6? Показать на схеме.
Решение
1. ИЭТ > 7, следовательно, белок основной.
2. Изображаем схему основного белка с преобладанием аминогрупп
(-NH2).
3. Показываем, как идет диссоциация белка при рН = 7.
4. Определяем знак заряда иона белка и среду, которая создается после диссоциации.
├ СООН HOH - ├ COO - + H + - ├ COO - + H 2 O
├ NH 2 + ├ NH 3 + + OH - + ├ NH 3 +
├ NH 2 + ├ NH 3 + + OH - + ├ NH 3 + + OH -
├ NH2 + ├ NH3+ + OH- + ├ NH3+ + OH-
| pH = 7 Заряд положительный. По нашей схеме (+ 2) |
| Создает щелочную среду, т. к. количество ионов ОН- больше, чем количество ионов Н+ |
5. Помещаем белок в щелочную среду с рН = 7,5. Ионы ОН- данной среды понижают диссоциацию белка по аминогруппе (–NH2).
По схеме надо добавить столько ионов ОН-, чтобы при понижении диссоциации белок потерял заряд и перешел в изоэлектрическое состояние.
- ├ COO - + H 2 O - ├ COO - + H 2 О - ├ COO - + H 2 O
+├ NH 3 + + OH - + ОН- 0├ NH 2 + НОН + OH - 0 ├ NH 2 + Н OH - + ОН-
+├ NH 3 + + OH - + ОН- 0├ NH 2 + H 2 О + ОН- 0 ├ NH 2 + H 2 О + OH -
| pH = 7,5 = ИЭТ Заряд равен нулю |
| рН = 8 Заряд отрицательный. По нашей схеме (- 1) |
+├ NH 3 + + OH - +├ NH 3 + + OH - + ОН- 0 ├ NH 2 + H 2 О + OH -
6. По условию задачи белок надо поместить в среду с рН = 8. При рН = 8 концентрация ионов ОН- больше, чем при рН = 7,5. Следовательно, по схеме надо еще добавить ионов ОН-. Белок зарядился отрицательно.
7. Для того чтобы показать, как заряжен данный белок при рН = 6, следует использовать схему данного белка при рН = 7. При помещении белка в кислую среду происходит нейтрализация ионов ОН- и понижение диссоциации по карбоксильным (-СООН) группам. По схеме надо добавить столько ионов Н+, чтобы их хватило для нейтрализации ионов ОН - и создания повышенной концентрации.
- ├ COO - + H + + Н+ 0 ├ COO Н + H +
+ ├ NH 3 + + Н2О + ├ NH 3 + + Н2О
+ ├ NH 3 + + ОН- + Н+ + ├ NH 3 + + H О H
+ ├ NH 3 + + OH - + Н+ + ├ NH 3 + + H О H
| рН = 6 Заряд положительный. По нашей схеме (+ 3) |
Дата: 2019-03-05, просмотров: 1539.