МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ДКР
В соответствии с учебным планом по дисциплине «Химия физическая и коллоидная» следует выполнить одну домашнюю контрольную работу (ДКР). Выполнение ДКР носит самостоятельный характер. ДКР выдаётся в первую сессию изучения дисциплины и часть материала обучающиеся должны изучить самостоятельно. К написанию домашней контрольной работы следует приступать только после полного изучения курса с использованием предложенной литературы, записей в тетради, данного учебно-методического пособия и интернет-ресурсов.
Домашняя контрольная работа, отражающая текущий контроль знаний обучающихся заочной и очно-заочной форм, предназначена для самостоятельного изучения отдельных вопросов теоретического материала и практического выполнения заданий.
Выполнение ДКР осуществляется в соответствии с вариантом, номер которого определяется по двум последним цифрам зачётной книжки (приложение А).
Ответы на вопросы ДКР должны строго соответствовать своему варианту. При оформлении ДКР вопросы переписываются полностью, а затем пишется развёрнутый ответ. Ответ должен быть конкретным.
Структура ДКР включает 2 теоретических вопроса и 2 практических, представленных задачами. В процессе выполнения ДКР оформляется отчет, включающий следующие разделы:
o Титульный лист (приложение Б);
o Задание 1, 2, 3,4;
o Библиографический список.
Отчет по ДКР принимается в сброшюрованном печатном (или письменном) виде на листах формата А4 (210*297) или написанный в тетради.
Титульный лист является первой страницей домашней контрольной работы и заполняется по строго определенным правилам.
Основная часть. Содержание выполняемых заданий этой части должно точно соответствовать теме задания и полностью ее раскрывать. Задания по ДКР должны показать умение исследователя сжато, логично и аргументированно излагать материал, обобщать, анализировать, делать логические выводы, необходимые рисунки, схемы от руки, если требуется по заданию, с соответствующим оформлением, подписями и объяснениями к ним.
Требования к оформлению текста в ДКР:
- левое поле – 3 см, правое – 1,5 см, верхнее и нижнее – 2 см;
- тип шрифта – Times New Roman;
- кегль шрифта – 14 пт. (1 пт=0,35 мм);
- межстрочный интервал – 1,5;
- выравнивание текстов должно быть по ширине листа;
- красная строка 1,25 см.
Заголовкизаданий оформляются по центру и каждый на новом листе. После заголовка делается пропуск строки и далее пишется сам текст.
В конце работы приводится список литературы, использованной при выполнении ДКР, с указанием авторов и года издания, ставится дата окончания ДКР и подпись.
Контрольная работа должна быть зачтена до сдачи зачета, в противном случае обучающийся до зачета не допускается.
При проверке отчета по ДКР преподавателем указываются замечания, требующие доработки. Если замечаний нет, на титуле отчета прописывается «Зачтено». В противном случае на титуле отчета прописывается «На доработку» и работа выдается обучающемуся повторно. В журнале преподаватель делает соответствующие записи. После проработки обучающимся незачтенных вопросов преподавателем осуществляется повторная проверка ДКР (повторная распечатка ДКР после доработки замечаний не требуется). Если замечаний нет, на титульном листе прописывается «Зачтено» с соответствующей отметкой в журнале.
КРИТЕРИИ ОЦЕНИВАНИЯ ДКР
Результаты текущего контроля в форме домашней контрольной работы оцениваются посредством интегральной (целостной) двухуровневой шкалы. Оценка «зачтено» ставится, если обучающийся овладел элементами дескрипторов компетенций в рамках определенного уровня, показано владение как теоретическим, так и практическим материалом, проработаны все задания ДКР, могут быть допущены незначительные ошибки, которые могут быть устранены после устного собеседования.
Если обучающийся не овладел элементами дескрипторов компетенций в рамках определенного уровня, обнаружил существенные пробелы в знании теоретического и практического материала, контрольная работа не соответствует варианту, выполнены не все задания (не выполнено более 2 заданий) или в работе содержатся грубейшие ошибки в работе, то обучающийся получает оценку «не зачтено» (см. таблицу 2).
Критерии и шкала оценивания домашней контрольной работы по дисциплине «Химия физическая и коллоидная» представлены в таблице 1.
Таблица 1 – Критерии и шкала и оценивания ответов на вопросы домашней контрольной работы
| Планируемые результаты обучения | Критерии оценивания |
| 1 уровень (низкий) | |
| Знания | Неполное обоснование теоретического вопроса, требующее наводящих вопросов |
| Умения | Поиск необходимой информации с помощью преподавателя |
| Навыки и (или) опыт деятельности | Правильность выполнения практических заданий по аналогии |
| 2 уровень (средний) | |
| Знания | Глубокие знания теоретического материала и умение их применять |
| Умения | Поиск необходимой информации с использованием учебно-методической литературы, возможны единичные ошибки |
| Навыки и (или) опыт деятельности | Правильность выполнения практических заданий |
| 3 уровень (высокий) | |
| Знания | Глубокие знания теоретического материала и умение их применять, комплексная оценка по предложенным вопросам |
| Умения | Последовательный и правильный поиск необходимой информации с использованием учебно-методической литературы, умение обоснованно излагать свои мысли, делать необходимые выводы |
| Навыки и (или) опыт деятельности | Правильность выполнения практических заданий с применением творческих проектных решений |
Результаты текущего контроля в форме домашней контрольной работы оцениваются посредством интегральной (целостной) двухуровневой шкалы, представленной в таблице 2.
Таблица 2 - Шкала и показатели оценивания ответов на вопросы домашней контрольной работы
| Шкала оценивания | Показатели оценивания |
| Зачтено | Обучающийся овладел элементами дескрипторов компетенций в рамках определенного уровня: - знания теоретического материала по дисциплине «Химия физическая и коллоидная» усвоены в полном объеме; - корректно и правильно оформил материал домашней контрольной работы; - давал верные ответы на уточняющие дополнительные вопросы преподавателя. |
| Не зачтено | Обучающийся не овладел элементами дескрипторов компетенций в рамках определенного уровня: - обнаружил существенные пробелы в знании теоретического материала по дисциплине «Химия физическая и коллоидная»; - представил домашнюю контрольную работу, не удовлетворяющую требованиям к ее выполнению; - не представил домашнюю контрольную работу для защиты в указанные сроки; - не отвечал на уточняющие дополнительные вопросы преподавателя. |
К сдаче промежуточного контроля в форме зачёта допускаются только студенты, имеющие зачтенную контрольную работу.
Вопросы для написания домашней контрольной работы
1. История развития физколлоидной химии.
2. Агрегатные состояния вещества.
3. Первое начало термодинамики, его значение в природе.
4. Второе начало термодинамики. Энтропия.
5. Третий закон термодинамики. Уравнение Нернста. Постулат Планка.
6. Электрическая проводимость растворов, её практическое применение.
7. Удельная и эквивалентная электрическая проводимость растворов.
8. Химическая кинетика. Основные положения и понятия. Классификация химических реакций.
9. Катализ. Виды. Значение.
10. Ферменты как катализаторы. Влияние условий на активность ферментов. Практическое применение ферментов.
11. Фотохимические реакции. Фотосинтез. Значение.
12. Электроды. Классификация.
13. Гальванические элементы. Аккумуляторы. Топливные элементы. Применение.
14. Химическое равновесие. Влияние внешних условий. Закон действующих масс.
15. Эмульсии. Характеристика. Классификация. Применение.
16. Пены. Характеристика. Применение. Пенообразователи и пеногасители.
17. Аэрозоли. Характеристика. Свойства. Получение и разрушение аэрозолей. Значение.
18. Суспензии. Характеристика. Свойства. Получение и разрушение аэрозолей. Значение.
19. Теория растворов. Классификация растворов.
20. Свойства растворов: диффузия, осмос (экзосмос и эндоосмос), полупронициаемые мембраны.
21. Биологическое значение осмотического давления. Тургор и плазмолиз, значение; гемолиз, виды гемолиза.
22. Осмотическое давление. Закон Вант-Гоффа. Уравнение Вант- Гоффа для электролитов и для неэлектролитов. Изотонический коэффициент.
23. Изотонический, гипертонический, гипотонический, физиологический раствор, области их применения.
24. Температура замерзания и кипения растворов электролитов и неэлектролитов. Первый и второй законы Рауля. Депрессия раствора. Области применения данных законов.
25. Диссоциация. Моляризация. Электролиты (сильные, средней силы, слабые). Закон разбавления Оствальда.
26. Теория электролитической диссоциации Аррениуса. Постулаты. Константа диссоциации. Степень диссоциации. От каких факторов зависит данная величина.
27. Ионное произведение воды. Логарифмическая форма ионного произведения воды. Активная реакция среды. Показатели активной реакции среды.
28. Пределы изменений и измерений рН. Кислотность (общая, активная, потенциальная). Виды кислотности.
29. Методы определения рН (колориметрический и потенциометрический). Биологическое значение рН.
30. Теория сильных электролитов Дебая-Хюккеля. Концентрация растворов сильных электролитов. Активность электролита. Ионная сила раствора.
31. Буферные системы. Виды буферных систем. Буферные растворы. Буферные системы крови. Значение.
32. Механизм действия буферных систем. Показать на конкретном примере. Буферная ёмкость. Расчёт буферной ёмкости. Буферное действие.
33. Биологическое значение буферных растворов. Алкалоз. Ацидоз.
34. Дисперсные системы. Дисперсная фаза и дисперсная среда.Признаки дисперсной среды: гетерогенность, дисперсность, межфазная поверхность
35. Классификация дисперсных систем по степени дисперсности и по интенсивности взаимодействия дисперсной среды и дисперсной фазы.
36. Классификация дисперсных систем по агрегатному состоянию дисперсной среды и дисперсной фазы, по форме частиц и характеру подвижности дисперсной фазы.
37. Поверхностная энергия. Поверхностное натяжение.
38. Адсорбция. Абсорбция. Сорбция. Адсорбент. Адсорбат.
39. От чего зависит величина адсорбции? Понятие элюции.
40. Виды адсорбции: физическая и химическая.
41. Адсорбция на границе раствор-газ
42. Изотерма адсорбции Гиббса.
43. Понятие о поверностно-активных веществах и поверхностно-инактивных веществах.
44. Правило Траубе-Дюкло.
45. Адсорбция на границе твёрдое тело-раствор
46. Адсорбция на границе твёрдое тело-газ.
47. Теория мономолекулярной адсорбции Лэнгмюра
48. Теория полимолекулярной адсорбции Поляни
49. Хроматография. Сущность, виды.
50. Золи. Размер частиц золя. Характеристика золей.
51. Адсорбция из растворов электролитов: ионнообменная и специфическая. Правило Пескова-Фаянса.
52. Методы получения золей: конденсационный, дисперсионный, пептизация. Виды пептизации. Правило осадка.
53. Методы очистки золей.
54. Оптические свойства золей: полихромия, рассеивание света, опалесценция.
55. Молекулярно-кинетические свойства золей: вязкость, броуновское движение, диффузия, осмос, осмотическое давление.
56. Электрокинетические свойства золей: электрофорез, наличие заряда коллоидных частиц, коагуляция.
57. Коагуляция и седиментация. Сущность. Взаимная коагуляция.
58. Ионы коагуляторы. Порог коагуляции. Правило Шульце-Гарди. Стадии коагуляции.
59. Коагуляция. Автокоагуляция (старение золей).
60. Свойства лиофильных дисперсных систем, отличия от лиофобных дисперсных систем.
61. Гидратная оболочка. Набухание и растворение.
62. Белки. Виды белков. Изменение заряда белка в зависимости от рН среды. Понятие об изоэлектрической точке и изоэлектрическом состоянии.
63. Виды коагуляции белков: высаливание и денатурация. Сущность.
64. Коллоидная защита. Сущность. Зольное число.
65. Гели и студни. Особенности строения. Классификация гелей. Свойства гелей и студней.
66. Солюбилизация. Значение.
67. Спинномозговая жидкость замерзает при температуре -0,4 0 С. Рассчитайте её осмотическое давление при 370 С.
68. Какой раствор замерзает при более низкой температуре: 3 % раствор глюкозы с молекулярной массой 180 г/моль или 3 % раствор мочевины с молекулярной массой 60 г/моль.
69. Рассчитать температуру замерзания и кипения 20 % раствора глицерина с молекулярной массой 92 г/моль.
70. Водный раствор сахарозы замерзает при температуре -0,093 0С. Вычислить моляльную концентрацию раствора?
71. Что произойдет с эритроцитами крови, если в пробу крови попала дистиллированная вода? Что такое изотонический, гипотонический и гипертонический растворы?
72. Определить рН буферного раствора, если он состоит из 5 мл 0,01 Н раствора NH4Cl и 15 мл 0,01 Н раствора NH4ОН. Константа диссоциации основания=1,8 х 10-5.
73. Рассчитать моляльную, нормальную и процентную концентрацию раствора, содержащего 10 г глюкозы в 180 мл воды. Молекулярная масса глюкозы 180 г/моль.
74. Вычислить рОН бикарбонатной буферной системы, состоящей из 5,0 мл 0,1 Н раствора NaHCO3 и 10,0 мл 0,1 Н раствора H2CO3. Константа диссоциации кислоты=3,7 х 10-7.
75. Что такое осмос? Полупроницаемая мембрана? Виды полупроницаемых мембран. Будет ли происходит осмос и в каком направлении, если полупроницаемой мембраной разделить 0,1 М растворы глюкозы и CaCL2? Объяснить почему?
76. рН одного раствора равна 2, рН второго раствора равна 6. Какой раствор кислее другого и во сколько раз? Определить Сн+ растворов.
77. В какой последовательности замерзают 10% растворы сахара (М=342); глюкозы (М=180); этиленгликоля (М=94).
78. Что такое буферная ёмкость? В какой из систем больше кислотная буферная ёмкость (объяснить почему):
10 мл 0,1 НСН3СООН 20 мл 0,1 НСН3СООН
20 мл 0,1 НСН3СООNa 10 мл 0,1 НСН3СООNa
79. Что такое буферная ёмкость? В какой из систем больше кислотная буферная ёмкость (объяснить почему):
5 мл 0,1 Н СН3СООН 20 мл 0,1 Н СН3СООН
20 мл 0,1 Н СН3СООNa 5 мл 0,1 Н СН3СООNa
80. Осмотическое давление. Закон Вант-Гоффа. Будет ли наблюдаться осмос, если полупроницаемой мембраной разделить 0,1 М раствор мочевины и глюкозы;0,1 М и 0,01 М растворы глюкозы?
81. Водный раствор глюкозы имеет осмотическое давление 9 атмосфер при 27 0С. Рассчитать его температуры замерзания и кипения?
82. Являются ли изотоничными 0,2 М растворы мочевины, глюкозы и хлорида натрия. Объяснить почему?
83. Что такое буферная ёмкость? В какой из систем больше щелочная буферная ёмкость (объяснить почему):
5 мл 0,1 НСН3СООН 20 мл 0,1 НСН3СООН
20 мл 0,1 НСН3СООNa 5 мл 0,1 НСН3СООNa
84. Клеточный сок растений имеет осмотическое давление равное 8 атмосферам, почвенный раствор 2,5 атмосферам. В каком направлении происходит движение воды. Ответ обосновать.
85. Вычислить процентную концентрацию водного раствора глицерина (М = 92 г/моль), если он замерзает при - 0,520С.
86. Как приготовить 1 л 2 М раствора мочевины. Что такое молярная, децимолярная, сантимолярная и милимолярная концентрация?
87. Водный раствор сахара, содержащий 0,17 г сахара в 25 мл воды, замерзает при температуре = -0,037 0С. Определить молекулярную массу сахара.
88. Вычислить рОН буферной смеси, состоящей из 8,0 мл 0,1 Н раствора NH4ОH и 2,0 мл 0,1 Н раствора NH4Cl. К диссоциации NH 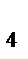 OH = 1,77∙10-5.
OH = 1,77∙10-5.
89. Вычислить рН фосфатной буферной системы, состоящей из 5 мл Na2НРО4 и 10 мл NaН2РО4 одинаковой концентрации. Константа диссоциации Н2РО4- =1,54 х 10-7.
90. Как объяснить благоприятное действие на гнойную рану повязки, смоченной гипертоническим раствором поваренной соли.
91. Рассчитать осмотическое давление 10 % раствора поваренной соли.
92. Найти рН ацетатной буферной смеси, состоящей из 100 мл 0,1н СН3СООН и 200 мл 0,2н CH3COONa. Кк-ты = 1,75 ∙ 10-5.
93. Найти рОН буфера, состоящего из 25,0 мл 0,01 Н раствора СН3СООН и 10,0 мл 0,01 Н раствора CН3COONa. Кк-ты = 1,85 х 10-5.
94. Рассчитать температуру замерзания и кипения 20% раствора сахара (М=342).
95. При наступлении холодов в клетках растений протекают процессы превращения крахмала в глюкозу. Какова роль этого процесса в повышении холодоустойчивости растений.
96. Даны 0,1 М растворы NaCL и K2SO4. Какой из них обладает большим осмотическим давлением и почему? Будет ли наблюдаться осмос, если эти растворы разделить полупроницаемой мембраной.
97. Найти температуру замерзания крови, если она имеет осмотическое давление равное 7,6 атмосферы при температуре 36 0С.
98. Вычислить рОН буферной смеси, состоящей из 10,0 мл 0,2 Н раствора NH4ОH и 20,0 мл 0,1 Н раствора NH4Cl. КNH 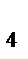 OH = 1,77 х 10-5.
OH = 1,77 х 10-5.
99. При какой температуре замерзает 55% раствор этиленгликоля (антифриз)? М этиленгликоля = 62 г/моль.
100. Что выгоднее применить для коагуляции положительно заряженного золя: Ca3(PO4)2 или K2SO4. Ответ объяснить.
101. Строение коллоидной частицы Строение коллоидной частицы AgCl, полученной при избытке AgNO3. Формула мицеллы.
102. AgCl, полученной при избытке HCl. Формула мицеллы.
103. Строение коллоидной частицы AgI, полученной при избытке HI. Формула мицеллы.
104. Строение коллоидной частицы PbI2, полученной при избытке HI. Формула мицеллы.
105. Строение коллоидной частицы AgI, полученной при избытке AgNO3. Формула мицеллы.
106. Какой из электролитов КСl, CaCl2, AlCl3 будет иметь наименьший порог коагуляции для положительно заряженного золя Na2SO4? Ответ объяснить.
107. Строение коллоидной частицы PbI2, полученной при избытке Pb(NO3)2. Формула мицеллы.
108. Какой из электролитов КСl, CaCl2, AlCl3 будет иметь наименьший порог коагуляции для положительно заряженного золя BaSO4? Ответ объяснить.
109. Напишите формулу мицеллы золя BaSO4, коагуляцию которого вызывают катионы, указать её составные части.
110. Записать формулу мицеллы золя берлинской лазури, полученного при избытке FeCl3, указать её составные части. 4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12KCl
111. Записать формулу мицеллы золя берлинской лазури, полученного при избытке K4[Fe(CN)6], указать её составные части. 4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12KCl
112. Записать формулу мицеллы золя Cu2[Fe(CN)6]3, полученного при избытке K4[Fe(CN)6], указать её составные части. 2CuCl2 + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl
113. Записать формулу мицеллы золя Cu2[Fe(CN)6]3, полученного при избытке CuCl2, указать её составные части. 2CuCl2 + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl
114. Записать формулу мицеллы золя PbCl2, полученного при избытке Pb(NO3)2, указать её составные части.
115. Записать формулу мицеллы золя PbCl2, полученного при избытке HCl, указать её составные части.
116. Записать формулу мицеллы золя PbS, полученного при избытке Pb(NO3)2, указать её составные части.
117. Записать формулу мицеллы золя PbS, полученного при избытке H2S, указать её составные части.
118. Строение мицеллы золя СаСО3 полученной при избытке Н2СО3. Формула мицеллы.
119. Строение коллоидной частицы AgBr, полученной при избытке AgNO3. Формула мицеллы.
120. Строение коллоидной частицы PbI2, полученной при избытке NaI. . Формула мицеллы.
121. Строение мицеллы СаСО3 полученной при избытке СаСI2. Формула мицеллы.
122. Объяснить конденсационный метод очистки коллоидных систем. Записать формулу мицеллы золя Al(OH)3, полученную при избытке NaOH, указать её составные части.
123. Строение коллоидной частицы AgBr, полученной при избытке KBr. Формула мицеллы.
124. Строение коллоидной частицы AgI, полученной при избытке NaI. . Формула мицеллы.
125. Строение мицеллы АgCl полученной при избытке Аg2CО3. Формула мицеллы.
126. Строение мицеллы MgСО3 полученной при избытке MgСI2. Формула мицеллы.
127. Что такое порог коагуляции и ионы коагуляторы. Сформулируйте правило Шульце-Гарди. Какой электролит обладает наибольшим порогом коагуляции по отношению к положительно заряженному золю: а) Na2SO4 б)CaCl2 в)Na2SO4 г)FeCl3
128. Строение коллоидной частицы Mg CO3, полученной при избытке Na2CO3. Формула мицеллы.
129. Строение мицеллы СаСО3 полученной при избытке СаСI2. Формула мицеллы.
130. Что выгоднее применить для коагуляции отрицательно заряженного золя: Ca3(PO4)2 или K2SO4. Ответ объяснить. Ионы –коагуляторы.
131. Строение мицеллы СаСО3 полученной при избытке MgСО3. Формула мицеллы.
132. Что такое порог коагуляции и ионы коагуляторы. Сформулируйте правило Шульце-Гарди. Какой электролит обладает наибольшим порогом коагуляции по отношению к отрицательно заряженному золю: а) Na2SO4 б)KCl в)K2SO4 г)AlCl3
133. Что выгоднее применить для коагуляции положительно заряженного золя: Ca3(PO4)2 или K2SO4. Ответ объяснить. Ионы –коагуляторы. Порог коагуляции.
134. ИЭТ белка=5,0. Какой это белок? Как изменится его заряд при рН = 8,0. Показать на схеме.
135. ИЭТ белка 5,0. Как изменится его заряд при рН 4,5. Показать на схеме.
136. ИЭТ белка 5,0. Как изменится его заряд при рН 4,5. Показать на схеме.
137. ИЭТ белка 7,0. какой это белок? Как изменится его заряд при рН 3,0. Показать на примере. Что такое ИЭС и ИЭТ?
138. ИЭТ белка=8,0. Какой это белок? Как изменится его заряд при рН=12,0. Показать на схеме.
139. ИЭТ белка=8,0. Какой это белок? Как изменится его заряд при рН = 9,0. Показать на схеме.
140. ИЭТ белка=9,0. Какой это белок? Как изменится его заряд при рН=5,0. Показать на схеме.
141. ИЭТ белка=7,0. Какой это белок? Как изменится его заряд при рН=9,0. Показать на схеме.
142. ИЭТ белка=7,0. Какой это белок? Как изменится его заряд при рН=3,0 и 10,0. Показать на схеме.
143. ИЭТ белка = 6,0. Как изменится его заряд при рН = 8,0. Показать на схеме.
144. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-2 моль/л, если рН его изоэлектрической точки равно 6,2. К Какому электроду будет двигаться молекула?
145. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-3 моль/л, если рН его изоэлектрической точки равно 5. К Какому электроду будет двигаться молекула?
146. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 10-10 моль/л, если рН его изоэлектрической точки равно 3,6. К Какому электроду будет двигаться молекула?
147. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 2,35*10-3 моль/л, если рН его изоэлектрической точки равно 8,0. К Какому электроду будет двигаться молекула?
148. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-4 моль/л, если рН его изоэлектрической точки равно 5,8. К Какому электроду будет двигаться молекула?
149. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 4,24*10-2 моль/л, если рН его изоэлектрической точки равно 8,2. К Какому электроду будет двигаться молекула?
150. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 2,23*10-2 моль/л, если рН его изоэлектрической точки равно 5,0. К Какому электроду будет двигаться молекула?
151. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,56*10-2 моль/л, если рН его изоэлектрической точки равно 4,0. К Какому электроду будет двигаться молекула?
152. ИЭТ белка=4,0. Какой это белок? Как изменится его заряд при рН = 2,0. Показать на схеме.
153. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,22*10-5 моль/л, если рН его изоэлектрической точки равно 7,0. К Какому электроду будет двигаться молекула?
154. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,64*10-6 моль/л, если рН его изоэлектрической точки равно 8,0. К Какому электроду будет двигаться молекула?
155. ИЭТ белка=7,0. Какой это белок? Как изменится его заряд при рН = 10,0. Показать на схеме.
156. Как изменится заряд белка-фермента пепсина (ИЭТ=1,0) в кислой среде желудка (рН=2,0). Показать на схеме.
157. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 1,56*10-4 моль/л, если рН его изоэлектрической точки равно 5,0. К Какому электроду будет двигаться молекула?
158. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 3,26*10-5 моль/л, если рН его изоэлектрической точки равно 2,0. К Какому электроду будет двигаться молекула?
159. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,43*10-4 моль/л, если рН его изоэлектрической точки равно 9,0. К Какому электроду будет двигаться молекула?
160. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 3,66*10-2 моль/л, если рН его изоэлектрической точки равно 8,0. К Какому электроду будет двигаться молекула?
161. ИЭТ белка=10,0. Какой это белок? Как изменится его заряд при рН = 5,0. Показать на схеме.
162. ИЭТ белка=5,8. Какой это белок? Как изменится его заряд при рН = 2,0. Показать на схеме.
163. ИЭТ белка равно 4. Какой это белок? Как он будет заряжен, если поместить его в раствор, у которого [Н+] = 3,16 *10-2 моль/л, к какому электроду будет двигаться макромолекула при электрофорезе?
164. Определите знак заряда макромолекулы белка в растворе с рН=8, если рН его изоэлектрической точки равно 3,5. К Какому электроду будет двигаться макромолекула белка при электрофорезе (аноду или катоду)?
165. Определите знак заряда макромолекулы белка в растворе с рН=3, если рН его изоэлектрической точки равно 5,5. К Какому электроду будет двигаться макромолекула белка при электрофорезе (аноду или катоду)?
166. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-5 моль/л, если рН его изоэлектрической точки равно 4,2. К Какому электроду будет двигаться молекула?
Приложение А
Таблица 1 – Номера вопросов для контрольной работы
| Цифра шифра | Последняя цифра | ||||||||||
| Предпоследняя цифра | |||||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| 0 | 1,34, 67,100,134 | 2,35, 68,101,135 | 3,36, 69,102,136 | 4,37, 70,103,137 | 5,38, 71,104,138 | 6,39, 72,105,139 | 7,40, 73,106,140 | 8,41, 74,107, 141 | 9,42, 75,108, 142 | 10,43, 76,109,143 | |
| 1 | 11,44, 77,110,144 | 12,45, 78,102,145 | 13,46, 79,103,146 | 14,47, 80,104,147 | 15,48, 81,105,148 | 16,49, 82,106,149 | 17,50, 83,107,150 | 18,51, 84,108, 151 | 19,52, 85,109, 152 | 20,53, 86,110,153 | |
| 2 | 21,54, 87,111,154 | 23,55, 88,112,155 | 24,56, 89,113,156 | 25,57, 90,114,157 | 26,58, 91,115,158 | 27,59, 92,116,159 | 28,60, 93,117,160 | 29,61, 94,118, 161 | 30,62, 95,119, 162 | 31,63, 96,120,163 | |
| 3 | 32,64, 97,121,164 | 33,65, 98,122,165 | 1,66, 99,123,166 | 2,34, 67,124, 134 | 3,35, 68,125,135 | 4,36, 69,126, 136 | 5,37, 70,127,137 | 6,38, 71,128,138 | 7,39, 72,129, 139 | 8,40, 73,130,140 | |
| 4 | 9,41, 74,131,141 | 10,42, 75,132,142 | 11,43, 76,100,143 | 12,44, 77,101,144 | 13,45, 78,102,145 | 14,46, 79,103,146 | 15,47, 80,104,147 | 16,48, 81,105,148 | 17,49, 82,106,149 | 18,50, 83,107,150 | |
| 5 | 19,51, 84,108,151 | 20,52, 85,109,152 | 21,53, 86,110,153 | 22,54, 87,111,154 | 23,55, 88,112,155 | 24,56, 89,113,156 | 25,57, 90,114,157 | 26,58, 91,115,158 | 27,59, 92,116,159 | 28,60, 93,117,160 | |
| 6 | 29,61, 94,118, 161 | 30,62, 95,119,162 | 31,63, 96,120,163 | 32,64, 97,121,164 | 33,65, 98,122,165 | 1,66, 99,123,166 | 2,34, 67,124,134 | 3,35, 68,125,135 | 4,36, 69,126,136 | 5,37, 70,127,137 | |
| 7 | 6,38, 71,128, 138 | 7,39, 72,129,139 | 8,40, 73,130,140 | 9,41, 74,131,141 | 10,42, 75,132,142 | 11,43, 76,100,143 | 12,44, 77,101,144 | 13,45,78,102, 145 | 14,46, 79,103,146 | 15,47, 80,104,147 | |
| 8 | 16,48, 81,105, 148 | 17,49, 82,106,149 | 18,50, 83,107,150 | 19,51, 84,108,151 | 20,52, 85,109,152 | 21,53, 86,110,153 | 22,54, 87,111,154 | 23,55, 88,112,155 | 24,56, 89,113,156 | 25,57, 90,114,157 | |
| 9 | 26,58, 91,115,158 | 27,59, 92,116,159 | 28,60, 93,117,160 | 29,61, 94,118,161 | 30,62, 95,119,162 | 31,63, 96,120,163 | 32,64, 97,121,164 | 1,65, 98,122,165 | 2,66, 99,123,166 | 3,34, 67,124,167 | |
Приложение Б
Министерство сельского хозяйства Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Вятская государственная сельскохозяйственная академия»
Биологический факультет
Дата: 2019-03-05, просмотров: 539.