Количественный состав растворов принято выражать через молярную и моляльную концентрацию.
1. Массовая доля - ω ( В ) - отношение массы растворенного вещества к общей массе раствора, выраженное в долях единицы или процентах.
 ω(В) =
ω(В) = 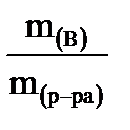 , (1)
, (1)
где ω(В) – массовая доля вещества;
m(В) – масса растворенного вещества, г;
m(р-ра) – масса раствора, г.
ω(В) = 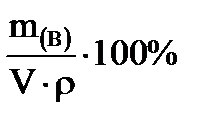 (2)
(2)
m (в)= 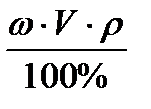 , (3)
, (3)
где m(в) - масса растворенного вещества, г;
V - объем раствора, мл;
ρ – плотность раствора, г/мл.
Массовая доля вещества, выраженная в процентах (процентная концентрация), показывает число единиц массы вещества (г), содержащееся в 100 единицах массы раствора (г).
Например: 5% - ный раствор содержит 5 г растворенного вещества в 100 г раствора.
2. Молярная концентрация - Св - отношение количества растворенного вещества к объему раствора.
Показывает число молей растворенного вещества в 1 л раствора.
Единицы измерения: моль/л.
Св= 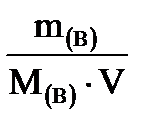 =
= 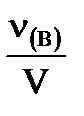 , (4)
, (4)
где Св – молярная концентрация вещества, моль/л;
m(в) – масса растворенного вещества, г;
М(в) – молярная масса растворенного вещества, г/моль;
V – объем раствора, л;
ν(В) – количество растворенного вещества, моль.
Раствор, 1 л которого содержит 1 моль растворенного вещества, называют молярным (М).
Растворы, 1 л которых содержит 0,1; 0,01; 0,001 моль растворенного вещества, соответственно называют децимолярными (0,1 М); сантимолярными (0,01 М) и миллимолярными (0,001 М).
Примечание: вместо обозначения молярной концентрации моль/л допускается обозначение буквой М.
3. Моляльная концентрация (моляльность) - С m - отношение количества растворенного вещества (моль) к массе растворителя (кг).
Единицы измерения: моль/кг.
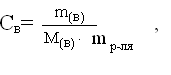 (5)
(5)
где С 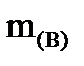 – моляльная концентрация раствора, моль/кг;
– моляльная концентрация раствора, моль/кг;
m(в) – масса растворенного вещества, г;
М(в) – молярная масса растворенного вещества, г/моль.
mр-ля – масса растворителя, кг.
4. Нормальная концентрация - Сн - отношение количества вещества эквивалента, содержащегося в растворе, к объему раствора.
Единицы измерения: моль/л.
С н= 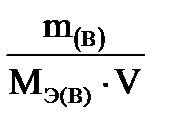 , (6)
, (6)
где Сн – нормальная концентрация вещества, моль/л;
m(в) – масса растворенного вещества, г;
Мэ(в) – молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Мэ(в)= М(в) ∙ f экв , (7)
где М(в) – молярная масса вещества (г/моль);
f экв – фактор эквивалентности.
Фактор эквивалентности ( f экв ) - показатель, отражающий долю реальной частицы вещества, эквивалентной одному атому водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
fэкв=1/Z, (8)
где Z – число эквивалентности.
Для кислот и оснований число эквивалентности Z равно их основности (числу ионов водорода или гидроксила в молекуле).
Для солей число эквивалентности Z находят умножением заряда аниона на количество анионов в молекуле.
Например, Z HCL =1; Z Ca(OH)2 =2; Z Na3PO4 =3.
Раствор, 1 л которого содержит 1 моль эквивалента растворенного вещества, называют нормальным (Н).
Растворы, 1 л которых содержит 0,1; 0,01; 0,001 моль эквивалента растворенного вещества, соответственно называют децинормальными (0,1 Н); сантинормальными (0,01 Н) и миллинормальными (0,001 Н).
Примечание: вместо обозначения нормальной концентрации моль/л допускается обозначение буквой Н.
Осмотическое давление (Росм) – сила, обусловливающая осмос, отнесенная к единице поверхности полупроницаемой мембраны. Оно равно давлению, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделённым от раствора полупроницаемой мембраной.
Осмотическое давление крови равно 7,6 атм.
Согласно закону Вант-Гоффа:
Р осм=Св∙R∙T, (9)
где Р осм – осмотическое давление, Па или атм;
Перевод Па в атмосферы: 1 атм=101325 Па=0,101 МПа.
Св– молярная концентрация вещества, моль/л.
В разбавленных растворах моляльная концентрация (Сm) незначительно отличается от молярной, поэтому можно принять Cв = Сm.
R – универсальная газовая постоянная.
· Если давление рассчитывается в атмосферах (атм), то
R = 0,082 л ∙ R атм/моль ∙ К.
· Если давление рассчитывается в Паскалях (Па), то
R = 8,31∙103 Дж/моль К.
Т – температура по шкале абсолютных температур Кельвина, 0К.
T=t0С+273, (10)
Для электролитов (солей, кислот, оснований) в уравнение Вант-Гоффа введен изотонический коэффициент (i):
Р осм= i ∙Св∙R∙T (11)
ί = 1 + α(υ - 1), (12)
где α – степень диссоциации электролита;
υ – число ионов, на которые диссоциирует молекула.
Практически изотонический коэффициент (i) равен числу ионов (υ) в молекуле полностью диссоциирующих сильных электролитов.
Например, при диссоциации соляной кислоты (НСl) образуется 2 иона, то есть i= υ =2.
Изотонический коэффициент показывает, во сколько раз увеличивается число частиц растворенного вещества в результате диссоциации молекул электролита на ионы и зависит от степени диссоциации электролита и количества ионов, образующихся при диссоциации одной молекулы.
ПРИМЕРЫ решения задач
ЗАДАЧА №1
Рассчитать осмотическое давление 10 % - ного раствора поваренной соли при температуре 20о С и плотностью раствора 1 г/мл. Степень диссоциации α = 1.
РЕШЕНИЕ
1. Р осм= i ∙Св∙R∙T - уравнение Вант-Гоффа для электролитов
2. ί = 1 + α (υ - 1) = 1+1 (2-1) = 2
3. Св= 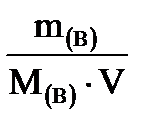
4. m (в)= 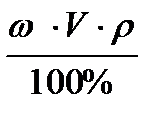 = 10 ∙ 1000 ∙ 1 / 100% = 100 г
= 10 ∙ 1000 ∙ 1 / 100% = 100 г
5. Св=100г / (58,5 г/моль ∙ 1 л) = 1,7 моль/л
6. R = 0,082 л ∙ R атм/моль ∙ К
7. T=t0С+273=20 + 273 = 2930 К
8. Р осм= 2 ∙ 1,7 ∙ 0,082 ∙ 293 = 82,1 атм.
ЗАДАЧА №2
Дата: 2019-03-05, просмотров: 418.