5 % - ного раствора Ca С L 2 . Плотность раствора – 1,05 г/мл.
РЕШЕНИЕ
I. Рассчитаем молярную концентрацию:
1. Св= 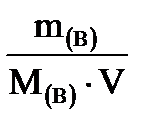
2. m (в)= 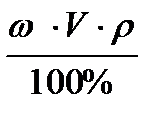 = (5 ∙ 1000 ∙ 1,05) / 100% = 52,5 г
= (5 ∙ 1000 ∙ 1,05) / 100% = 52,5 г
3. Св = 52,5 г / (111 г/моль ∙ 1 л) = 0,47 моль/л
II. Рассчитаем нормальную концентрацию:
1. С н= 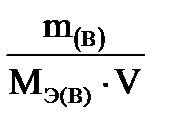
2. Мэ(в)= М(в) ∙ f экв
3. Мэ(в) = 111 г/ моль ∙ 1/2 = 55,5 г/ моль
4. С н= 52,5 г / (55,5 г/моль ∙ 1 л) = 0,95 моль/л
III. Рассчитаем моляльную концентрацию:
1. Сm= 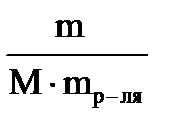
2. mв = 5 г, mр-ля = 95 г = 0,095 кг
3. Сm = 5 г / (111 г/моль ∙ 0,095 кг) = 0,47 моль/кг
Температура замерзания и кипения
Разбавленных растворов
∆tз = Сm ∙ K, (13)
где Сm – моляльная концентрация раствора, моль/кг;
В разбавленных растворах моляльная концентрация (Сm) незначительно отличается от молярной, поэтому можно принять Cв = Сm.
K – криоскопическая постоянная – численно равна понижению температуры замерзания 1 М раствора. Для воды K - 1,86 град/моль; уксусной кислоты - 3,90 град/моль; бензола – 5,12 град/моль; камфоры – 40,0 град/моль.
Для электролитов (солей, кислот, оснований) в формулу вводится изотонический коэффициент (i):
∆tз = ί ∙ Сm ∙ K, (14)
где Сm – моляльная концентрация раствора, моль/кг;
K –криоскопическая постоянная;
ί – изотонический коэффициент.
∆tз = tзам. р-ля - tзам. р-ра, (15)
tзам. р-ра= tзам. р-ля –∆tз, (16)
где ∆tз – депрессия раствора - понижение температуры замерзания раствора по сравнению с чистым растворителем;
tзам. р-ля – температура замерзания растворителя;
Для водных растворов растворителем является вода: tзам. воды=0 0С.
tзам. р-ра – температура замерзания раствора.
Депрессия крови в норме составляет 0,56 - 0,580.
∆tк = tкип. р-ра - tкип. р-ля, отсюда (17)
tкип. р-ра = tкип. р-ля + ∆tк , (18)
где ∆tк – депрессия – повышение температуры кипения раствора по сравнению с чистым растворителем;
tкип. р-ля – температура кипения растворителя; tкип. воды=1000С.
tкип. р-ра– температура кипения раствора.
∆tк = Сm ∙ Е, (19)
где Сm – моляльная концентрация раствора, моль/кг;
Е – эбулиоскопическая постоянная – численно равна повышению температуры кипения 1 М раствора. Для воды Е – 0,516 град/моль; уксусной кислоты - 3,10 град/моль; бензола – 2,57 град/моль; этилового спирта – 1,06 град/моль.
Для электролитов (солей, кислот, оснований):
∆tк= ί ∙Сm ∙Kкип, (20)
где Сm – моляльная концентрация раствора, моль/кг;
Kкип –эбуллиоскопическая постоянная.
ί – изотонический коэффициент.
ПРИМЕРЫ решения ЗАДАЧ
ЗАДАЧА №1
Рассчитать температуру замерзания 5 М раствора глицерина.
РЕШЕНИЕ
1. tзам. р-ра= tзам. р-ля –∆tз
2. tзам. р-ля = 0 0 С
3. ∆tз = Сm ∙ K = 5 ∙ 1,86 = 9,3 0
4. tзам. р-ра= 0–9,3 = -9,3 0 С
ЗАДАЧА №2
Рассчитать температуру замерзания и кипения 15 % - ного раствора мочевины.
РЕШЕНИЕ
I. Рассчитаем температуру замерзания раствора:
1. tзам. р-ра= tзам. р-ля –∆tз
2. ∆tз = Сm ∙ K
3. Сm= 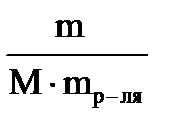
4. mв = 15 г, mр-ля = 85 г = 0,085 кг
5. Сm = 15 г / (60 г/моль ∙ 0,085 кг) = 2,94 моль/кг
6. ∆tз = Сm ∙ K = 2,94 ∙ 1,86 = 5,5 0
7. tзам. р-ра=0 –5,5 = -5,5 0 С
II. Рассчитаем температуру кипения раствора:
1. tкип. р-ра = tкип. р-ля + ∆tк
2. ∆tк = Сm ∙ Е = 2,94 ∙0,513 = 1,5 0
3. tкип. р-ра =100 +1,5 = 101,5 0 С
ПРИЛОЖЕНИЕ Д
Расчётный метод определения рН водных растворов
Ионное произведение воды:
[Н+] ∙ [ОН-] = 10-14 , (21)
где [Н+] - концентрация водородных ионов;
[ОН-] - концентрация гидроксид-ионов в растворе.
рН = - lg [Н+], отсюда [Н+]= 10-рН (22)
рОН = - lg [ОН-], следовательно [ОН-]= 10-рОН (23)
Логарифмическая форма ионного произведения воды:
pН + рОН = 14, (24)
где рН – показатель активной реакции среды – кислотности среды;
рОН – показатель активной реакции среды – щелочности среды.
Десятичный логарифм ( lg ) – это показатель степени, в которую нужно возвести 10, чтобы получилось это число.
Например: lg 100= lg102=2;
lg 1= lg100=0;
lg 0,1= lg10-1=-1.
Если число, логарифм которого необходимо найти, не целое число, то используют таблицы логарифмов Брадиса (смотри приложение Е) или инженерный калькулятор.
Дата: 2019-03-05, просмотров: 431.