Ионов водорода и гидроксила в растворах кислот и
Оснований
| Электролит | [H+] | [OH-] |
| Вода |
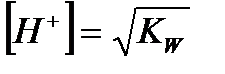
|
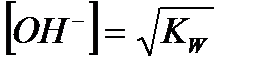
|
| Сильная кислота |
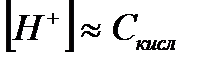
| 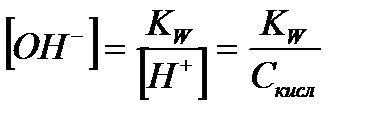
|
| Сильное основание | 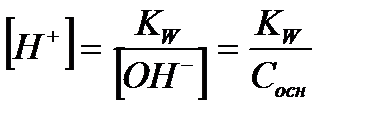
| 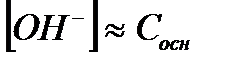
|
| Слабая кислота | 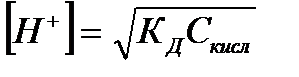
| 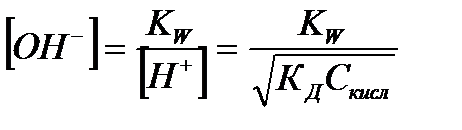
|
| Слабое основание | 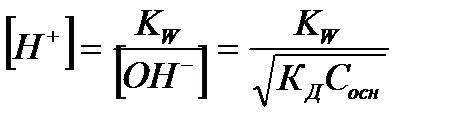
| 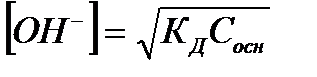
|
примеры решения ЗАДАЧ
ЗАДАЧА №1
[Н+] = 5,29 ∙10-6 моль/л. Определить рН и рОН этого раствора.
РЕШЕНИЕ
рН = -lg [Н+]= - lg 5,29 ∙10-6
Логарифм произведения равен сумме логарифмов множителей, поэтому pН = - (lg 5,29 + lg10-6).
lg 10-6= -6.
lg 5,29 находим по таблице логарифмов Брадиса следующим образом:
1. В первом вертикальном столбце найдем число 52 и в верхней горизонтальной строчке - 9.
На пересечении колонок, в которых записаны указанные числа, находим мантиссу (дробная часть логарифма) - 7235.
2. Перед мантиссой ставим запятую, а перед запятой в характеристику (целая часть логарифма) ставим столько единиц, сколько цифр в целой части логарифмируемого числа без одной.
В нашем примере целая часть числа (5,29) изображена одной цифрой (5), поэтому характеристика будет 1-1 = 0, значит
lg 5,29 = 0,7235
рН = -(0,7235 - 6) = 5,2765 ≈ 5,28
рОН =14 - 5,28 ≈ 8,72
ЗАДАЧА №2
рН раствора равна 3,2. Найти [Н+]этого раствора.
РЕШЕНИЕ
Данный тип задач сводится к нахождению числа по логарифму:
[Н+]= 10-рН = 10-3,2
1. Показатель степени (-3,2) - это логарифм;
-3 – его целая часть (характеристика);
-0,2 – дробная часть логарифма (мантисса).
Характеристика может быть отрицательной, а мантисса только положительной. Поэтому сделаем мантиссу положительной, прибавив к ней 1, и вычтем 1 из характеристики, чтобы в целом показатель степени не изменился.
-1 +1
[Н+]= 10-3, 2 = 10-4 + 0,8 = 10-4 · 100,8
Примечание: показатели степеней складываются при умножении одинаковых оснований.
2. «-4» - это логарифм числа 10-4.
3. В таблице Брадиса находим число, соответствующее мантиссе 8000 (0,8 и 0,8000 одно и то же число) - 631.
В целую часть числа выделяем число цифр, на единицу большее характеристики, поэтому выделяем 1 цифру.
Получится число 6,31.
4. Окончательный результат:
[Н+]= 6,31· 10-4 моль/л
Расчётный метод определения рН буферных растворов
1. Концентрация водородных ионов в кислотной буферной системе прямо пропорциональна константе диссоциации кислоты (Кд к-ты), концентрации (Ск) и объёму (Vк) кислоты и обратно пропорциональна концентрации (Сс) и объёму соли (Vс), взятых для приготовления буферной системы:
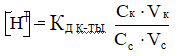
(25)
2. Концентрация гидроксильных ионов в основной буферной системе прямо пропорциональна константе диссоциации основания (Кд осн), концентрации (Сосн) и объёму (Vосн) основания и обратно пропорциональна концентрации (Сс) и объёму (Vс) соли, взятых для приготовления буферного раствора:
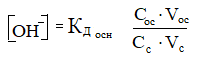 (26)
(26)
примеры РЕШЕНИЯ ЗАДАЧ
ЗАДАЧА №1
Определить рН буферной смеси, состоящей из 10 мл 0,1Н раствора CH 3 COOH и 5 мл 0,1Н раствора CH3COONa. Кк-ты = 1,85·10-5
Решение
Дана кислотная буферная система.
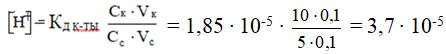 моль/л
моль/л
рН = - lg [Н+] = - (lg 3,7 + lg 10-5) = - (0,5682 - 5) = 4,4318 ≈ 4,43
ЗАДАЧА № 2
Вычислить рН буферной смеси, содержащей 15 мл NH4Cl и 20 мл NH4OH одинаковой концентрации. КNH 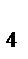 OH = 1,8 10-5
OH = 1,8 10-5
Решение
Дана основная буферная система. При одинаковых исходных концентрациях компонентов буферной системы учитываются только их объемы.
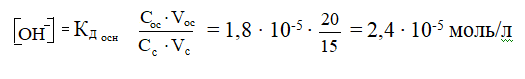
рОН = - lg[ОН-] = - lg 2,4∙ 10-5 = - (lg 2,4 + lg ∙ 10-5) = - (0,3802 - 5) = 4,62
рН = 14 - рОН = 14 - 4,62 = 9,38
ЗАДАЧА № 3
Сколько мл 0,1Н раствора СН3СООН надо прилить к 10 мл 0,1Н раствора СН3СОО Na , чтобы получить буферную систему с рН = 5,4?
Кк-ты = 1,85 ∙ 10-5
Решение
По данному значению рН найдем [Н+]:
[Н+]= 10-рН = 10-5,4 = 100,6 · 10-6 = 3,98 ∙ 10-6 моль/л
Определим необходимый объем кислоты:
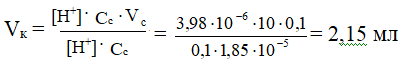
ЗАДАЧА № 4
В каком соотношении надо смешать растворы масляной кислоты и маслянокислого натрия одинаковой концентрации, чтобы получить буфер с рН = 5? Кмасляной к-ты= 1,48 ·10-5
РЕШЕНИЕ
Дана кислотная буферная система.
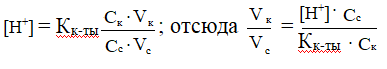 ,
,
поскольку Сс = Ск,
то 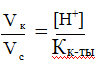
Величину [Н+]находим по данному рН: [Н+]= 10-5 моль/л,
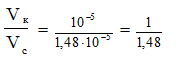
Приложение Ж
СТРОЕНИЕ КОЛЛОИДНОЙ ЧАСТИЦЫ
Золь называется по названию труднорастворимого соединения. Растворимость солей отображена в приложении З.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Для того чтобы правильно записать формулу мицеллы золя, необходимо знать:
· по какой реакции получено труднорастворимое соединение,
· какой реактив был при этом в избытке.
1. Процесс образования гидрозоля (дисперсионная среда – вода) хлорида серебра, полученного в ходе химической реакции:
AgNO 3 (изб) + NaCl → AgCl (золь) + NaNO 3
Гидрозоль образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке.
Примечание: если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится.
При постепенном введении раствора NaCl в раствор AgNO3 в системе в первый момент образуются кристаллические агрегаты (AgCl)m, состоящие из ионов Ag+ и С1- - ядро мицеллы (агрегат). Ядро состоит из ионов, входящих в состав самого золя.
На кристаллических агрегатах происходит адсорбция ионов с образованием двойного ионного слоя.
Ядро (AgCl)m адсорбирует на своей поверхности те ионы, которые отвечают двум требованиям:
· составляют кристаллическую решетку золя;
· находятся в растворе в избытке.
Эти ионы формируют потенциалопределяющий слой (адсорбционный слой родственных ионов).
Этим условиям отвечают ионы серебра. В результате адсорбции ионов Ag+ кристаллические агрегаты хлорида серебра приобретают положительный заряд.
Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристаллов AgCl. Таким образом, агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Ядро с потенциалопределяющими ионами имеет положительный заряд и притягивает ионы противоположного заряда – противоионы.
Эти ионы формируют два слоя:
· адсорбционный (плотный) слой противоионов;
· диффузный (рыхлый) слой противоионов.
Этим условиям отвечают нитрат-ионы NO3–.
Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
Диффузный слой формируют те же противоионы, причём концентрация противоионов диффузного слоя постепенно понижается по мере удаления от ядра.
Между противоионами адсорбционного и диффузионного слоев устанавливается подвижное равновесие.
Противоионы диффузного слоя ориентируют полярные молекулы растворителя, создавая дополнительную сольватную оболочку.
Ядро вместе с ионами адсорбционного слоя составляет коллоидную частицу или гранулу. Гранула всегда заряжена, знак заряда соответствует знаку заряда потенциалопределяющих ионов.
Гранула совместно с противоионами диффузного слоя называется мицелла. Мицелла всегда электронейтральна.
Ионы диффузного слоя под действием электрического поля способны отрываться от мицеллы, и гранула будет двигаться к противоположно заряженному электроду.
Строение мицеллы гидрозоля хлорида серебра представлено на рисунке.
| NO3– NO3– NO3– NO3– |
| NO3– NO3– NO3– NO3 |
| Ag+ Ag+ Ag+ Ag Ag+ Ag+ Ag+ |
| Ag+ Cl– Cl–Ag+ Ag+ Cl– |
1 2 3 4
1 – ядро;
2 – потенциалопределяющие ионы; адсорбционный слой
3 – противоионы адсорбционного слоя
4 – противоионы диффузного слоя
1,2,3 – коллоидная частица (гранула)
1,2,3,4 – мицелла
Формула мицеллы
ядро
{(AgCl)m , nAg+, (n – х) NO3–}  NO3–
NO3–
гранула
Обозначения:
m – условное число молекул в агрегате труднорастворимого соединения;
n – условное число адсорбированных ионов;
(n-x) – условное число противоионов адсорбционного слоя;
x – условное число противоионов диффузного слоя.
2. Процесс образования гидрозоля хлорида серебра, полученного в ходе химической реакции:
AgNO 3 + NaCl (изб) → AgCl (золь) + NaNO 3
Если приливать раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности ядра (AgCl)m будут адсорбироваться хлорид-ионы (Cl-), имеющиеся в избытке в растворе, а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия (Na+).
NO3– NO3–
Na+– Na+
Na+ Na+
Na+ Na+
CL- CL-
СL- Ag CL-
CL- CL-
Ag+ Cl– Cl–Ag+
Ag+ Cl–
1 2 3 4
1 – ядро;
2 – потенциалопределяющие ионы; адсорбционный слой
3 – противоионы адсорбционного слоя
4 – противоионы диффузного слоя
1,2,3 – коллоидная частица (гранула)
1,2,3,4 – мицелла
Формула мицеллы
ядро
{(AgCl)m, nCl–, (n – x)Na+} 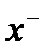 Na+
Na+
гранула
Знак заряда коллоидной частицы определяется зарядом потенциалопределяющих ионов, адсорбированных ядром. На границе раздела твердое тело (ядро) – раствор возникает двойной электрический слой.
Дзета – потенциал (электрокинетический потенциал) – разность потенциалов между диффузной и адсорбционной частями двойного электрического слоя.
Если каким-либо путем заряд коллоидных частиц уменьшить или полностью нейтрализовать, то диффузный слой разрушается, тогда частицы получают возможность слипания и укрупнения, что приводит к понижению агрегативной устойчивости коллоидной системы, т.е. коагуляции.
ПРИЛОЖЕНИЕ З
Дата: 2019-03-05, просмотров: 378.