Л.В. Пилип
Химия физическая и коллоидная
Учебно-методическое пособие
для самостоятельной и контрольной работ обучающихся
заочной и очно-заочной форм обучения
по направлению подготовки 06.03.01 Биология
Киров 2018
ПОДГОТОВКА К ЗАЧЁТУ
УКАЗАНИЯ К ПОДГОТОВКЕ К ЗАЧЁТУ
Процедура оценивания знаний, умений и навыков при проведении промежуточной аттестации по дисциплине «Химия физическая и коллоидная» проводится в форме зачета.
Порядок организации и проведения промежуточной аттестации обучающегося, форма проведения, процедура сдачи зачета, сроки и иные вопросы определены «Положением о порядке организации и проведения текущего контроля успеваемости и промежуточной аттестации обучающихся».
Процедура оценивания знаний, умений и навыков при проведении зачета по дисциплине «Химия физическая и коллоидная» проводится путем собеседования с обучающимся. При сдаче зачёта соблюдаются следующие правила:
· обучающиеся, имеющие задолженность по текущему контролю успеваемости, получают зачёт только после ликвидации задолженности;
· обучающемуся выдаются два вопроса по дисциплине с учетом определенного уровня сложности (низкого, базового или продвинутого);
· в определенное время (в среднем 10-15 минут на вопрос) обучающийся составляет план ответа, который излагает преподавателю;
· по результатам собеседования выставляется оценка согласно установленной шкале оценивания (зачтено/незачтено).
Для зачёта необходима зачтённая контрольная работа, сданная на кафедру в печатном и электронном виде.
Задание для подготовки к сдаче зачета
1.Осмос – это:
а) односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией;
б) диффузия молекул растворителя через полупроницаемую мембрану под действием внешнего давления;
в) самопроизвольная диффузия молекул растворённых веществ через полупроницаемую мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией;
г) Односторонняя диффузия молекул растворителя и растворённых веществ через полупроницаемую мембрану с целью выравнивания концентраций.
2. Имеется 4 раствора, содержащие в 5 л 1 моль сахарозы (первый); 3 моль глюкозы (второй); 1,5 моль мочевины (третий) и 0,5 моль глицерина (четвёртый). В каком растворе больше осмотическое давление?
а) в первом;
б) во втором;
в) в третьем;
г) в четвёртом.
3. Частицы коллоидного раствора гидроксида железа имеют положительный заряд. Какие вещества следует применить для коагуляции данного раствора?
а) этиловый спирт;
б) глицерин;
в) AlCl3.
4. Коллоидная химия изучает:
а) гетерогенные дисперсные системы;
б) гомогенные дисперсные системы;
в) однофазные и многофазные системы;
г) однокомпонентные и многокомпонентные системы.
5. Коллоидные частицы имеют диаметр (см):
а) 10 –7 – 10 –5;
б) 10 –7 – 10 –9;
в) 10 –9 – 10 –10;
г) 10 –5 – 10 –7.
6. Коллоидные растворы способны:
а) опалесцировать;
б) отражать и преломлять свет;
в) поглощать и отражать свет;
г) пропускать и поглощать свет.
7. Коллоидная частица…
а) имеет только положительный заряд;
б) имеет только отрицательный заряд;
в) может иметь как положительный, так и отрицательный заряд;
г) не имеет заряда.
8. Коллоидная частица входит в состав:
а) мицеллы;
б) гранулы;
в) агрегата;
г) ассоциата.
9. Коагуляция частиц – это:
а) слипание, укрупнение;
б) разукрупнение, расщепление;
в) удерживание частиц в объёме жидкости.
10. Коллоидная защита – это:
а) повышение устойчивости растворов высокомолекулярных соединений при добавлении коллоидных растворов;
б) повышение устойчивости коллоидных растворов при добавлении высокомолекулярных соединений;
в) понижение дисперсности коллоидного раствора при добавлении коагулянтов;
г) повышение дисперсности коллоидного раствора при добавлении пептизаторов.
11.Какие системы относятся к эмульсиям?
а) жидкость – газ;
б) жидкость – твёрдое;
в) жидкость – жидкость;
г) твёрдое – газ.
12. Тиксотропия – это:
а) обратимый переход геля в коллоидный раствор при механическом воздействии;
б) самопроизвольное уменьшение объёма геля;
в) превращение коллоидного раствора в гель;
г) превращение геля в студень.
13. Самопроизвольный процесс разрушения (старения) геля называется:
а) тиксотропия;
б) высаливание;
в) диспергирование;
г) синерезис.
Ответы: 1-а, 2-б, 3-в, 4-а,5-а, 6-а, 7-в,8 –а,9- а,10 –б, 11-в, 12-а, 13-г
КРИТЕРИИ ОЦЕНИВАНИЯ ДКР
Результаты текущего контроля в форме домашней контрольной работы оцениваются посредством интегральной (целостной) двухуровневой шкалы. Оценка «зачтено» ставится, если обучающийся овладел элементами дескрипторов компетенций в рамках определенного уровня, показано владение как теоретическим, так и практическим материалом, проработаны все задания ДКР, могут быть допущены незначительные ошибки, которые могут быть устранены после устного собеседования.
Если обучающийся не овладел элементами дескрипторов компетенций в рамках определенного уровня, обнаружил существенные пробелы в знании теоретического и практического материала, контрольная работа не соответствует варианту, выполнены не все задания (не выполнено более 2 заданий) или в работе содержатся грубейшие ошибки в работе, то обучающийся получает оценку «не зачтено» (см. таблицу 2).
Критерии и шкала оценивания домашней контрольной работы по дисциплине «Химия физическая и коллоидная» представлены в таблице 1.
Таблица 1 – Критерии и шкала и оценивания ответов на вопросы домашней контрольной работы
| Планируемые результаты обучения | Критерии оценивания |
| 1 уровень (низкий) | |
| Знания | Неполное обоснование теоретического вопроса, требующее наводящих вопросов |
| Умения | Поиск необходимой информации с помощью преподавателя |
| Навыки и (или) опыт деятельности | Правильность выполнения практических заданий по аналогии |
| 2 уровень (средний) | |
| Знания | Глубокие знания теоретического материала и умение их применять |
| Умения | Поиск необходимой информации с использованием учебно-методической литературы, возможны единичные ошибки |
| Навыки и (или) опыт деятельности | Правильность выполнения практических заданий |
| 3 уровень (высокий) | |
| Знания | Глубокие знания теоретического материала и умение их применять, комплексная оценка по предложенным вопросам |
| Умения | Последовательный и правильный поиск необходимой информации с использованием учебно-методической литературы, умение обоснованно излагать свои мысли, делать необходимые выводы |
| Навыки и (или) опыт деятельности | Правильность выполнения практических заданий с применением творческих проектных решений |
Результаты текущего контроля в форме домашней контрольной работы оцениваются посредством интегральной (целостной) двухуровневой шкалы, представленной в таблице 2.
Таблица 2 - Шкала и показатели оценивания ответов на вопросы домашней контрольной работы
| Шкала оценивания | Показатели оценивания |
| Зачтено | Обучающийся овладел элементами дескрипторов компетенций в рамках определенного уровня: - знания теоретического материала по дисциплине «Химия физическая и коллоидная» усвоены в полном объеме; - корректно и правильно оформил материал домашней контрольной работы; - давал верные ответы на уточняющие дополнительные вопросы преподавателя. |
| Не зачтено | Обучающийся не овладел элементами дескрипторов компетенций в рамках определенного уровня: - обнаружил существенные пробелы в знании теоретического материала по дисциплине «Химия физическая и коллоидная»; - представил домашнюю контрольную работу, не удовлетворяющую требованиям к ее выполнению; - не представил домашнюю контрольную работу для защиты в указанные сроки; - не отвечал на уточняющие дополнительные вопросы преподавателя. |
К сдаче промежуточного контроля в форме зачёта допускаются только студенты, имеющие зачтенную контрольную работу.
Вопросы для написания домашней контрольной работы
1. История развития физколлоидной химии.
2. Агрегатные состояния вещества.
3. Первое начало термодинамики, его значение в природе.
4. Второе начало термодинамики. Энтропия.
5. Третий закон термодинамики. Уравнение Нернста. Постулат Планка.
6. Электрическая проводимость растворов, её практическое применение.
7. Удельная и эквивалентная электрическая проводимость растворов.
8. Химическая кинетика. Основные положения и понятия. Классификация химических реакций.
9. Катализ. Виды. Значение.
10. Ферменты как катализаторы. Влияние условий на активность ферментов. Практическое применение ферментов.
11. Фотохимические реакции. Фотосинтез. Значение.
12. Электроды. Классификация.
13. Гальванические элементы. Аккумуляторы. Топливные элементы. Применение.
14. Химическое равновесие. Влияние внешних условий. Закон действующих масс.
15. Эмульсии. Характеристика. Классификация. Применение.
16. Пены. Характеристика. Применение. Пенообразователи и пеногасители.
17. Аэрозоли. Характеристика. Свойства. Получение и разрушение аэрозолей. Значение.
18. Суспензии. Характеристика. Свойства. Получение и разрушение аэрозолей. Значение.
19. Теория растворов. Классификация растворов.
20. Свойства растворов: диффузия, осмос (экзосмос и эндоосмос), полупронициаемые мембраны.
21. Биологическое значение осмотического давления. Тургор и плазмолиз, значение; гемолиз, виды гемолиза.
22. Осмотическое давление. Закон Вант-Гоффа. Уравнение Вант- Гоффа для электролитов и для неэлектролитов. Изотонический коэффициент.
23. Изотонический, гипертонический, гипотонический, физиологический раствор, области их применения.
24. Температура замерзания и кипения растворов электролитов и неэлектролитов. Первый и второй законы Рауля. Депрессия раствора. Области применения данных законов.
25. Диссоциация. Моляризация. Электролиты (сильные, средней силы, слабые). Закон разбавления Оствальда.
26. Теория электролитической диссоциации Аррениуса. Постулаты. Константа диссоциации. Степень диссоциации. От каких факторов зависит данная величина.
27. Ионное произведение воды. Логарифмическая форма ионного произведения воды. Активная реакция среды. Показатели активной реакции среды.
28. Пределы изменений и измерений рН. Кислотность (общая, активная, потенциальная). Виды кислотности.
29. Методы определения рН (колориметрический и потенциометрический). Биологическое значение рН.
30. Теория сильных электролитов Дебая-Хюккеля. Концентрация растворов сильных электролитов. Активность электролита. Ионная сила раствора.
31. Буферные системы. Виды буферных систем. Буферные растворы. Буферные системы крови. Значение.
32. Механизм действия буферных систем. Показать на конкретном примере. Буферная ёмкость. Расчёт буферной ёмкости. Буферное действие.
33. Биологическое значение буферных растворов. Алкалоз. Ацидоз.
34. Дисперсные системы. Дисперсная фаза и дисперсная среда.Признаки дисперсной среды: гетерогенность, дисперсность, межфазная поверхность
35. Классификация дисперсных систем по степени дисперсности и по интенсивности взаимодействия дисперсной среды и дисперсной фазы.
36. Классификация дисперсных систем по агрегатному состоянию дисперсной среды и дисперсной фазы, по форме частиц и характеру подвижности дисперсной фазы.
37. Поверхностная энергия. Поверхностное натяжение.
38. Адсорбция. Абсорбция. Сорбция. Адсорбент. Адсорбат.
39. От чего зависит величина адсорбции? Понятие элюции.
40. Виды адсорбции: физическая и химическая.
41. Адсорбция на границе раствор-газ
42. Изотерма адсорбции Гиббса.
43. Понятие о поверностно-активных веществах и поверхностно-инактивных веществах.
44. Правило Траубе-Дюкло.
45. Адсорбция на границе твёрдое тело-раствор
46. Адсорбция на границе твёрдое тело-газ.
47. Теория мономолекулярной адсорбции Лэнгмюра
48. Теория полимолекулярной адсорбции Поляни
49. Хроматография. Сущность, виды.
50. Золи. Размер частиц золя. Характеристика золей.
51. Адсорбция из растворов электролитов: ионнообменная и специфическая. Правило Пескова-Фаянса.
52. Методы получения золей: конденсационный, дисперсионный, пептизация. Виды пептизации. Правило осадка.
53. Методы очистки золей.
54. Оптические свойства золей: полихромия, рассеивание света, опалесценция.
55. Молекулярно-кинетические свойства золей: вязкость, броуновское движение, диффузия, осмос, осмотическое давление.
56. Электрокинетические свойства золей: электрофорез, наличие заряда коллоидных частиц, коагуляция.
57. Коагуляция и седиментация. Сущность. Взаимная коагуляция.
58. Ионы коагуляторы. Порог коагуляции. Правило Шульце-Гарди. Стадии коагуляции.
59. Коагуляция. Автокоагуляция (старение золей).
60. Свойства лиофильных дисперсных систем, отличия от лиофобных дисперсных систем.
61. Гидратная оболочка. Набухание и растворение.
62. Белки. Виды белков. Изменение заряда белка в зависимости от рН среды. Понятие об изоэлектрической точке и изоэлектрическом состоянии.
63. Виды коагуляции белков: высаливание и денатурация. Сущность.
64. Коллоидная защита. Сущность. Зольное число.
65. Гели и студни. Особенности строения. Классификация гелей. Свойства гелей и студней.
66. Солюбилизация. Значение.
67. Спинномозговая жидкость замерзает при температуре -0,4 0 С. Рассчитайте её осмотическое давление при 370 С.
68. Какой раствор замерзает при более низкой температуре: 3 % раствор глюкозы с молекулярной массой 180 г/моль или 3 % раствор мочевины с молекулярной массой 60 г/моль.
69. Рассчитать температуру замерзания и кипения 20 % раствора глицерина с молекулярной массой 92 г/моль.
70. Водный раствор сахарозы замерзает при температуре -0,093 0С. Вычислить моляльную концентрацию раствора?
71. Что произойдет с эритроцитами крови, если в пробу крови попала дистиллированная вода? Что такое изотонический, гипотонический и гипертонический растворы?
72. Определить рН буферного раствора, если он состоит из 5 мл 0,01 Н раствора NH4Cl и 15 мл 0,01 Н раствора NH4ОН. Константа диссоциации основания=1,8 х 10-5.
73. Рассчитать моляльную, нормальную и процентную концентрацию раствора, содержащего 10 г глюкозы в 180 мл воды. Молекулярная масса глюкозы 180 г/моль.
74. Вычислить рОН бикарбонатной буферной системы, состоящей из 5,0 мл 0,1 Н раствора NaHCO3 и 10,0 мл 0,1 Н раствора H2CO3. Константа диссоциации кислоты=3,7 х 10-7.
75. Что такое осмос? Полупроницаемая мембрана? Виды полупроницаемых мембран. Будет ли происходит осмос и в каком направлении, если полупроницаемой мембраной разделить 0,1 М растворы глюкозы и CaCL2? Объяснить почему?
76. рН одного раствора равна 2, рН второго раствора равна 6. Какой раствор кислее другого и во сколько раз? Определить Сн+ растворов.
77. В какой последовательности замерзают 10% растворы сахара (М=342); глюкозы (М=180); этиленгликоля (М=94).
78. Что такое буферная ёмкость? В какой из систем больше кислотная буферная ёмкость (объяснить почему):
10 мл 0,1 НСН3СООН 20 мл 0,1 НСН3СООН
20 мл 0,1 НСН3СООNa 10 мл 0,1 НСН3СООNa
79. Что такое буферная ёмкость? В какой из систем больше кислотная буферная ёмкость (объяснить почему):
5 мл 0,1 Н СН3СООН 20 мл 0,1 Н СН3СООН
20 мл 0,1 Н СН3СООNa 5 мл 0,1 Н СН3СООNa
80. Осмотическое давление. Закон Вант-Гоффа. Будет ли наблюдаться осмос, если полупроницаемой мембраной разделить 0,1 М раствор мочевины и глюкозы;0,1 М и 0,01 М растворы глюкозы?
81. Водный раствор глюкозы имеет осмотическое давление 9 атмосфер при 27 0С. Рассчитать его температуры замерзания и кипения?
82. Являются ли изотоничными 0,2 М растворы мочевины, глюкозы и хлорида натрия. Объяснить почему?
83. Что такое буферная ёмкость? В какой из систем больше щелочная буферная ёмкость (объяснить почему):
5 мл 0,1 НСН3СООН 20 мл 0,1 НСН3СООН
20 мл 0,1 НСН3СООNa 5 мл 0,1 НСН3СООNa
84. Клеточный сок растений имеет осмотическое давление равное 8 атмосферам, почвенный раствор 2,5 атмосферам. В каком направлении происходит движение воды. Ответ обосновать.
85. Вычислить процентную концентрацию водного раствора глицерина (М = 92 г/моль), если он замерзает при - 0,520С.
86. Как приготовить 1 л 2 М раствора мочевины. Что такое молярная, децимолярная, сантимолярная и милимолярная концентрация?
87. Водный раствор сахара, содержащий 0,17 г сахара в 25 мл воды, замерзает при температуре = -0,037 0С. Определить молекулярную массу сахара.
88. Вычислить рОН буферной смеси, состоящей из 8,0 мл 0,1 Н раствора NH4ОH и 2,0 мл 0,1 Н раствора NH4Cl. К диссоциации NH  OH = 1,77∙10-5.
OH = 1,77∙10-5.
89. Вычислить рН фосфатной буферной системы, состоящей из 5 мл Na2НРО4 и 10 мл NaН2РО4 одинаковой концентрации. Константа диссоциации Н2РО4- =1,54 х 10-7.
90. Как объяснить благоприятное действие на гнойную рану повязки, смоченной гипертоническим раствором поваренной соли.
91. Рассчитать осмотическое давление 10 % раствора поваренной соли.
92. Найти рН ацетатной буферной смеси, состоящей из 100 мл 0,1н СН3СООН и 200 мл 0,2н CH3COONa. Кк-ты = 1,75 ∙ 10-5.
93. Найти рОН буфера, состоящего из 25,0 мл 0,01 Н раствора СН3СООН и 10,0 мл 0,01 Н раствора CН3COONa. Кк-ты = 1,85 х 10-5.
94. Рассчитать температуру замерзания и кипения 20% раствора сахара (М=342).
95. При наступлении холодов в клетках растений протекают процессы превращения крахмала в глюкозу. Какова роль этого процесса в повышении холодоустойчивости растений.
96. Даны 0,1 М растворы NaCL и K2SO4. Какой из них обладает большим осмотическим давлением и почему? Будет ли наблюдаться осмос, если эти растворы разделить полупроницаемой мембраной.
97. Найти температуру замерзания крови, если она имеет осмотическое давление равное 7,6 атмосферы при температуре 36 0С.
98. Вычислить рОН буферной смеси, состоящей из 10,0 мл 0,2 Н раствора NH4ОH и 20,0 мл 0,1 Н раствора NH4Cl. КNH  OH = 1,77 х 10-5.
OH = 1,77 х 10-5.
99. При какой температуре замерзает 55% раствор этиленгликоля (антифриз)? М этиленгликоля = 62 г/моль.
100. Что выгоднее применить для коагуляции положительно заряженного золя: Ca3(PO4)2 или K2SO4. Ответ объяснить.
101. Строение коллоидной частицы Строение коллоидной частицы AgCl, полученной при избытке AgNO3. Формула мицеллы.
102. AgCl, полученной при избытке HCl. Формула мицеллы.
103. Строение коллоидной частицы AgI, полученной при избытке HI. Формула мицеллы.
104. Строение коллоидной частицы PbI2, полученной при избытке HI. Формула мицеллы.
105. Строение коллоидной частицы AgI, полученной при избытке AgNO3. Формула мицеллы.
106. Какой из электролитов КСl, CaCl2, AlCl3 будет иметь наименьший порог коагуляции для положительно заряженного золя Na2SO4? Ответ объяснить.
107. Строение коллоидной частицы PbI2, полученной при избытке Pb(NO3)2. Формула мицеллы.
108. Какой из электролитов КСl, CaCl2, AlCl3 будет иметь наименьший порог коагуляции для положительно заряженного золя BaSO4? Ответ объяснить.
109. Напишите формулу мицеллы золя BaSO4, коагуляцию которого вызывают катионы, указать её составные части.
110. Записать формулу мицеллы золя берлинской лазури, полученного при избытке FeCl3, указать её составные части. 4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12KCl
111. Записать формулу мицеллы золя берлинской лазури, полученного при избытке K4[Fe(CN)6], указать её составные части. 4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12KCl
112. Записать формулу мицеллы золя Cu2[Fe(CN)6]3, полученного при избытке K4[Fe(CN)6], указать её составные части. 2CuCl2 + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl
113. Записать формулу мицеллы золя Cu2[Fe(CN)6]3, полученного при избытке CuCl2, указать её составные части. 2CuCl2 + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl
114. Записать формулу мицеллы золя PbCl2, полученного при избытке Pb(NO3)2, указать её составные части.
115. Записать формулу мицеллы золя PbCl2, полученного при избытке HCl, указать её составные части.
116. Записать формулу мицеллы золя PbS, полученного при избытке Pb(NO3)2, указать её составные части.
117. Записать формулу мицеллы золя PbS, полученного при избытке H2S, указать её составные части.
118. Строение мицеллы золя СаСО3 полученной при избытке Н2СО3. Формула мицеллы.
119. Строение коллоидной частицы AgBr, полученной при избытке AgNO3. Формула мицеллы.
120. Строение коллоидной частицы PbI2, полученной при избытке NaI. . Формула мицеллы.
121. Строение мицеллы СаСО3 полученной при избытке СаСI2. Формула мицеллы.
122. Объяснить конденсационный метод очистки коллоидных систем. Записать формулу мицеллы золя Al(OH)3, полученную при избытке NaOH, указать её составные части.
123. Строение коллоидной частицы AgBr, полученной при избытке KBr. Формула мицеллы.
124. Строение коллоидной частицы AgI, полученной при избытке NaI. . Формула мицеллы.
125. Строение мицеллы АgCl полученной при избытке Аg2CО3. Формула мицеллы.
126. Строение мицеллы MgСО3 полученной при избытке MgСI2. Формула мицеллы.
127. Что такое порог коагуляции и ионы коагуляторы. Сформулируйте правило Шульце-Гарди. Какой электролит обладает наибольшим порогом коагуляции по отношению к положительно заряженному золю: а) Na2SO4 б)CaCl2 в)Na2SO4 г)FeCl3
128. Строение коллоидной частицы Mg CO3, полученной при избытке Na2CO3. Формула мицеллы.
129. Строение мицеллы СаСО3 полученной при избытке СаСI2. Формула мицеллы.
130. Что выгоднее применить для коагуляции отрицательно заряженного золя: Ca3(PO4)2 или K2SO4. Ответ объяснить. Ионы –коагуляторы.
131. Строение мицеллы СаСО3 полученной при избытке MgСО3. Формула мицеллы.
132. Что такое порог коагуляции и ионы коагуляторы. Сформулируйте правило Шульце-Гарди. Какой электролит обладает наибольшим порогом коагуляции по отношению к отрицательно заряженному золю: а) Na2SO4 б)KCl в)K2SO4 г)AlCl3
133. Что выгоднее применить для коагуляции положительно заряженного золя: Ca3(PO4)2 или K2SO4. Ответ объяснить. Ионы –коагуляторы. Порог коагуляции.
134. ИЭТ белка=5,0. Какой это белок? Как изменится его заряд при рН = 8,0. Показать на схеме.
135. ИЭТ белка 5,0. Как изменится его заряд при рН 4,5. Показать на схеме.
136. ИЭТ белка 5,0. Как изменится его заряд при рН 4,5. Показать на схеме.
137. ИЭТ белка 7,0. какой это белок? Как изменится его заряд при рН 3,0. Показать на примере. Что такое ИЭС и ИЭТ?
138. ИЭТ белка=8,0. Какой это белок? Как изменится его заряд при рН=12,0. Показать на схеме.
139. ИЭТ белка=8,0. Какой это белок? Как изменится его заряд при рН = 9,0. Показать на схеме.
140. ИЭТ белка=9,0. Какой это белок? Как изменится его заряд при рН=5,0. Показать на схеме.
141. ИЭТ белка=7,0. Какой это белок? Как изменится его заряд при рН=9,0. Показать на схеме.
142. ИЭТ белка=7,0. Какой это белок? Как изменится его заряд при рН=3,0 и 10,0. Показать на схеме.
143. ИЭТ белка = 6,0. Как изменится его заряд при рН = 8,0. Показать на схеме.
144. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-2 моль/л, если рН его изоэлектрической точки равно 6,2. К Какому электроду будет двигаться молекула?
145. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-3 моль/л, если рН его изоэлектрической точки равно 5. К Какому электроду будет двигаться молекула?
146. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 10-10 моль/л, если рН его изоэлектрической точки равно 3,6. К Какому электроду будет двигаться молекула?
147. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 2,35*10-3 моль/л, если рН его изоэлектрической точки равно 8,0. К Какому электроду будет двигаться молекула?
148. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-4 моль/л, если рН его изоэлектрической точки равно 5,8. К Какому электроду будет двигаться молекула?
149. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 4,24*10-2 моль/л, если рН его изоэлектрической точки равно 8,2. К Какому электроду будет двигаться молекула?
150. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 2,23*10-2 моль/л, если рН его изоэлектрической точки равно 5,0. К Какому электроду будет двигаться молекула?
151. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,56*10-2 моль/л, если рН его изоэлектрической точки равно 4,0. К Какому электроду будет двигаться молекула?
152. ИЭТ белка=4,0. Какой это белок? Как изменится его заряд при рН = 2,0. Показать на схеме.
153. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,22*10-5 моль/л, если рН его изоэлектрической точки равно 7,0. К Какому электроду будет двигаться молекула?
154. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,64*10-6 моль/л, если рН его изоэлектрической точки равно 8,0. К Какому электроду будет двигаться молекула?
155. ИЭТ белка=7,0. Какой это белок? Как изменится его заряд при рН = 10,0. Показать на схеме.
156. Как изменится заряд белка-фермента пепсина (ИЭТ=1,0) в кислой среде желудка (рН=2,0). Показать на схеме.
157. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 1,56*10-4 моль/л, если рН его изоэлектрической точки равно 5,0. К Какому электроду будет двигаться молекула?
158. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 3,26*10-5 моль/л, если рН его изоэлектрической точки равно 2,0. К Какому электроду будет двигаться молекула?
159. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 4,43*10-4 моль/л, если рН его изоэлектрической точки равно 9,0. К Какому электроду будет двигаться молекула?
160. Определите знак макромолекулы белка в растворе с концентрацией ионов водорода 3,66*10-2 моль/л, если рН его изоэлектрической точки равно 8,0. К Какому электроду будет двигаться молекула?
161. ИЭТ белка=10,0. Какой это белок? Как изменится его заряд при рН = 5,0. Показать на схеме.
162. ИЭТ белка=5,8. Какой это белок? Как изменится его заряд при рН = 2,0. Показать на схеме.
163. ИЭТ белка равно 4. Какой это белок? Как он будет заряжен, если поместить его в раствор, у которого [Н+] = 3,16 *10-2 моль/л, к какому электроду будет двигаться макромолекула при электрофорезе?
164. Определите знак заряда макромолекулы белка в растворе с рН=8, если рН его изоэлектрической точки равно 3,5. К Какому электроду будет двигаться макромолекула белка при электрофорезе (аноду или катоду)?
165. Определите знак заряда макромолекулы белка в растворе с рН=3, если рН его изоэлектрической точки равно 5,5. К Какому электроду будет двигаться макромолекула белка при электрофорезе (аноду или катоду)?
166. Определите знак макромолекулы белка в растворе с концентрацией ионов гидроксила 10-5 моль/л, если рН его изоэлектрической точки равно 4,2. К Какому электроду будет двигаться молекула?
Приложение А
Таблица 1 – Номера вопросов для контрольной работы
| Цифра шифра | Последняя цифра | ||||||||||
| Предпоследняя цифра | |||||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| 0 | 1,34, 67,100,134 | 2,35, 68,101,135 | 3,36, 69,102,136 | 4,37, 70,103,137 | 5,38, 71,104,138 | 6,39, 72,105,139 | 7,40, 73,106,140 | 8,41, 74,107, 141 | 9,42, 75,108, 142 | 10,43, 76,109,143 | |
| 1 | 11,44, 77,110,144 | 12,45, 78,102,145 | 13,46, 79,103,146 | 14,47, 80,104,147 | 15,48, 81,105,148 | 16,49, 82,106,149 | 17,50, 83,107,150 | 18,51, 84,108, 151 | 19,52, 85,109, 152 | 20,53, 86,110,153 | |
| 2 | 21,54, 87,111,154 | 23,55, 88,112,155 | 24,56, 89,113,156 | 25,57, 90,114,157 | 26,58, 91,115,158 | 27,59, 92,116,159 | 28,60, 93,117,160 | 29,61, 94,118, 161 | 30,62, 95,119, 162 | 31,63, 96,120,163 | |
| 3 | 32,64, 97,121,164 | 33,65, 98,122,165 | 1,66, 99,123,166 | 2,34, 67,124, 134 | 3,35, 68,125,135 | 4,36, 69,126, 136 | 5,37, 70,127,137 | 6,38, 71,128,138 | 7,39, 72,129, 139 | 8,40, 73,130,140 | |
| 4 | 9,41, 74,131,141 | 10,42, 75,132,142 | 11,43, 76,100,143 | 12,44, 77,101,144 | 13,45, 78,102,145 | 14,46, 79,103,146 | 15,47, 80,104,147 | 16,48, 81,105,148 | 17,49, 82,106,149 | 18,50, 83,107,150 | |
| 5 | 19,51, 84,108,151 | 20,52, 85,109,152 | 21,53, 86,110,153 | 22,54, 87,111,154 | 23,55, 88,112,155 | 24,56, 89,113,156 | 25,57, 90,114,157 | 26,58, 91,115,158 | 27,59, 92,116,159 | 28,60, 93,117,160 | |
| 6 | 29,61, 94,118, 161 | 30,62, 95,119,162 | 31,63, 96,120,163 | 32,64, 97,121,164 | 33,65, 98,122,165 | 1,66, 99,123,166 | 2,34, 67,124,134 | 3,35, 68,125,135 | 4,36, 69,126,136 | 5,37, 70,127,137 | |
| 7 | 6,38, 71,128, 138 | 7,39, 72,129,139 | 8,40, 73,130,140 | 9,41, 74,131,141 | 10,42, 75,132,142 | 11,43, 76,100,143 | 12,44, 77,101,144 | 13,45,78,102, 145 | 14,46, 79,103,146 | 15,47, 80,104,147 | |
| 8 | 16,48, 81,105, 148 | 17,49, 82,106,149 | 18,50, 83,107,150 | 19,51, 84,108,151 | 20,52, 85,109,152 | 21,53, 86,110,153 | 22,54, 87,111,154 | 23,55, 88,112,155 | 24,56, 89,113,156 | 25,57, 90,114,157 | |
| 9 | 26,58, 91,115,158 | 27,59, 92,116,159 | 28,60, 93,117,160 | 29,61, 94,118,161 | 30,62, 95,119,162 | 31,63, 96,120,163 | 32,64, 97,121,164 | 1,65, 98,122,165 | 2,66, 99,123,166 | 3,34, 67,124,167 | |
Приложение Б
Министерство сельского хозяйства Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Вятская государственная сельскохозяйственная академия»
Биологический факультет
ДОМАШНЯЯ КОНТРОЛЬНАЯ РАБОТА
ФИО_____________________________________________________
направление подготовки 06.03.01 Биология
шифр, наименование
направленность (профиль) программы бакалавриата «Охотоведение»
курс ________, группа _________
Дисциплина Химия физическая и коллоидная
Тема
(номера вопросов)___________________________________________________ __________________________________________________________________
Регистрационный номер на кафедре_________________________________
Дата регистрации «_______» ____________________________20___г.
Результат проверки ___________________
Киров 20__
Приложение В
Периоды
Г р у п п ы
I
II
III
IV
V
1
H 1
водород
1,00794
2
Li 3
литий
6,941
Be 4
бериллий
9,01218
B 5
бор
10,811
С 6
углерод
12,011
N 7
азот
14,0067
3
Na 11
натрий
22,98977
Mg 12
магний
24,305
Al 13
алюминий
26,98154
Si 14
кремний
28,0855
P 15
фосфор
30,97376
4
K 19
калий
39,0983
Ca 20
кальций
40,078
21 Sc
скандий
44,95591
22 Ti
титан
47,88
23 V
ванадий
50,9415
29 Cu
медь
63,546
30 Zn
цинк
65,39
Ga 31
галлий
69,723
Ge 32
германий
72,59
As 33
мышьяк
74,9216
5
Rb 37
рубидий
85,4678
Sr 38
стронций
87,62
39 Y
иттрий
88,9059
40 Zr
цирконий
91,224
41 Nb
ниобий
92,9064
47 Ag
серебро
107,8682
48 Cd
кадмий
112,41
In 49
индий
114,82
Sn 50
олово
118,710
Sb 51
сурьма
121,75
6
Cs 55
цезий
132,9054
Ba 56
барий
137,33
57 *La
лантан
138,9055
72 Hf
гафний
178,49
73 Ta
тантал
180,9479
79 Au
золото
196,9665
80 Hg
ртуть
200,59
Tl 81
таллий
204,383
Pb 82
свинец
207,2
Bi 83
висмут
208,9804
7
Fr 87
франций
223,0197
Ra 88
радий
226,0254
89 *Ac
актиний
227,0278
104 Db
дубний
[261]
105 Jl
жолиотий
[262]
высшие
оксиды
R2О
RO
R2O3
RO2
R2O5
летучие
водородные
соединения
RH4
RH3
лантаноиды*
| Сe 58 церий 140,12 | Pr 59 празеодим 140,9077 | Nd 60 неодим 144,24 | Pm 61 прометий 144,9128 | Sm 62 самарий 150,36 | Eu 63 европий 151,96 | Gd 64 гадолиний 157,25 | Tb 65 тербий 158,9254 |
актиноиды*
Pa 91
протактиний
231,0359
U 92
уран
238,0289
Np 93
нептуний
237,0482
Am 95
америций
243,0614
Cm 96
кюрий
247,0703
ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
|
| э л е м е н т о в | |||||||||||
|
| VI | VII | VIII | |||||||||
|
| (H)
| He 2 гелий 4,002602 |
| |||||||||
| O 8 кислород 15,9994 | F 9 фтор 18,998403 | Ne 10 неон 20,179 | ||||||||||
| S 16 сера 32,066 | Cl 17 хлор 35,453 | Ar 18 аргон 39,948 | ||||||||||
|
| 24 Cr хром 51,9961 | 25 Mn марганец 54,9380 | 26 Fe железо 55,847 | 27 Co кобальт 58,9332 | 28 Ni никель 58,69 | |||||||
|
| Se 34 селен 78,96 | Br 35 бром 79,904 | Kr 36 криптон 83,80 | |||||||||
|
| 42 Mo молибден 95,94 | 43 Tc технеций 97,9072 | 44 Ru рутений 101,07 | 45 Rh родий 102,9055 | 46 Pd палладий 106,42 | |||||||
|
| Te 52 теллур 127,60 | I 53 иод 126,9045 | Xe 54 ксенон 131,29 | |||||||||
|
| 74 W вольфрам 183,85 | 75 Re рений 186,207 | 76 Os осмий 190,2 | 77 Ir иридий 192,22 | 78 Pt платина 195,08 | |||||||
|
| Po 84 полоний 208,9824 | At 85 астат 209,9871 | Rn 86 радон 222,0176 | |||||||||
|
| 106 Rf резерфордий [263] | 107 Bh борий [262] | 108 Hn ганий [265] | 109 Mt мейтнерий [266] |
| |||||||
|
| RO3 | R2O7 | RO4
| |||||||||
|
| RH2 | RH | ||||||||||
|
| ||||||||||||
| Dy 66 диспрозий 162,50 | Ho 67 гольмий 164,9304 | Er 68 эрбий 167,26 | Tm 69 тулий 168,9342 | Yb 70 иттербий 173,04 | Lu 71 лютеций 174,967 | |||||||
|
| ||||||||||||
| Cf 98 калифорний 251,0796 | Es 99 эйнштений 252,0828 | Fm 100 фермий 257,0951 | Md 101 менделевий 258,0986 | No 102 нобелий 259,1009 | Lr 103 лоуренсий 260,1054 | |||||||
Приложение Г
ПРИМЕРЫ решения задач
ЗАДАЧА №1
Рассчитать осмотическое давление 10 % - ного раствора поваренной соли при температуре 20о С и плотностью раствора 1 г/мл. Степень диссоциации α = 1.
РЕШЕНИЕ
1. Р осм= i ∙Св∙R∙T - уравнение Вант-Гоффа для электролитов
2. ί = 1 + α (υ - 1) = 1+1 (2-1) = 2
3. Св= 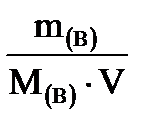
4. m (в)= 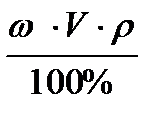 = 10 ∙ 1000 ∙ 1 / 100% = 100 г
= 10 ∙ 1000 ∙ 1 / 100% = 100 г
5. Св=100г / (58,5 г/моль ∙ 1 л) = 1,7 моль/л
6. R = 0,082 л ∙ R атм/моль ∙ К
7. T=t0С+273=20 + 273 = 2930 К
8. Р осм= 2 ∙ 1,7 ∙ 0,082 ∙ 293 = 82,1 атм.
ЗАДАЧА №2
Разбавленных растворов
∆tз = Сm ∙ K, (13)
где Сm – моляльная концентрация раствора, моль/кг;
В разбавленных растворах моляльная концентрация (Сm) незначительно отличается от молярной, поэтому можно принять Cв = Сm.
K – криоскопическая постоянная – численно равна понижению температуры замерзания 1 М раствора. Для воды K - 1,86 град/моль; уксусной кислоты - 3,90 град/моль; бензола – 5,12 град/моль; камфоры – 40,0 град/моль.
Для электролитов (солей, кислот, оснований) в формулу вводится изотонический коэффициент (i):
∆tз = ί ∙ Сm ∙ K, (14)
где Сm – моляльная концентрация раствора, моль/кг;
K –криоскопическая постоянная;
ί – изотонический коэффициент.
∆tз = tзам. р-ля - tзам. р-ра, (15)
tзам. р-ра= tзам. р-ля –∆tз, (16)
где ∆tз – депрессия раствора - понижение температуры замерзания раствора по сравнению с чистым растворителем;
tзам. р-ля – температура замерзания растворителя;
Для водных растворов растворителем является вода: tзам. воды=0 0С.
tзам. р-ра – температура замерзания раствора.
Депрессия крови в норме составляет 0,56 - 0,580.
∆tк = tкип. р-ра - tкип. р-ля, отсюда (17)
tкип. р-ра = tкип. р-ля + ∆tк , (18)
где ∆tк – депрессия – повышение температуры кипения раствора по сравнению с чистым растворителем;
tкип. р-ля – температура кипения растворителя; tкип. воды=1000С.
tкип. р-ра– температура кипения раствора.
∆tк = Сm ∙ Е, (19)
где Сm – моляльная концентрация раствора, моль/кг;
Е – эбулиоскопическая постоянная – численно равна повышению температуры кипения 1 М раствора. Для воды Е – 0,516 град/моль; уксусной кислоты - 3,10 град/моль; бензола – 2,57 град/моль; этилового спирта – 1,06 град/моль.
Для электролитов (солей, кислот, оснований):
∆tк= ί ∙Сm ∙Kкип, (20)
где Сm – моляльная концентрация раствора, моль/кг;
Kкип –эбуллиоскопическая постоянная.
ί – изотонический коэффициент.
ПРИМЕРЫ решения ЗАДАЧ
ЗАДАЧА №1
ПРИЛОЖЕНИЕ Д
Расчётный метод определения рН водных растворов
Ионное произведение воды:
[Н+] ∙ [ОН-] = 10-14 , (21)
где [Н+] - концентрация водородных ионов;
[ОН-] - концентрация гидроксид-ионов в растворе.
рН = - lg [Н+], отсюда [Н+]= 10-рН (22)
рОН = - lg [ОН-], следовательно [ОН-]= 10-рОН (23)
Логарифмическая форма ионного произведения воды:
pН + рОН = 14, (24)
где рН – показатель активной реакции среды – кислотности среды;
рОН – показатель активной реакции среды – щелочности среды.
Десятичный логарифм ( lg ) – это показатель степени, в которую нужно возвести 10, чтобы получилось это число.
Например: lg 100= lg102=2;
lg 1= lg100=0;
lg 0,1= lg10-1=-1.
Если число, логарифм которого необходимо найти, не целое число, то используют таблицы логарифмов Брадиса (смотри приложение Е) или инженерный калькулятор.
Оснований
| Электролит | [H+] | [OH-] |
| Вода |
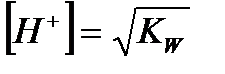
|
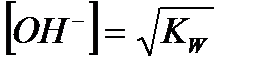
|
| Сильная кислота |
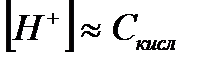
| 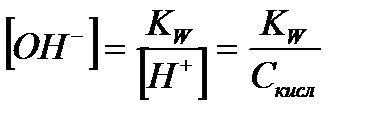
|
| Сильное основание | 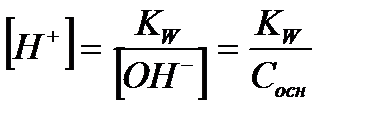
| 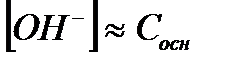
|
| Слабая кислота | 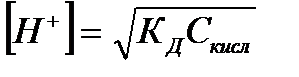
| 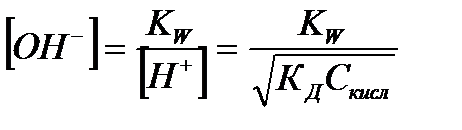
|
| Слабое основание | 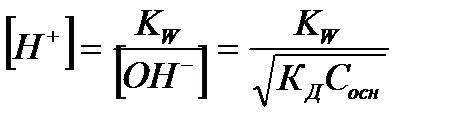
| 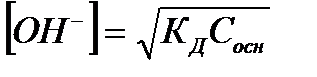
|
примеры решения ЗАДАЧ
ЗАДАЧА №1
[Н+] = 5,29 ∙10-6 моль/л. Определить рН и рОН этого раствора.
РЕШЕНИЕ
рН = -lg [Н+]= - lg 5,29 ∙10-6
Логарифм произведения равен сумме логарифмов множителей, поэтому pН = - (lg 5,29 + lg10-6).
lg 10-6= -6.
lg 5,29 находим по таблице логарифмов Брадиса следующим образом:
1. В первом вертикальном столбце найдем число 52 и в верхней горизонтальной строчке - 9.
На пересечении колонок, в которых записаны указанные числа, находим мантиссу (дробная часть логарифма) - 7235.
2. Перед мантиссой ставим запятую, а перед запятой в характеристику (целая часть логарифма) ставим столько единиц, сколько цифр в целой части логарифмируемого числа без одной.
В нашем примере целая часть числа (5,29) изображена одной цифрой (5), поэтому характеристика будет 1-1 = 0, значит
lg 5,29 = 0,7235
рН = -(0,7235 - 6) = 5,2765 ≈ 5,28
рОН =14 - 5,28 ≈ 8,72
ЗАДАЧА №2
рН раствора равна 3,2. Найти [Н+]этого раствора.
РЕШЕНИЕ
Данный тип задач сводится к нахождению числа по логарифму:
[Н+]= 10-рН = 10-3,2
1. Показатель степени (-3,2) - это логарифм;
-3 – его целая часть (характеристика);
-0,2 – дробная часть логарифма (мантисса).
Характеристика может быть отрицательной, а мантисса только положительной. Поэтому сделаем мантиссу положительной, прибавив к ней 1, и вычтем 1 из характеристики, чтобы в целом показатель степени не изменился.
-1 +1
[Н+]= 10-3, 2 = 10-4 + 0,8 = 10-4 · 100,8
Примечание: показатели степеней складываются при умножении одинаковых оснований.
2. «-4» - это логарифм числа 10-4.
3. В таблице Брадиса находим число, соответствующее мантиссе 8000 (0,8 и 0,8000 одно и то же число) - 631.
В целую часть числа выделяем число цифр, на единицу большее характеристики, поэтому выделяем 1 цифру.
Получится число 6,31.
4. Окончательный результат:
[Н+]= 6,31· 10-4 моль/л
Расчётный метод определения рН буферных растворов
1. Концентрация водородных ионов в кислотной буферной системе прямо пропорциональна константе диссоциации кислоты (Кд к-ты), концентрации (Ск) и объёму (Vк) кислоты и обратно пропорциональна концентрации (Сс) и объёму соли (Vс), взятых для приготовления буферной системы:
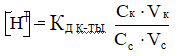
(25)
2. Концентрация гидроксильных ионов в основной буферной системе прямо пропорциональна константе диссоциации основания (Кд осн), концентрации (Сосн) и объёму (Vосн) основания и обратно пропорциональна концентрации (Сс) и объёму (Vс) соли, взятых для приготовления буферного раствора:
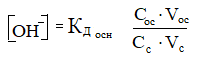 (26)
(26)
примеры РЕШЕНИЯ ЗАДАЧ
ЗАДАЧА №1
Определить рН буферной смеси, состоящей из 10 мл 0,1Н раствора CH 3 COOH и 5 мл 0,1Н раствора CH3COONa. Кк-ты = 1,85·10-5
Решение
Дана кислотная буферная система.
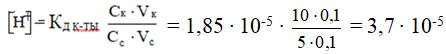 моль/л
моль/л
рН = - lg [Н+] = - (lg 3,7 + lg 10-5) = - (0,5682 - 5) = 4,4318 ≈ 4,43
ЗАДАЧА № 2
Вычислить рН буферной смеси, содержащей 15 мл NH4Cl и 20 мл NH4OH одинаковой концентрации. КNH 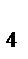 OH = 1,8 10-5
OH = 1,8 10-5
Решение
Дана основная буферная система. При одинаковых исходных концентрациях компонентов буферной системы учитываются только их объемы.
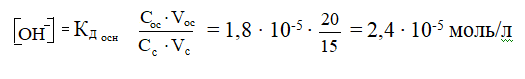
рОН = - lg[ОН-] = - lg 2,4∙ 10-5 = - (lg 2,4 + lg ∙ 10-5) = - (0,3802 - 5) = 4,62
рН = 14 - рОН = 14 - 4,62 = 9,38
ЗАДАЧА № 3
Сколько мл 0,1Н раствора СН3СООН надо прилить к 10 мл 0,1Н раствора СН3СОО Na , чтобы получить буферную систему с рН = 5,4?
Кк-ты = 1,85 ∙ 10-5
Решение
По данному значению рН найдем [Н+]:
[Н+]= 10-рН = 10-5,4 = 100,6 · 10-6 = 3,98 ∙ 10-6 моль/л
Определим необходимый объем кислоты:
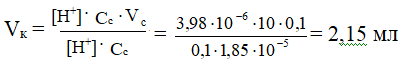
ЗАДАЧА № 4
В каком соотношении надо смешать растворы масляной кислоты и маслянокислого натрия одинаковой концентрации, чтобы получить буфер с рН = 5? Кмасляной к-ты= 1,48 ·10-5
РЕШЕНИЕ
Дана кислотная буферная система.
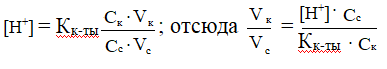 ,
,
поскольку Сс = Ск,
то 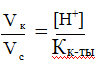
Величину [Н+]находим по данному рН: [Н+]= 10-5 моль/л,
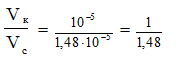
Приложение Ж
СТРОЕНИЕ КОЛЛОИДНОЙ ЧАСТИЦЫ
Золь называется по названию труднорастворимого соединения. Растворимость солей отображена в приложении З.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Для того чтобы правильно записать формулу мицеллы золя, необходимо знать:
· по какой реакции получено труднорастворимое соединение,
· какой реактив был при этом в избытке.
1. Процесс образования гидрозоля (дисперсионная среда – вода) хлорида серебра, полученного в ходе химической реакции:
AgNO 3 (изб) + NaCl → AgCl (золь) + NaNO 3
Гидрозоль образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке.
Примечание: если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится.
При постепенном введении раствора NaCl в раствор AgNO3 в системе в первый момент образуются кристаллические агрегаты (AgCl)m, состоящие из ионов Ag+ и С1- - ядро мицеллы (агрегат). Ядро состоит из ионов, входящих в состав самого золя.
На кристаллических агрегатах происходит адсорбция ионов с образованием двойного ионного слоя.
Ядро (AgCl)m адсорбирует на своей поверхности те ионы, которые отвечают двум требованиям:
· составляют кристаллическую решетку золя;
· находятся в растворе в избытке.
Эти ионы формируют потенциалопределяющий слой (адсорбционный слой родственных ионов).
Этим условиям отвечают ионы серебра. В результате адсорбции ионов Ag+ кристаллические агрегаты хлорида серебра приобретают положительный заряд.
Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристаллов AgCl. Таким образом, агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Ядро с потенциалопределяющими ионами имеет положительный заряд и притягивает ионы противоположного заряда – противоионы.
Эти ионы формируют два слоя:
· адсорбционный (плотный) слой противоионов;
· диффузный (рыхлый) слой противоионов.
Этим условиям отвечают нитрат-ионы NO3–.
Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
Диффузный слой формируют те же противоионы, причём концентрация противоионов диффузного слоя постепенно понижается по мере удаления от ядра.
Между противоионами адсорбционного и диффузионного слоев устанавливается подвижное равновесие.
Противоионы диффузного слоя ориентируют полярные молекулы растворителя, создавая дополнительную сольватную оболочку.
Ядро вместе с ионами адсорбционного слоя составляет коллоидную частицу или гранулу. Гранула всегда заряжена, знак заряда соответствует знаку заряда потенциалопределяющих ионов.
Гранула совместно с противоионами диффузного слоя называется мицелла. Мицелла всегда электронейтральна.
Ионы диффузного слоя под действием электрического поля способны отрываться от мицеллы, и гранула будет двигаться к противоположно заряженному электроду.
Строение мицеллы гидрозоля хлорида серебра представлено на рисунке.
| NO3– NO3– NO3– NO3– |
| NO3– NO3– NO3– NO3 |
| Ag+ Ag+ Ag+ Ag Ag+ Ag+ Ag+ |
| Ag+ Cl– Cl–Ag+ Ag+ Cl– |
1 2 3 4
1 – ядро;
2 – потенциалопределяющие ионы; адсорбционный слой
3 – противоионы адсорбционного слоя
4 – противоионы диффузного слоя
1,2,3 – коллоидная частица (гранула)
1,2,3,4 – мицелла
Формула мицеллы
ядро
{(AgCl)m , nAg+, (n – х) NO3–}  NO3–
NO3–
гранула
Обозначения:
m – условное число молекул в агрегате труднорастворимого соединения;
n – условное число адсорбированных ионов;
(n-x) – условное число противоионов адсорбционного слоя;
x – условное число противоионов диффузного слоя.
2. Процесс образования гидрозоля хлорида серебра, полученного в ходе химической реакции:
AgNO 3 + NaCl (изб) → AgCl (золь) + NaNO 3
Если приливать раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности ядра (AgCl)m будут адсорбироваться хлорид-ионы (Cl-), имеющиеся в избытке в растворе, а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия (Na+).
NO3– NO3–
Na+– Na+
Na+ Na+
Na+ Na+
CL- CL-
СL- Ag CL-
CL- CL-
Ag+ Cl– Cl–Ag+
Ag+ Cl–
1 2 3 4
1 – ядро;
2 – потенциалопределяющие ионы; адсорбционный слой
3 – противоионы адсорбционного слоя
4 – противоионы диффузного слоя
1,2,3 – коллоидная частица (гранула)
1,2,3,4 – мицелла
Формула мицеллы
ядро
{(AgCl)m, nCl–, (n – x)Na+} 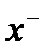 Na+
Na+
гранула
Знак заряда коллоидной частицы определяется зарядом потенциалопределяющих ионов, адсорбированных ядром. На границе раздела твердое тело (ядро) – раствор возникает двойной электрический слой.
Дзета – потенциал (электрокинетический потенциал) – разность потенциалов между диффузной и адсорбционной частями двойного электрического слоя.
Если каким-либо путем заряд коллоидных частиц уменьшить или полностью нейтрализовать, то диффузный слой разрушается, тогда частицы получают возможность слипания и укрупнения, что приводит к понижению агрегативной устойчивости коллоидной системы, т.е. коагуляции.
ПРИЛОЖЕНИЕ З
ПРИМЕРЫ Решения задач
Задача №1
ИЭТ = 5. Какой это белок? Как будет заряжен белок при рН = 4, при рН = 6, при рН = 7,5? Показать на схеме.
Решение
1. ИЭТ ниже 7, значит белок кислый.
2. Изображаем схему белка с преобладанием карбоксильных групп - СООН .
3. Показываем диссоциацию данного белка при рН = 7.
4. Смотрим, как заряжается ион белка и какую среду создает белок.
├ СООН HOH -├ COO - + H + -├ COO - + Н+
├ СООН -├ COO - + H + -├ COO - + Н+
├ СООН -├ COO - + H + -├ COO - + H 2 O
├ NH 2 +├ NH 3 + + OH - +├ NH 3 +
| pH = 7 pH среды, в которую помещен белок. Ион белка в данной среде имеет заряд (- 2) |
| Белок создает кислую среду, так как количество ионов Н+ больше, чем количество ионов ОН- |
5. При помещении белка в кислую среду с рН = 6: ионы Н+ данной среды частично понижают диссоциацию белка по карбоксильной группе (-СООН).
Понижение диссоциации на схеме можно изобразить стрелочкой. По схеме надо добавить столько ионов Н+, чтобы создать концентрацию ионов Н+ больше прежней.
├ СОО- + Н+ - ├ COO - + H + - ├ COO - + Н+ + Н+
├ СОО- + Н+ - ├ COO - + Н+ + Н+ 0 ├ COO Н + Н+
├ СОО- + Н+ + Н+ 0├ COO Н + H + 0 ├ COO Н + H +
| pH = 6 Отрицательный заряд понижается. По нашей схеме до (- 1) |
| pH = 5 = ИЭТ Заряд равен 0 |
├ NH 3 + + H 2 O + ├ NH 3 + + H 2 О +├ NH 3 + + H 2 O
6. При помещении белка в среду с рН = ИЭТ = 5 происходит дальнейшее подавление диссоциации белка по карбоксильной (–СООН) группе, т.к. при данном значении рН концентрация ионов Н+ больше, чем при рН = 6.
По схеме надо добавить столько ионов Н+, чтобы при понижении диссоциации белок потерял заряд и перешел в изоэлектрическое состояние. По условию задачи белок надо поместить еще в среду с рН = 4, где концентрация ионов Н+ еще больше, чем при рН = 5. Следовательно, по схеме надо добавить еще ионов Н+.
0 ├ COO Н + Н+
0 ├ COO Н + Н+
0 ├ COO Н + Н+
| pH = 4 Заряд положительный. По нашей схеме (+1) |
+ ├ NH 3 + + Н2О
7. Для того чтобы показать, как заряжен белок при рН = 7,5, удобнее использовать схему белка при рН = 7.
- ├ COO - + Н+ + ОН- -├ COO - + НОН
- ├ COO - + Н+ + ОН- -├ COO - + НОН
- ├ COO - + H 2 O -├ COO - + H 2 O
+├ NH 3 + + ОН- + ОН- 0├ NH 2 + H ОН + ОН-
| pH = 7,5 Заряд отрицательный. По нашей схеме (- 3) |
При помещении белка в щелочную среду происходит нейтрализация ионов Н+ и понижение диссоциации аминогруппы (-NH2). По схеме надо добавить столько ионов ОН-, чтобы их хватило для нейтрализации ионов Н+ и создания повышенной концентрации.
Задача №2
ИЭТ = 7,5. Какой это белок? Как заряжен при рН = 8, при рН = 6? Показать на схеме.
Решение
1. ИЭТ > 7, следовательно, белок основной.
2. Изображаем схему основного белка с преобладанием аминогрупп
(-NH2).
3. Показываем, как идет диссоциация белка при рН = 7.
4. Определяем знак заряда иона белка и среду, которая создается после диссоциации.
├ СООН HOH - ├ COO - + H + - ├ COO - + H 2 O
├ NH 2 + ├ NH 3 + + OH - + ├ NH 3 +
├ NH 2 + ├ NH 3 + + OH - + ├ NH 3 + + OH -
├ NH2 + ├ NH3+ + OH- + ├ NH3+ + OH-
| pH = 7 Заряд положительный. По нашей схеме (+ 2) |
| Создает щелочную среду, т. к. количество ионов ОН- больше, чем количество ионов Н+ |
5. Помещаем белок в щелочную среду с рН = 7,5. Ионы ОН- данной среды понижают диссоциацию белка по аминогруппе (–NH2).
По схеме надо добавить столько ионов ОН-, чтобы при понижении диссоциации белок потерял заряд и перешел в изоэлектрическое состояние.
- ├ COO - + H 2 O - ├ COO - + H 2 О - ├ COO - + H 2 O
+├ NH 3 + + OH - + ОН- 0├ NH 2 + НОН + OH - 0 ├ NH 2 + Н OH - + ОН-
+├ NH 3 + + OH - + ОН- 0├ NH 2 + H 2 О + ОН- 0 ├ NH 2 + H 2 О + OH -
| pH = 7,5 = ИЭТ Заряд равен нулю |
| рН = 8 Заряд отрицательный. По нашей схеме (- 1) |
+├ NH 3 + + OH - +├ NH 3 + + OH - + ОН- 0 ├ NH 2 + H 2 О + OH -
6. По условию задачи белок надо поместить в среду с рН = 8. При рН = 8 концентрация ионов ОН- больше, чем при рН = 7,5. Следовательно, по схеме надо еще добавить ионов ОН-. Белок зарядился отрицательно.
7. Для того чтобы показать, как заряжен данный белок при рН = 6, следует использовать схему данного белка при рН = 7. При помещении белка в кислую среду происходит нейтрализация ионов ОН- и понижение диссоциации по карбоксильным (-СООН) группам. По схеме надо добавить столько ионов Н+, чтобы их хватило для нейтрализации ионов ОН - и создания повышенной концентрации.
- ├ COO - + H + + Н+ 0 ├ COO Н + H +
+ ├ NH 3 + + Н2О + ├ NH 3 + + Н2О
+ ├ NH 3 + + ОН- + Н+ + ├ NH 3 + + H О H
+ ├ NH 3 + + OH - + Н+ + ├ NH 3 + + H О H
| рН = 6 Заряд положительный. По нашей схеме (+ 3) |
Л.В. Пилип
Химия физическая и коллоидная
Учебно-методическое пособие
для самостоятельной и контрольной работ обучающихся
заочной и очно-заочной форм обучения
по направлению подготовки 06.03.01 Биология
Киров 2018
ПОДГОТОВКА К ЗАЧЁТУ
УКАЗАНИЯ К ПОДГОТОВКЕ К ЗАЧЁТУ
Процедура оценивания знаний, умений и навыков при проведении промежуточной аттестации по дисциплине «Химия физическая и коллоидная» проводится в форме зачета.
Порядок организации и проведения промежуточной аттестации обучающегося, форма проведения, процедура сдачи зачета, сроки и иные вопросы определены «Положением о порядке организации и проведения текущего контроля успеваемости и промежуточной аттестации обучающихся».
Процедура оценивания знаний, умений и навыков при проведении зачета по дисциплине «Химия физическая и коллоидная» проводится путем собеседования с обучающимся. При сдаче зачёта соблюдаются следующие правила:
· обучающиеся, имеющие задолженность по текущему контролю успеваемости, получают зачёт только после ликвидации задолженности;
· обучающемуся выдаются два вопроса по дисциплине с учетом определенного уровня сложности (низкого, базового или продвинутого);
· в определенное время (в среднем 10-15 минут на вопрос) обучающийся составляет план ответа, который излагает преподавателю;
· по результатам собеседования выставляется оценка согласно установленной шкале оценивания (зачтено/незачтено).
Для зачёта необходима зачтённая контрольная работа, сданная на кафедру в печатном и электронном виде.
Задание для подготовки к сдаче зачета
1.Осмос – это:
а) односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией;
б) диффузия молекул растворителя через полупроницаемую мембрану под действием внешнего давления;
в) самопроизвольная диффузия молекул растворённых веществ через полупроницаемую мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией;
г) Односторонняя диффузия молекул растворителя и растворённых веществ через полупроницаемую мембрану с целью выравнивания концентраций.
2. Имеется 4 раствора, содержащие в 5 л 1 моль сахарозы (первый); 3 моль глюкозы (второй); 1,5 моль мочевины (третий) и 0,5 моль глицерина (четвёртый). В каком растворе больше осмотическое давление?
а) в первом;
б) во втором;
в) в третьем;
г) в четвёртом.
3. Частицы коллоидного раствора гидроксида железа имеют положительный заряд. Какие вещества следует применить для коагуляции данного раствора?
а) этиловый спирт;
б) глицерин;
в) AlCl3.
4. Коллоидная химия изучает:
а) гетерогенные дисперсные системы;
б) гомогенные дисперсные системы;
в) однофазные и многофазные системы;
г) однокомпонентные и многокомпонентные системы.
5. Коллоидные частицы имеют диаметр (см):
а) 10 –7 – 10 –5;
б) 10 –7 – 10 –9;
в) 10 –9 – 10 –10;
г) 10 –5 – 10 –7.
6. Коллоидные растворы способны:
а) опалесцировать;
б) отражать и преломлять свет;
в) поглощать и отражать свет;
г) пропускать и поглощать свет.
7. Коллоидная частица…
а) имеет только положительный заряд;
б) имеет только отрицательный заряд;
в) может иметь как положительный, так и отрицательный заряд;
г) не имеет заряда.
8. Коллоидная частица входит в состав:
а) мицеллы;
б) гранулы;
в) агрегата;
г) ассоциата.
9. Коагуляция частиц – это:
а) слипание, укрупнение;
б) разукрупнение, расщепление;
в) удерживание частиц в объёме жидкости.
10. Коллоидная защита – это:
а) повышение устойчивости растворов высокомолекулярных соединений при добавлении коллоидных растворов;
б) повышение устойчивости коллоидных растворов при добавлении высокомолекулярных соединений;
в) понижение дисперсности коллоидного раствора при добавлении коагулянтов;
г) повышение дисперсности коллоидного раствора при добавлении пептизаторов.
11.Какие системы относятся к эмульсиям?
а) жидкость – газ;
б) жидкость – твёрдое;
в) жидкость – жидкость;
г) твёрдое – газ.
12. Тиксотропия – это:
а) обратимый переход геля в коллоидный раствор при механическом воздействии;
б) самопроизвольное уменьшение объёма геля;
в) превращение коллоидного раствора в гель;
г) превращение геля в студень.
13. Самопроизвольный процесс разрушения (старения) геля называется:
а) тиксотропия;
б) высаливание;
в) диспергирование;
г) синерезис.
Ответы: 1-а, 2-б, 3-в, 4-а,5-а, 6-а, 7-в,8 –а,9- а,10 –б, 11-в, 12-а, 13-г
Дата: 2019-03-05, просмотров: 744.