Класс
Астана 2018
Содержание
О языковых целях. 3
Долгосрочный план. 5
9.1А Основные классы неорганических соединений. 11
9.1В Периодическая система химических элементов. 19
9.1С Строение вещества. 26
9.2А Растворение и растворы.. 33
9.2В Неорганический анализ. 47
9.3A Металлы и сплавы.. 56
9.3B Химия элементов 1, 2-ой и 13-ой групп. 63
9.3C Неметаллы и их соединения (Группы 16 и 17) 70
9.3D Скорость химических реакций. 78
9.4A Химия кремния - Группа 14. 84
9.4B Химические вещества в организме человека. 90
9.4C Радиохимия. 96
План урока. 103
О языковых целях
Каждый предмет имеет свой собственный стиль речи, который можно назвать "академическим языком" конкретного предмета. Академический язык является ключевым инструментом для изучения предметного содержания и улучшения способности думать и работать с понятиями предмета. Большинство учащихся, обучающихся через второй или третий языки, нуждаются в поддержке на протяжении всего процесса обучения для того, чтобы освоить академический язык и предметное содержание. В контексте трехъязычного образования, развитие академического языка на первом языке также требует постоянного внимания, и то ограниченное время, отведенное на обучение через первый язык, должно использоваться эффективно и результативно.
Языковые цели являются важным инструментом для овладения академическим языком. От того, насколько ясно сформулированы языковые цели, будет зависеть понимание учащимися того, что от них ожидается. Кроме того, языковые цели помогут учителям и учащимся создавать, измерять и поддерживать мотивацию к учебе. Учителя-предметники, которые поддерживают постоянный двойной фокус, как на изучение предметного содержания, так и на развитие академического языка, показывают учащимся пример и помогают обучаться и тому, и другому.
Для поддержания обучения академическому языку, учителям рекомендуется включать следующие цели обучения в учебные планы:
• акцентирование внимания учащихся на академическом языке (например, лексика, включающая терминологию и фразы, необходимые для достижения целей обучения предмета);
• предоставление рабочего языка на уроке, необходимого для работы с понятиями предметного содержания (например, фразы, необходимые для: работы в группе, умения задавать вопросы, проведения анализа ситуации, дискуссии/дебатов);
• предварительное обучение и, прежде всего, предварительное использование в уместном контексте лексики, включая терминологию и фразы, необходимые для того, чтобы научиться правильно использовать их в предмете;
• использование учащимися всех четырех языковых навыков в различных комбинациях (например, чтение-аудирование, чтение-письмо, чтение-говорение, аудирование-письмо, и т.д.) для достижения различных целей;
• вовлечение учащихся в диалог-дискуссию (например, не принимать односложные ответы от учащихся и не задавать вопросы, ответы на которые просто демонстрируют знание; побуждать учащихся использовать знания для эффективного обсуждения, а также предоставлять богатый лексический запас, чтобы учащиеся могли поддержать диалог);
• развитие навыков обучения, характерных для языка (например, избирательное прослушивание, разъяснение, развитие металингвистического и метакогнитивного осознания, перефразирование и навыки пользования словарем);
• поощрение критического размышления о языке (например, сравнение языков, поощрение учащихся использовать язык более точно, оценивание прогресса в изучении языка);
• постановка языковой цели в начале урока и обсуждение прогресса в достижении этой цели в конце урока.
Пример языковой цели представлен в каждом разделе учебного плана. Пример языковой цели также включает в себя компоненты академического языка, на использование и запоминание которого важно обратить внимание учащихся. Они указаны под следующими заголовками:
(1) лексика и терминология, специфичная для предмета,
(2) набор полезных фраз для диалога/письма. Если язык понятен и ясен для учащихся, это поможет им достичь как предметные цели, так и цели в изучении языка.
Для создания языковых целей можно использовать следующие глаголы: анализировать, распределять по категориям, выбирать, классифицировать, сравнивать, связывать, сопоставлять, копировать, создавать, критиковать, определять, описывать, разрабатывать, оценивать, объяснять, приводить примеры, предполагать, выявлять, обосновывать, вести переговоры, прогнозировать, производить, предлагать альтернативные решения, указывать причины почему, пересматривать, реорганизовывать, перефразировать, пересказывать, пересматривать, переписать, играть в ролевые игры, обобщать, синтезировать и писать, использовать для различных целей, писать своими словами определение, иллюстрировать.
Несмотря на то, что некоторые языковые цели могут считаться целями предметного содержания, процесс разделения содержания и языка поможет учащимся поддерживать двойной фокус, как на содержании, так и языке. Это также поможет сбалансировать внимание, уделяемое как ответам/решениям, так и процессам, используемым для нахождения этих ответов/решений. В частности, фокусируясь на этих процессах, можно способствовать более точному использованию языка и улучшению мыслительной деятельности.
На уроках неязыковых дисциплин большинство целей обучения будут сосредоточены на содержании, но хотя бы одна должна быть сосредоточена на развитии языка.
Долгосрочный план
Класс: 9
| Раздел долгосрочного плана | Темы/Содержание раздела долгосрочного плана | Цели обучения | ||
Четверть
С Строение вещества
(9 ч)
Движение электронов в атоме
9.1.4.1 знать понятия атомная орбиталь, энергетический уровень, энергетический подуровень;
9.1.4. 2 составлять электронные и графические формулы для первых 36 элементов;
9.1.4.3 определять, как может быть получена завершенная внешняя оболочка атома;
9.1.4.4 понимать последствия присоединения или отдачи электронов атомами или ионами;
Электроотрицательность. Ковалентная связь
9.1.4.5 знать понятие электроотрицательности
9.1.4.6 объяснять механизм образования ковалентной связи;
9.1.4.7 объяснять механизм образования ионной связи;
Металлическая связь
9.1.4.8 объяснять образование металлической связи;
9.1.4.9 сравнивать металлическую связь с ионной и ковалентной связью;
· Типы кристаллических решеток
· Демонстрация №1 «Типы кристалличечских решеток»
9.1.4.10 знать типы кристаллических решеток;
9.1.4.11 объяснять зависимость физических свойств веществ от типа кристаллической решетки;
Четверть
A Растворение и растворы
(14 ч)
Молярная концентрация.
Демонстрация №2 Практическая работа № 2 «Приготовление растворов с заданной молярной концентрацией»
9. 3. 4 . 1 понимать термин «концентрация» раствора;
9. 3. 4 .2 вычислять молярную концентрацию растворенного вещества в растворе;
9. 3. 4 .3 понимать принцип растворимости веществ в различных растворителях;
Электролитическая диссоциация.
Лабораторная работа № 5 «Электролиты и неэлектролиты»
9.3.4.4 классифицировать вещества на электролиты и неэлектролиты, слабые и сильные электролиты
9. 3. 4 .5 понимать роль воды в процессе диссоциации;
9. 3. 4 .6 объяснять механизм электролитической диссоциации веществ с ионными и ковалентными полярными видами связей;
Кислотность и основность растворов.
Лабораторная работа №6 «Определение среды растворов по значению рН»
9. 3. 4 .7 знать вещества, ионизация которых приводит к образованию H+(водн) и OH-(водн) ионов;
9.3.4. 8 понимать кислотность, как присутствие в водном растворе ионов H+(водн);
9. 3. 4 .9 понимать основность, как присутствие в водном растворе ионов OH-(водн);
9. 3. 4 .11 определять среду раствора по значению рН;
9. 3. 4 .12 понимать значение «сила электролита» и отличать его от понятия «концентрация»;
9. 3. 4 .10 составлять уравнения реакций в ионном виде;
9.3.4.1 3 определять среду растворов и составлять уравнения реакции гидролиза солей;
9 . 2.3.2 производить вычисления по химическим уравнениям, если одно из исходных веществ дано в избытке;
В Неорганиче ский анализ
( 8 ч)
9.4.1.8 знать и применять качественные реакции на водород, кислород, диоксид углерода, воду;
9.4.1.9 определять катионы металлов по окрашиванию пламени: Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Cu2+;
9.4.1.10 знать качественные реакции на определение катионов NH4+,Ca2+, Аl3+, Zn2+, Mg2+, Cr3+, Ba2+, Cu2+, Fe2+, Fe3+ .
9.4.1.11 знать качественные реакции на хлорид-, бромид-, йодид-, сульфат-, карбонат-, фосфат-, нитрат-, силикат- ионы;
9.4.1.12 составлять план эксперимента по определению катионов и анионов и осуществлять его на практике;
9.4.1.13 составлять план эксперимента по определению состава незнакомого вещества и осуществлять его на практике;
9.4.1.14 знать, что существуют современные инструментальные методы для определения веществ (хроматография, масс-спектрометрия, ИК-спектроскопия);
9.4.1.15 знать и понимать применение хроматографии для разделения цветных пигментов;
Четверть
А Металлы и сплавы
(6 ч)
9.1.4.12 объяснять физические свойства металлов в зависимости от типа связи и кристаллической решетки;
9.1.4.13 описывать характерные химические свойства металлов;
9.1.4.14 сделать вывод о преимуществах сплавов;
9.1.4.15 знать состав, свойства и применение латуни и бронзы;
9.1.4.16 знать сплавы железа чугун и сталь, а также процентное содержание углерода в них;
9.1.4.17 знать о распространении и добыче металлов в Казахстане;
9 . 2.3.3 вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего определенную массу примесей;
В Элементы 1, 2 и 13 групп
(8 ч)
9.2.1.5 знать химические свойства металлов 1-ой группы: взаимодействие лития, натрия, калия с кислородом воздуха. хлором и водой;
Алюминий
Лабораторная работа №12 «Взаимодействие магния, кальция и алюминия с кислородом, водой и разбавленными кислотами»
9.2.1.6 знать химические свойства металлов 2 группы: горение магния, кальция на воздухе, взаимодействие их с хлором, водой, разбавленными кислотами;
9.2.1.7 знать химические свойства металлов 13-ой группы: взаимодействие алюминия с разбавленными кислотами и щелочами;
9.2.1.8 прогнозировать свойства неизученных элементов 1, 2 группы;
9.2.1.9 составлять уравнения химических реакций элементов 1, 2 и 13 групп и их соединений методом электронного баланса;
Четверть
A Химия кремния – Группа 14
(9 ч)
9.2.1.1 6 знать электронное строение атома кремния
9.2.1.17 объяснять способность кремния образовывать различные типы макромолекулярных структур;
9.2.1.18 знать строение, физические свойства и применение кремния, диоксида и карбида кремния;
9.2.1.19 объяснять полупроводниковые свойства кремния;
9.2.1.20 оценить значение кремния и его соединений в современном мире;
C Радиохимия
(9 ч)
9.1.2.1 понимать, что с увеличением числа протонов, ядро становится менее стабильным;
9.1.2.2 знать природу и свойства радиоактивного излучения;
9.1.2.3 знать и понимать последствия радиоактивного распада;
9.1.2.4 понимать, что распад ядра является самопроизвольным процессом;
9.1.2.5 моделировать процесс радиоактивного распада;
9.1.2.6 понимать смысл термина «период полураспада»;
9.1.2.7 понимать, что при распаде ядра выделяется энергия, которая является эффективным источником энергии;
9.1.2.8 оценивать перспективы развития атомной промышленности в Казахстане;
9.1.2.9 объяснять проблемы негативного влияния на окружающую среду атомной промышленности;
|
Контекст | |||||||||||||
| Раздел предусматривает расширение знаний учащихся по теме «Основные классы неорганических соединений». Здесь объясняются различия между щелочами и основаниями, рассматриваются способы получения солей. Темы данного раздела являются основой для понимания учащимися окислительно-восстановительных реакций и множества важных аспектов, которые будут необходимы в старшей школе. Также учащиеся приобретут опыт в планировании и проведении экспериментов. | |||||||||||||
|
Цель обучения по предмету |
Языковая цель обучения | Предметная лексика и терминология |
Краткий обзор | ||||||||||
| В разделе рассматриваются различия между основными, кислотными и амфотерными оксидами. Вводится понятие «сила электролита». Дается четкое определение и объяснение реакции нейтрализации. Учащимся представлены понятия рН (математические расчёты даются в старшей школе). Вводятся способы приготовления солей, включая титрование, и учащиеся смогут на практике провести данные эксперименты. | |||||||||||||
| Ссылка в предмет. программе |
Цели обучения |
Предварительные знания Расположение электронов в атомах (8.1А.) Ряд активности металлов (8.2.А) | |||||||||||
| Данный раздел расширяет понимание учащихся о значении периодической таблицы и основных принципах химии, которые были освещены в материалах, изученных ранее. Рассматриваются вопросы о свойствах химических элементов и их соединений с позиции электронного строения, а также расположения данного химического элемента в периодической таблице. Эти знания представляют основу для понимания основ неорганической химии, которую они продолжат изучать в последующих разделах. | |||||||||||||
|
Краткий обзор | |||||||||||||
| Учащиеся повторяют некоторые общие элементарные знания о структуре Периодической таблице, расположение в ней элементов и их электронное строение. Они продолжают расширять свои знания о структуре таблицы и закономерностях изменения свойств соединений элементов, вырабатывая общие правила и концепции. | |||||||||||||
| Ссылка в предметной программе | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения |
| 9.2.1.1 знать распределение элементов в Периодической таблице; 9.2.1.2 объяснять физический смысл атомного номера, группы, периода 9.2.1.3 понимать, что элементы одной группы содержат на внешнем энергетическом уровне одинаковое количество электронов; 9.2.1.4 объяснять закономерности изменения химических свойств элементов и их соединений в группах и периодах | (К) (И) (О) Раздайте учащимся «скелетную» периодическую таблицу, цветные карандаши или фломастеры. Попросите их написать в них группы и периоды, символы металл и неметалл, указать номер группы, порядковые номера химических элементов. и т.д. (см.ссылку справа). Попросите их указать области таблицы, в которых содержатся металлы, неметаллы, твердые вещества , жидкости и газы и т.д. (У, К) Объясните учащимся, что замена атомной массы зарядом ядра была первым шагом в раскрытии физического смысла периодического закона. Задайте проблемный вопрос: почему появилась необходимость такой замены ( учащиеся должны привести примеры элементов, расположенных не по возрастанию атомных масс) ? Вместе с учащимися рассмотрите вопрос физического смысла понятия «атомный номер». Через ряд вопросов низкого и высокого уровня сложности. Например, Как вы понимаете понятие «Атомный номер»? Что он обозначает? Чему равен атомный номер водорода, кальция, серы, хлора и т.д. Как узнать количество протонов и электронов у атома фосфора, железа, цинка и т.д.? (К) Обсудите вопрос значения номера группы, периода с точки зрения строения атома. Учащиеся должны понять, что номер периода с точки зрения строения атома обозначает количество энергетических уровней или электронных оболочек. А номер группы обозначает число электронов на внешнем энергетическом уровне. (К) Раздайте учащимся копии периодической таблицы с указанными значениями электронных конфигураций атомов и попросите их посмотреть число электронов на внешней оболочке для каждого элемента. (К) (О) Спросите, какая возникает закономерность. Учащиеся должны увидеть, что количество электронов на внешней оболочке данного элемента равно номеру группы, в котором расположен этот элемент. (К) Попросите учащихся выделить желтым контуром в таблице 1-2 группу и подписать эти группы как s-блок. С 3 по 12 группу выделить зеленым цветом и это будет d-блок. С 13 по 18 группу выделить фиолетовым цветом и это будет p-блок. Лантаноиды выделить голубым цветом, актиноиды – красным. Подписать их как f-блок. (Г, К) Можно устроить «мозговой штурм» с химическими элементами. Переставьте группы периодической таблицы, и попросите их заполнить ячейки элементов названиями, которые они «штурмовали». Спросите, сколько электронов они имеют на внешней оболочке. (О ) Спросите, какую информацию они получили исходя из количества электронов. (У, К) Напомните учащимся, что химические свойства элементов и их соединений напрямую зависят от строения атома. В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет. (И) или (Г) Попросите учащихся на примере шестой группы (подгруппа кислорода) обсудить вопросы: - Как изменяется радиус атома в группе сверху вниз? \ -Какова сила притяжения электронов к ядру атома? - Как изменяется способность атомов отдавать и принимать электроны? - В каком случае элемент обладает металлическими свойствами? (И) (О) Попросите учащихся разработать правила закономерностей изменения химических свойств элементов и их соединений в группах. (К) (Г) или (И) Предложите учащимся на примере элементов второго периода (Li-Ne) ответить на следующие вопросы: - Как изменяются радиусы атомов химических элементов в периоде? - Что происходит с электронами последнего энергетического уровня? (К) Также учащиеся должны написать в тетрадях закономерность изменения химических свойств элементов и их соединений в периодах. (Г) или (И) Попросите учащихся определить «Короля Неметаллов» и «Короля Металлов» и объяснить свой выбор. (У, К) Акцентируйте внимание учащихся, что есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства. Попросите учащихся выписать их в тетради: Zn, Cr, Al, Sn, Pb, Mn, Fe, Be. (О ) Попросите учащихся сделать надписи в копиях таблиц, в виде стрелочек указывающих закономерности: а) окислительных и неметаллических свойств в периодах; б) восстановительных и металлических свойств в периодах; в) восстановительных и металлических свойств в группах. Затем подвести итог: С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне. (О ) (И) Проведите проверочный тест по данной теме в виде различных видов активных форм обучения и дифференциации заданий. | Они должны указать каждый элемент в таблице. Убедитесь, что данную работу выполняет каждый учащийся.
Физический смысл атомного (порядкового номера )Z элемента в периодической системе элементов был установлен в ядерной модели атома Резерфорда: Z совпадает с числом положительных элементарных зарядов в ядре, закономерно возрастающих на единицу при переходе от предыдущего элемента к последующему.
Таблица должна быть длиннопериодная
(Г) Можно украсить лабораторию Постерами.
Помогите учащимся понять, что электроны на внешней оболочке обозначают, сколько связей элемент может образовать.
Также скажите, что валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях, а именно, сколько связей может образовать данный элемент.
(О) (И) Eсли вы располагаете временем, вы можете предложить учащимся написать рассказ о своем любимом элементе.
Убедитесь, что все учащиеся правильно понимают, что
В группах сверху вниз возрастают металлические свойства элементов
Усиливаются основные свойства их соединений
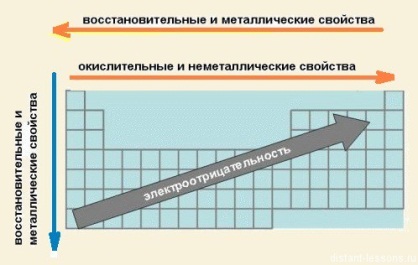
Следует обратить внимание на то, что понятие «электроотрицательность» в этом разделе не вводится. Оно встретится в разделе «Химическая связь».
Убедитесь, что все учащиеся правильно поняли, что:
В периодах слева направо возрастают неметаллические свойства элементов;
усиливаются кислотные свойства их соединений.
Это должно выглядеть примерно так:
| Вы можете найти полезные таблицы здесь: http://www.nclark.net/KnowPeriodicTable.htm Песня-анимация про элементы: http://www.privatehand.com/flash/elements.html Брошюра по химическим элементам: http://www.nclark.net/ElementBrochure.html Другие полезные и занимательные идеи: http://www.nclark.net/PeriodicTable Физический смысл закона периодичности: http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_3.html Периодический закон и периодическая система: http://maratakm.narod.ru/index3.files/Page544.htm Элементарные сведения о строении атома: http://him.1september.ru/article.php?ID=200800603 Закономерности в периодической таблице http://serc.carleton.edu/sp/mnstep/activities/19801.html Закономерности изменения химических свойств элементов и соединений: https://distant-lessons.ru/ximiya/zakonomernosti-izmeneniya-ximicheskix-svojstv-elementov-i-ix-soedinenij Объяснение структуры Периодической таблицы ХЭ: http://prosto-o-slognom.ru/chimia/09_Periodicheskaya_tablitsa.html · Тест с ответами на тему: Периодическая система элементов Д.И.... testdoc.ru/ximiya/test-s-... копия |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
П - работа в паре
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
С Строение вещества | |||
| Рекомендуемые предварительные знания | |||
| Все темы о строении атома рассматриваются в частности: Расположение электронов в атомах (8.1A) Относительная атомная масса и простейшие формулы (7.4С) | |||
|
Контекст | |||
| В данном разделе рассматриваются понятия строение атома, поведение электронов в атомах и последствия этого на структуру и вид связи элементов и соединений. Понимание данных тем поможет учащимся в изучении последующих разделов для лучшего восприятия предмета. Может прослеживаться некоторая информация о магнитных полях и электрического заряда из курса физики. | |||
|
Краткий обзор | |||
| Учащиеся повторяют тему об электронах, строении атома, движении электрона в атоме, правила и принципы, лежащие в основе теории строения атома. Это приводит к пониманию механизма образования ионной и ковалентной связей, и общие свойства которым присущи данным типам структур. |
| Ссылка в учебную программе | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения | ||||||||||||||||||||
| 9.1.4.1 знать понятия атомная орбиталь, энергетический уровень, энергетический подуровень. 9.1.4.2 уметь составлять электронные и графические формулы первых 36 элементов; | (К) Начните урок с того, что атомы элементов имеют очень сложное строение и каждому атому соответствует совокупность определенных атомов. Попросите учащихся ответить на ряд вопросов:
-Каково строение атома?
- Каков заряд и масса субатомных частиц?
- Что такое нуклоны?
(У, К) Объясните учащимся понятие «атомная орбиталь (АО)», как область наиболее вероятного пребывания электрона в атоме. Покажите им картинки, какие по форме могут быть орбитали.
(У, К) Объясните, что энергия, которой обладает электрон в определенном стационарном состоянии, образует «энергетический уровень».
Объясните, понятие «энергетические подуровни», как подуровни, образованные из орбиталей и электронов с одинаковыми значениями энергии.
(К) Учащиеся должны записать в тетрадях таблицу, которую они будут использовать при составлении графических формул для первых 36-ти элементов.
Энергетические подуровни (ЭП)
(О ) (И) Попросите учащихся составить электронную формулу для нескольких атомов различных первых 36-ти химических элементов. (У, К) Затем на основании составленных ими формул объясните принцип составления графических формул. | Акцентируйте внимание учащихся на том, что ядро занимает очень небольшую часть всего объема атома. Однако при этом почти вся масса атома сосредоточена в его ядре, и поэтому плотность ядра чрезвычайно велика Следует показать только формы орбиталей, но не рассматривать их по типу образования.. | Материал о строении атомов. http://www.alhimik.ru/teleclass/glava2/gl-2-6.shtml http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_2.html http://him.1september.ru/article.php?ID=200501001 Электронные формулы атомов элементов: http://studopedia.ru/17_109988_polnie-elektronnie-formuli-atomov-elementov.html | |||||||||||||||||||||
| 9.1.4.3 определить каким путем может быть получена завершенная внешняя оболочка атома; 9.1.4.4 понимать последствия присоединения или отдачи электронов атомами или ионами; 9.1.4.5 знать понятие электроотрицательности 9.1.4.6 объяснять механизм образования ковалентной связи; 9.1.4.7 объяснять механизм образования ионной связи; | (К) (Г) Попросите учащихся обсудить вопросы: Как образуется химическая связь в соединениях? Какие частицы участвуют в образовании связи? Как происходит стабилизация атома? (О ) Попросите учащихся объяснить обсуждаемые вопросы и оцените достоверность ответов учащихся. (У, К) Объясните учащимся особенности «правила октета». Попросите учащихся записать это правило в тетради. (О) (Г) Попросите учащихся составить схемы превращения атомов металлов и неметаллов в стабилизированные частицы. 11Na (металл натрий: 1s2 2s2 2p6 3s1) - e- = 11Na+ (ион натрия: 1s2 2s22p6 - октет) 9F(газ фтор: 1s2 2s2 2p5) + e- = 9F- (ион фтора: 1s2 2s22p6 - октет) (О ) (И) Попросите учащихся объяснить, последствия присоединения или отдачи электронов атомами. (К) Напомните учащимся, что Металлы — химические элементы, атомы которых способны отдавать электроны. Неметаллы — химические элементы, атомы которых могут принимать и отдавать электроны. (К) Попросите учащихся написать процесс отдачи и принятия электронов между атомом натрия и кислорода. Затем спросите, что произойдет, если взаимодействуют атомы двух неметаллов? Например, между атомом серы и кислорода (У) Введите понятие электроотрицательности (ЭО), как способности атома притягивать к себе валентные электроны от других атомов. Можно предложить задание высокого порядка: Составить формулы высшего оксида и гидроксида элемента по электронной формуле 1s22s22p63s23p5 (У, К) Введите идею диаграммы «точек и крестов». Объясните особенность образования ковалентной неполярной, а затем полярной связи. (И) (О ) Приведите примеры множества формул веществ с данным типом связи и попросите их построить диаграммы «точек и крестов». Обратить внимание, что при образовании полярной связи общие электронные пары смещены к более электроотрицательному элементу. На основании диаграмм « точек и крестов» учащиеся должны составить структурные формулы соединений, опираясь на то, что количество ковалентных связей соответствует количеству общих электронных пар, образуемых атомами неметаллов. (К) Предложите учащимся нарисовать диаграмму «точек и крестов» для хлористого натрия. Предложите учащимся сопоставить механизм образования ионной и ковалентной связей (О) Попросите учащихся объяснить механизм образования ионной связи и привести свои примеры, постепенно усложняя их. | Убедитесь, что все учащиеся понимают, что завершенность или незавершенность внешних уровней атомов позволяет оценить многие химические свойства элементов. Не забудьте отметить, что только в одном случае завершенная оболочка может включать не 8, а 2 электрона. Благородный газ гелий (порядковый номер 2) имеет завершенную внешнюю оболочку из 2-х электронов (1s2). Используйте мини-маркерные доски, чтобы дать учащимся более сложные структуры. Используйте мини-маркерные доски, чтобы оценить уровень усвоения знаний учащихся. | Теоретическое объяснение «правила октета»: http://www.hemi.nsu.ru/ucheb126.htm Материал об ЭО: http://www.yaklass.ru/p/himija/8-9-klass/stroenie-veshchestva-18844/elektrootritcatelnost-khimicheskikh-elementov-18845/re-d48636e5-fc98-49bc-aa70-ca5a271dce44 Образование связей: https://www.youtube.com/watch?v=LkAykOv1foc Материал об ионной связи: http://www.alhimik.ru/stroenie/gl_7.html https://www.youtube.com/watch?v=zpaHPXVR8WU | |||||||||||||||||||||
| 9.1.4.8 объяснять образование металлической связи 9.1.4.9 сравнивать металлическую связь с ионной и ковалентной | (У, К) Опишите и покажите модели металлических структур. Напомните о движении свободных электронов. Обсудите характеристику свойств металлов относительно строения. (И) (О) Учащиеся строят сравнительную таблицу типов связей соединений и их характерных свойств. | Учащиеся должны прийти к выводу, что металлическая связь схожа с ионной и ковалентной связью, но в тоже время имеет существенные отличия. | Металлическая связь и её свойства: http://abouthist.net/mezhmolekulyarnoe-vzaimodejstvie/metallicheskaya-svyaz.html | |||||||||||||||||||||
| 9.1.4.10 знать типы кристаллических решеток (КР) 9.1.4.11 объяснять зависимость физических свойств веществ от типа кристаллической решетки | (У, К) (О) Повторите ионную связь. Объясните, как это приводит к образованию ионной решетки, демонстрируя на моделях. Убедитесь, что учащиеся понимают, что для ионного соединения применяется формула, которая представляет собой соотношение ионов в соединении. Объясните силу ионной связи и свойства соединения, которые вытекают из этого. (У, К) (Д или Э) Демонстрация №1 «Типы кристалличечских решеток» Объяснить, как ковалентные связи приводят к молекулярным строениям, и дискретным частицам (молекулам), и что формула является точным указателем количества атомов в молекуле. Применяйте модели для построения молекул. Обсудите специфичные свойства молекулярных соединений относительно строения. (У, К) Расскажите, что макромолекулярные структуры элементов, расположенных вблизи центра периодической таблицы, образуют много ковалентных соединений. Опишите и покажите модели макромолекулярных соединений (алмаз, графит). Обсудите характеристики свойств макромолекулярных соединений относительно строения. | Точка кипения и плавления, плотность, растворимость в воде, простые геометрические кристаллические формы и т.д Удостоверьтесь, что учащимся понятна тема ковалентная связь и сила ковалентной связи. Даже будет лучше, если учащиеся смогут построить сами. В этом месте следует подробно остановиться на аллотропных модификациях углерода. Кубическая и гексагональная плотная упаковка не требуется. Групповая работа с плакатами. | Видео-урок «Типы КР и свойства веществ»: https://www.youtube.com/watch?v=NpBpWmsJz_w Youtube 30.11.14 Кристаллические решетки · Кристаллические решетки tutoronline.ru/blog/... · Задания по теме "Периодическая система химических элементов Д.И.... multiurok.ru/files/zadaniia-po-... копия |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
Четверть | |||
|
А Растворение и растворы | |||
| Рекомендуемые предварительные знания | |||
| Простые химические реакции (7.2В) Растворы и растворимость (7.3C) Ряд активности металлов (8.2А ) Вода (8.4В) | |||
|
Контекст | |||
| В данном разделе рассматриваются такие вопросы, как способы выражения концентрации раствора, принцип растворимости веществ, процесс диссоциации в водных растворах. Все эти вопросы рассматриваются на основе состава и строения соединений. Данный раздел предшествует следующему разделу (9.2 В) «Неорганический анализ». | |||
|
Краткий обзор | |||
| Для развития идеи химии растворов в данном разделе используются предыдущие знания о молях и типах связей. Раздел начинается с разъяснения понятий «разбавленный и концентрированный раствор» и плавно переходит к понятию молярности, как способу выражения концентрации. Рассматривается растворимость веществ в данном растворителе, затем развивается очень важная идея диссоциации соединений при растворении в воде. Для подготовки к следующему разделу учащиеся учатся писать ионные уравнения. |
| Ссылка в предметн. программе | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения | |||
| 9. 3. 4 . 1 понимать термин «концентрация» раствора; 9. 3. 4 .2 вычислять молярную концентрацию растворенного вещества в растворе; | (К) Обсудите с учащимися, какой апельсиновый сок им нравится слабый или сильный. Объясните, что термины «слабый» и «сильный» применяются в химии для различных целей, и следует использовать термин «концентрированный и разбавленный раствор». (К) (О) Спросите учащихся, какие способы выражения количественного состава раствора они знают. Объясните термин «концентрация» и что лучше всего выражать состав раствора молярной концентрацией (моль/дм3). Дайте определение одно молярному раствору, как раствору, содержащему один моль вещества, растворенного 1 дм3 раствора. (Д) Продемонстрируйте растворение одного моль подходящего вещества в 1 дм3 воды. Продемонстрируйте, что конечный объем раствора не равен 1 дм3. (Г) (О) Попросите у учащихся рассчитать массу вещества, необходимого для приготовления 1 дм3 раствора. Закрепите это умение на примере других объемов и других концентраций. Покажите учащимся, как приготовить раствор с заданной молярной концентрацией. В ходе выполнения химического эксперимента учащиеся самостоятельно готовят растворы с разной молярной концентрацией. (Э) Предложите учащимся выполнить практическую работу № 2 «Приготовление растворов с заданной молярной концентрацией». Предложите учащимся приготовить 0.1М раствор сульфата меди () объёмом 0.5 мл. Или 0.5 М раствор хлорида натрия объёмом 0.2 мл | Вспомнить с учащимися различные способы выражения концентраций. Учитель может включить расчетные задачи на смешивание, разбавление концентрирование растворов с использованием, как массовой доли растворенного вещества, так и молярной концентрации растворов. Можно также использовать задания, где необходимо осуществить перевод одного способа выражения концентрации в другой. В расчетах можно использовать правило «креста». Важно также использовать задачи на кристаллогидраты: нахождение количества воды, металла, формулы кристаллогидрата. Предложите учащимся для закрепления пройденного материала комбинированные задачи с использованием уравнений реакций с участием растворов веществ различной молярной концентрации раствора и разной массовой доли растворенного вещества. рактическая работа может быть выделена как в отдельный урок, так и выполняться в течении всего урока. (ТБ) Можно предложить учащимся приготовить два раствора, можно предложить разделить класс на две группы и предложить каждой группе приготовить разные растворы. Можно также выполнить работу в парах, но лучше, что бы каждый ученик выполнил её индивидуально. Так же предложите учащимся приготовить раствор используя твёрдые соли. (ТБ). Старайтесь избегать задания, на приготовления растворов кислот и щелочей. | Определение концентрации растворов: http://www.hometrainingtools.com/making-chemical-solutions-science-teaching-tip/a/1102/ интерактивные ресурсы: http://www.wellesley.edu/Biology/Concepts/Html/molarsolutions.html Алгоритм приготовления определённого объёма раствора с заданной молярной концентрацией: http://xn--i1abbnckbmcl9fb.xn--p1ai/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/509225/ Алгоритм приготовления определённого объёма раствора с заданной молярной концентрацией: http://xn--i1abbnckbmcl9fb.xn--p1ai/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/509225/ Электронные весы, мерные колбы, цилиндры, химический стакан, стеклянные палочки, воронки, пипетки, пробирки. Реактивы: хлорид натрия, медный купорос, вода. | ||||
|
| 9. 3. 4 .3 понимать принцип растворимости веществ в различных растворителях; | (Э) Демонстрация № 3 «Растворимость веществ в полярных и неполярных растворителях». Разрешите Покажите учащимся эксперимент по изучению растворимости различных соединений в разных растворителях. Попросите их использовать полученные результаты для формулирования принципа растворимости: «Подобное растворяется в подобном». | Покажите учащимся несколько опытов. Учащиеся должны увидеть, что ионные соединения растворяются в воде, необходимо понимать, что некоторые соединения и элементы частично или полностью не растворяются. Необходимо объяснить что, при попадании какого-либо вещества в воду оно может: а) раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне; б) вступить с водой в химическую реакцию; в) не раствориться и не прореагировать. (ТБ) Очень важно, чтобы учащиеся видели органические соединения, растворяющиеся в органических растворителях. Многие из них являются токсичными и легко воспламеняются, выбор подходящего соединения должен проходить с особой осторожностью. (ТБ) Необходимо защищать глаза. | Влияние некоторых факторов на растворимость веществ: https://www.calc.ru/Zavisimost-Rastvorimosti-Ot-Prirody-Rastvoritelya-Temperatur.html http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_6-1.html | |||
| 9.3.4.4 классифицировать вещества на электролиты и неэлектролиты, слабые и сильные электролиты 9. 3. 4 .5 понимать роль воды в процессе диссоциации; 9. 3. 4 .6 объяснять механизм электролитической диссоциации веществ с ионным и ковалентным полярным видами связи; | (Э) Предложите учащимся провести лабораторную работу № 7 «Электролиты и неэлектролиты» и занести полученные результаты в таблицу
(К, О) Предложите учащимся привести свои примеры электролитов и не электролитов дополнив таблицу и и пояснить ответы.
(К) Напомните учащимся о необычных свойствах воды (раздел 8.4 С). Объясните, что при растворении ионных соединений в воде, они распадаются на ионы. Это происходит, потому что вода помогает протекать данному процессу. Рассмотрите пространственное (дипольное) строение молекулы воды, валентный угол, наличие не поделенной пары электронов.
(У, К) Дайте учащимися понятия: диссоциация, степень диссоциации, электролиты и неэлектролиты, слабые и сильные электролиты опираясь на результаты эксперимента по изучению электропроводности веществ и их растворов. При рассмотрении механизма электролитической диссоциации соединений с ионной связью обратите внимание учащихся на образование гидратированных ионов, что их не | Не останавливайтесь подробно на химии водородных соединений и устойчивости к растворимости ионов: эти темы рассматриваются в высшей школе. Для дополнительных уроков, можете подробно рассмотреть тему электролит. Используйте проблемные вопросы и задания для глубокого понимания учащимися механизма электролитической диссоциации: Почему молекулы воды, а именно атом кислорода, в данном процессе не может быть акцептором электронов? В какихВ каких случаях он может быть акцептором? Может ли образоваться ион Н4О2+? Поясните свой ответ. При рассмотрении механизма электролитической диссоциации соединений с ионной связью обратите внимание учащихся на образование гидратированных ионов, что их не показывают в уравнениях диссоциации. | Электролитическая диссоциация: http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_6-3.html | ||||
| 9.3.4.7 знать вещества, ионизация которых приводит к образованию H+(водн) и OH-(водн) ионов; 9.3.4.8 понимать кислотность, как присутствие в водном растворе ионов H+(водн); 9.3.4.9 понимать основность, как присутствие в водном растворе ионов OH-(водн); 9.3.4.11 определять среду раствора по значению рН; | (Э) Предложите учащимся провести Лабораторную работу №8 «Определение среды растворов по значению рН». Предложите учащимся определить рН дистиллированной воды, раствора сильной сильной и слабой кислоты, сильного и слабого основания. Пусть учащиеся составят «свою» шкалу рН и сравнят её с табличными данными. Попросите сделать вывод, как применяя шкалу рН можно определить среду раствора и его силу. (К, И) Перейдите к кислотам и щелочам, и Напишите уравнение диссоциации их в воде. Спросите учащихся, что общего в растворах имеют все кислоты - электролиты, а также все щелочи - электролиты? Учащиеся самостоятельно должны сделать вывод о том, что общие свойства кислот обусловлены ионами H+(водн) или Н3О+ , а общие свойства щелочей ионами OH-(водн). Следует повторить химические свойства основных классов неорганических соединений, при этом использовать полученные знания об электролитах и не электролитах и обратить внимание на правильное написание как молекулярных, так и ионных уравнений реакций. | Опираясь на знания, полученные в 7-8 классах, необходимо углубить понятие рН растворов и шкалы рН, опираясь на значение водородного показателя в практической деятельности человека. Можно ввести формулу рН, но не для расчетов, а для того, чтобы учащиеся поняли взаимосвязь рН и концентраций ионов водорода и гидроксид-ионов. Также можно ввести формулу рН +рОН=14. Учащиеся должны уметь писать уравнения ступенчатой диссоциации многоосновных кислот, обращать внимание на анионы кислотных остатков (SO42-, HSO4-, CO32-, HCO3 -, PO43-, HPO42-, H2PO4 -) | Презентация по химии на тему: «Водородный показатель» http://rushkolnik.ru/docs/51/index-1412797.html Ионное произведение воды. Водородный показатель: http://him.1september.ru/article.php?ID=201000308 | ||||
|
| 9. 3. 4 .12 понимать значение «сила электролита » и отличать его от понятия «концентрация»; | (К) Предложите учащимся задания на классификацию веществ по силе электролита (сильные, слабые, при этом необходимо ввести понятие о степени диссоциации), особенно обратить внимание на сильные и слабые кислоты и основания. Они должны четко знать и уметь объяснять причину различной силы электролитов, используя знания о строении веществ, видах связи. Затем предложить учащимся пояснить, чем отличаются концентрированные растворы от разбавленных. | Следует избегать решения любых задач, связанных с нахождением константы диссоциации. Учащиеся должны пользоваться только готовыми данными и делать выводы. | Сильные и слабые электролиты: http://him.1september.ru/article.php?ID=200502002 Степень диссоциации. http://him.1september.ru/article.php?ID=200303504 Концентрация: http://him.1september.ru/article.php?ID=200502203 | |||
| 9. 3. 4 .10 уметь составлять уравнения реакций в ионном виде | Г или. И). Попросите учащихся написать сбалансированное уравнение любой реакции обмена. Спросите их, что происходит с соединением - электролитом, когда оно растворяется в воде. Они должны написать полное ионное уравнение, которое показывает, как образуются ионы при диссоциации электролитов в воде. Затем попросите их упростить уравнение путем передвижения «видимых» ионов (тех, которые останутся неизмененными на другой стороне уравнения), то есть составить сокращенное ионное уравнение реакции. (Э) Практическая работа № 3. «Реакции обмена между растворами электролитов». Учащиеся на практике проводят реакцию между парой растворов и записывают для данного взаимодействия полные и сокращенные ионные уравнения. Сделайте вместе с учащимися вывод о том, в каких случаях реакции ионного обмена идут до конца: образование осадка или малорастворимого соединения выделение газа образование образование слабого электролита, например воды. (У) Объяснить учащимся, что сокращенные ионные уравнения реакций выражают сущность реакций ионного обмена, так как в нем находятся только те ионы и молекулы, взаимодействие которых приводит к протеканию реакции до конца. | На этой стадии символы ( (тв), (ж), (г), (водн) должны быть введены как вспомогательные, в процессе определения «видимых» ионов. Учащиеся должны быть полностью вовлечены в процесс составления молекулярных и ионных уравнений реакций. Подготовьте карточки на которых представлены сокращенные уравнения реакций. Учащиеся должны уметь подбирать молекулярные уравнения к имеющимся ионным. | Видео ионных уравнений: http://www.youtube.com/watch?v=BQFykq21T0E | ||||
| 9.3.4.1 3 определять среду растворов и составлять уравнения реакции гидролиза солей; | (К) Поставить перед учащимися проблемную ситуацию в виде экспериментальной задачи: даны растворы трех веществ Na2CO3, HCl, NaOH, как экспериментально их различить с помощью индикатора? (Э) Для решения проблемной ситуации предложите учащимся выполнить лабораторную работу № 9 «Гидролиз солей» Предоставьте учащимся растворы солей: KCl, CuSO4, AlCl3,Na2SO4, Na2CO3, BaCl2,K2SiO3,NaNO3,Na2S . Попросите определить среду их растворов и самостоятельно попытаться найти закономерность в полученных результатах. Учащиеся должны сделать вывод: щелочную среду показывают растворы не только щелочей, но и некоторых солей. Такой же вывод делают и в отношении кислой среды растворов. (У) Дайте определение понятия «гидролиз», а также алгоритм составления уравнений гидролиза солей. (О) (К, И) используйте карточки для повторения и закрепления данных заданий. | Обратить внимание учащихся на то, что по составу соли можно разделить на 4 группы. Необходимо учащимся знать все сильные кислоты и основания и при написании уравнений гидролиза четко определять, каким основание и какой кислотой образована данная соль. Работая сРаботая с таблицей растворимости, ученики должны понимать, почему напротив некоторых солей есть прочерк. Это соли, которые полностью подвергаются гидролизу. Предложить задания: гидролиз каких солей происходит по следующей схеме? а) Е2- + Н2О→НЕ- + ОН- в) Х3+ + Н2О→ХОН2+ + Н+ Свой ответ подтвердите ионными и молекулярными уравнениями гидролиза | Гидролиз солей https://rutube.ru/video/a9f9158d39491b47f10ddaa835c8eef8/ Составление уравнений гидролиза солей: http://him.1september.ru/article.php?ID=200404102 http://him.1september.ru/article.php?ID=200501003 | ||||
| 9 . 2.3.2 производить вычисления по химическим уравнениям, если одно из исходных веществ дано в избытке; | (К) Повторите с учащимися алгоритм решения задач по уравнениям реакций. Предложите решить задачу на вычисление массы продукта реакции по известной массе одного из реагентов участвующих в реакции. (К) Далее поставьте перед учащимися проблемный вопрос: «Как вычислить массу продукта реакции по известной массе всех реагентов и выслушайте их ответы?». Или предложите учащимся решить задачу на вычисления продукта реакции, если известны массы реагентов. (У) Объясните алгоритм решения задач на «избыток-недостаток» и разберите с учащимися решение одной задачи в качестве примера. (Г) Предложите учащимся в группах решить задачи применяя алгоритм решения. (О) Для проверки усвоения алгоритма решения задач предложите каждому ученику задачу для самостоятельного решения. | Задачи необходимо решать через применение понятия «количество вещества». Успешным учащимся можно предложить вариант, когда оба вступивших в реакцию вещества даны в стехиометрических количествах, т. е. реагируют друг с другом без остатка. Кроме того, подбирая задачи для решения в классе необходимо помнить, что в некоторых случаях (например, если кислота или кислотный оксид дан в избытке) решение задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать дальше с образованием кислой соли. Это повысит сложность материала. | Алгоритм решения задач. http://him.1september.ru/2003/44/25.htm Закрепление алгоритма решения задач. http://him.1september.ru/article.php?ID=200400109 Задачи для самостоятельного решения. http://him.1september.ru/article.php?ID=200401106 |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
В Неорганический анализ | |||
| Рекомендуемые предварительные знания Простые химические реакции (7.2В) Химическая активность металлов (8.1B) Ряд активности металлов (8.2А) Вода (8.4В) | |||
|
Контекст | |||
| Данный раздел объединяет различные качественные реакции на вещества (ионы), изученные ранее, и расширяет знания и практические навыки учащихся в определении веществ. В данном разделе повторяется и изучается широкий спектр основных понятий химии. Рекомендуется посетить рабочую аналитическую лабораторию (например, в университете или на предприятии по водоснабжению). | |||
|
Краткий обзор | |||
| В данном разделе повторяются тесты на водород, кислород, двуокись углерода и воду, которые изучены ранее. Данный раздел обучает учащихся выполнять простые реакции окрашивания пламени ионами металлов и реакции на анионы (галиды, сульфаты, нитраты) и вводиться идея систематического анализа. |
| Ссылка в предметн. программе | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения |
| 9.4.1.8 знать и применять качественные реакции на водород, кислород, диоксид углерода, воду; | (К, Д, Э) (О) Повторите с учащимися определение водорода, кислорода, диоксида углерода и воды. через проведение лабораторной работы № 9 «Качественные реакции на определение водорода, кислорода, диоксида углерода и воды». При выполнении данного задания учащиеся должны: - выявить потенциальные риски, чтобы безопасно работать с необходимыми химическими оборудованиями и соединениями; - принять решение об оборудовании, которое должно быть использовано в исследовании; - проводить наблюдения, используя все органы чувств и соответствующее оборудование; - выбрать подходящий метод для отображения результатов; - написать простой отчет об эксперименте, включая метод, оборудование, результаты и заключение; | Желательно что бы каждый учащийся выполнял качественные реакции самостоятельно. | Гранулированный цинк, раствор хлороводородной кислоты, натрий, фенолфталеиновый, кристаллизатор с водой. Лабораторное оборудование для получения газов. https://www.youtube.com/watch?v=_x0dzQ8FpWw https://www.youtube.com/watch?v=95R37hF-eyU Теоретический материал по теме: http://chem100.ru/elem.php?n=1 Раствор пероксида водорода, оксид марганца (IV), перманганат калия, оборудование для нагревания, лучинки Получение О2 из КMnO4 https://www.youtube.com/watch?v=m_4hLiJso-Y https://www.youtube.com/watch?v=XUljKiZycZA | |
| 9.4.1.9 определять катионы металлов по окрашиванию пламени: Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Cu2+; | (У, К, Д) Дать учащимся информацию о том, что в основу определения соединений положены реакции определения составных частей соединений, чаще – ионов. Реакции на ионы (называемые качественными) можно проводить в растворе. Но один из способов анализа «сухим методом» - это окрашивание пламени летучими соединениями элемента. По цвету пламени судят о содержании того или иного элемента в веществе. (У) Обсудить тему окрашенного пламени (можно упомянуть натриевое уличное освещение). Продемонстрируйте тест на окрашивание пламени, используя соединение натрия. (Э) Разрешите учащимся протестировать несколько растворов металлов для определения, какой из них дает характерный цвет пламени (литий, натрий, калий, рубидий, кальций, стронций, барий и медь, вероятно, покажут хорошие результаты) (Э) (О) Далее для закрепления знаний учащиеся определяют несколько незнакомых растворов Для закрепления предложите задания, в которых необходимо определить соединения по окрашиванию цвета пламени. | Дискуссия с учащимися, возможно с применением электронных досок и т.д. (ТБ) Известковая вода не опасна, но учащимся следует защищать глаза от попадания брызг (ТБ) Хлористый кобальт токсичен. Необходимо применять меры предосторожности, когда работаете с бумагой из хлористого кобальта. Очень интенсивный цвет; обычно проявляется во всем (пример, водопроводная вода). (ТБ) Проволоки, используемые в реакции, необходимо чистить, чтобы убрать остатки натрия и т.д. Отлично подходит концентрированная соляная кислота (для учащихся можно использовать разбавленный раствор). Если используется концентрированная кислота, проволоку необходимо принести учителю для очищения. Необходимо защищать глаза. Концентрированные растворы или твердые соединения необходимо использовать для теста - запомните, что некоторые из них вредные для окружающей среды. | Полезная информация на сайте: http://www.chemguide.co.uk/inorganic/group1/flametests.html Проба на окрашивание пламени: https://elementy.ru/trefil/36/Proba_na_okrashivanie_plameni | |
| знать качественные реакции на определение катионов NH4+,Ca2+, Аl3+, Zn2+, Mg2+ Cr3+ Ba2+, Cu2+, Fe2+, Fe3 9.4.1.11 знать качественные реакции на хлорид-, бромид-, йодид-, сульфат-, карбонат-, фосфат-, нитрат-, силикат- ионы; 9.4.1.12 составлять план эксперимента по определению катионов и анионов и осуществлять его на практике; 9.4.1.13 составлять план эксперимента по определению состава незнакомого вещества и осуществлять его на практике; | Д, Э) Предоставьте учащимся всё необходимое оборудование и реактивы и разрешите им провести качественные реакции на катионы предложенные в лабораторной работе № 10 «Качественные реакции на катионы» Д, Э) Провести тест на хлорид-ион. Опишите тесты на бромид и йодид, и разрешите учащимся провести эти реак(Д, Э) Провести тест на сульфаты, используя раствор хлористого бария и раствор соляной кислоты, на нитраты, используя гидроксид натрия и алюминиевый порошок или сплав Деварда. Для определения нитратов можно использовать индикаторную бумагу. Провести простой тест на карбонаты. Разрешить учащимся провести тест самим (Д, Э) Предоставьте учащимся всё необходимое оборудование и реактивы и разрешите им провести качественные реакции на анионы предложенные в лабораторной работе № 11 «Качественные реакции на анионы». КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ (Э) Предложите учащимся комбинированные задания на распознавание веществ при выполнении практической работы № 4 «Качественный анализ неизвестного вещества» Задача 1. Элементы А и В принадлежат к 1 группе, а элемент С к 7 группе. Соединение элементов А и С растворимо в воде и окрашивает пламя в фиолетовый цвет, а соединение В и С имеет белую окраску и нерастворимо ни в воде, ни в кислотах, что представляют собой элементы? Задача 2Задача 2. На соединение А подействовали серной кислотой, при этом выделился бесцветный газ Б с резким запахом. Газ Б пропустили через окрашенный водный раствор простого жидкого соединения В. Окраска раствора при этом исчезла. При добавлении к полученному раствору соли бария выпадает белый осадок, нерастворимый в кислотах. При пропускании же через полученный бесцветный раствор желто-зеленого газа Г вновь появляется окраска и образуется соединение В. Соединение А окрашивает пламя в желтый цвет. Расшифруйте соединения и напишите уравнения соответствующих реакций. Задача 3. Даны три соли. Первая соль окрашивает пламя в фиолетовый, вторая - в желтый цвет. Раствор третьей соли образует белый осадок с раствором первой соли, желтый осадок с раствором второй соли и белый творожистый осадок с раствором нитрата серебра. Назовите заданные соли, ответ подтвердите соответствующими уравнениями реакций. | При записи наблюдений необходимо учить учащихся правильно использовать буклет выдаваемый на внешнем суммммативном оценивани для качественного анализа. Можно предложить учащимся реактивы в склянках, исследуемые катионы в пробирках. Учащиеся самостоятельно должны спланировать свое исследование, составить таблицу, записать уравнения реакций в молекулярной и ионной форме. . Выпавший в осадок цвет поможет определить галид-ион. Разбавленный раствор аммиака используется для дальнейшего подтверждения. Учащиеся могут писать уравнения для этих реакции. (ТБ) Аммиак является токсичным и раздражающим. Нельзя использовать концентрации более 0,5 М. Комната должна проветриваться. Учащиеся должны защищать глаза от попадания аммиака. (ТБ) Нитрат серебра токсичен, но в данном эксперименте применяется 0,05 М раствора, который является менее опасным. (ТБ) Хлористый барий опасен: используйте 0,1 М раствор, и надевайте очки для защиты. | Качественные реакции на катионы: https://www.slideshare.net/vruseva/ss-49473748 Полезная презентация PowerPoint: http://www.slideshare.net/sitinurbaiyah/ppt2-tests-for-anions Полезные сведения по основным тестам: school-sector.relarn.ru/nsm/chemistry/Rus/Data/tab/tab10.html | |
|
| 9.4.1.15 | (К, Г) (О) Обсудить с учащимися, как эти тесты могут применяться для идентификации незнакомых соединений. Попросите предложить способ, который поможет им в определении незнакомого соединения. Вместе с учащимися разбираем алгоритм определения неизвестных соединений на основании качественных реакций. Рекомендации по ходу определения: 1. Запишите формулы всех соединений, о которых идет речь в задаче, а под ними название класса, к которому принадлежит соединение. 2. Вспомните химические свойства соединений данных классов, а также их качественные реакции. 3. Определите, какие реактивы нужно использовать, чтобы различить соединения, относящиеся к этим классам соединений. 4. По каким признакам можно различить соединения, данные в задаче, при использовании этих реактивов. 5. Проведите необходимые реакции. 6. Запишите свои наблюдения в таблицу. Далее учащиеся, опираясь на эти рекомендации, решают экспериментальные задачи на распознавание неорганических соединений Используя метод «обнаружение», попросите учащихся, работая в паре, определить незнакомое соединение, тщательно фиксируя результаты, полученные из тестов. (Г) (О) Попросите учащихся представить результаты всему классу, обоснованно мотивируя причины принятых решений. Для закрепления учащиеся выполняют | Можно предложить учащимся составить теоретическую и практическую матрицу, сравнивая полученные результаты, учащиеся, определяют неизвестные соединения. По усмотрению учителя можно использовать другие реактивы, предварительно практически проверив их решение. Учитель может организовать конкурс сочинений-эссе, отметив наиболее интересные и самостоятельные. | chem21.info/info/1900450/ |
| 9.4.1.14 знать, что существуют современные инструментальные методы для определения веществ (хроматография, масс-спектрометрия, ИК-спектроскопия); 9.4.1.15 знать и понимать применение хроматографии в разделении цветных пигментов; | (У, К) Объясните учащимся, что в современных лабораториях неорганический анализ тщательно проводится при помощи инструментов. Если возможно, посетите аналитическую лабораторию университета. Вместе с учащимися выяснить, что означает «хроматография». Обратить внимание на то, что принципиальным отличием хроматографических методов от других физико-химических методов анализа является возможность разделения близких по свойствам соединений. После разделения компоненты анализируемой смеси можно идентифицировать (установить природу) и количественно определять (массу, концентрацию) любыми химическими, физическими и физико-химическими методами. Для закрепления учащиеся выполняют эксперимент «Разделение пигментов хроматографическим методом» | В качестве домашнего задания можно учащимся предложить написать эссе об инструментальных методах для определения соединений (ученик может выбрать один из методов, который для него наиболее интересен и понятен и раскрыть сущность метода и его практическое применение). Критерии оценивания учитель предварительно разрабатывает совместно с учащимися (учитывается самостоятельность, научность, грамотность и доступность изложения, использование интересных фактов и аргументированность) Учитель может организовать конкурс сочинений-эссе, отметив наиболее интересные и самостоятельные. | Список инструментальных подходов: http://en.wikipedia.org/wiki/Analytical_chemistry#Instrumental_methods Бумажная хроматография - https://www.youtube.com/watch?v=Sl8TOBKVF1g www.xumuk.ru/encyklopedia/648.html Разделение пигментов листа хроматографическим методом по ... chem21.info/info/1900450/ |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
Четверть | |||
|
A Металлы и сплавы | |||
| Рекомендуемые предварительные знания | |||
| 7.2В Простые химические реакции 8.1В Химическая активность металлов 8.2А Ряд активности металлов | |||
|
Контекст | |||
| В данном разделе изучаются особенности строения металлов, физические и химические свойства типичных металлов. Учащиеся делают вывод о преимущества сплавов, обобщают информацию о применении металлов и сплавов в Казахстане. В контексте изучения применения сплавов учащиеся решают задачи на вычисление массы вещества, содержащего примеси. | |||
|
Контекст | |||
| С данного раздела начинается изучение групп химических элементов. Химические свойстваэлементов и их соединений изучаются на основании строения атома и закономерностей изменения свойств в периодической таблице. Учащиеся будут прогнозировать свойства малознакомых металлов. | |||
|
Краткий обзор | |||
| В данном разделе делается акцент на применении предыдущих знаний для прогнозирования свойств менее знакомых элементов. Учащиеся применяют знание общих физических и химических свойств металлов для изучения свойств металлов 1, 2, 13 групп. Учащиеся обобщают закономерности изменения свойств металлов и их соединений сверху вниз в группах и объясняют их с точки зрения строения атома. |
| Ссылка в предметн. программе | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения |
| 9.2.1.5 знать химические свойства металлов 1-ой группы: взаимодействие Li, Na, K с кислородом воздуха, хлором и водой; | (Д) Отрежьте по кусочку различных щелочных металлов. Обратите внимание на условия их хранения. (К) (О) Попросите учащихся вспомнить общие физические свойства металлов, а затем обсудите физические свойства щелочных металлов: пластичные, легко режутся ножом и т. д. Спросите у учащихся: – Какова причина сходства физических свойств щелочных металлов с другими металлами? – Почему щелочные металлы хранят под слоем керосина? – Почему на срезе щелочные металлы серебристо-белые, а на поверхности тусклые? (Д) Покажите учащимся видео горения щелочных металлов на воздухе. (К) Попросите учащихся сравнить, насколько энергично протекают реакции горения различных щелочных металлов и указать цвет пламени. (Д) Проведите реакцию взаимодействия каждого металла с водой: отметьте, насколько энергично протекают эти реакции. Добавьте несколько капель фенолфталеина, чтобы доказать образование щелочи в растворе. (И) (О) Предложите учащимся составить уравнения реакций взаимодействия щелочных металлов с кислородом и водой, указать процессы окисления и восстановления, окислитель и восстановитель, расставить коэффициенты методом электронного баланса. Попросите учащихся записать в тетрадь, что при горении только литий образует оксид, остальные щелочные металлы образуют пероксиды. (Д) Покажите видео взаимодействия щелочного металла с хлором/другими неметаллами. | Очень удобно по мере изучения данного раздела заполнять сравнительную таблицу «Металлы 1, 2, 13 группы». (ТБ) Будьте осторожны при работе со щелочными металлами.Образцы должны быть маленькими (половина горошины).. Эксперимент необходимо проводить очень осторожно в защитных очках. Лабораторию необходимо хорошо проветривать. (ТБ) | Щелочные металлы. http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch2_8-2.html Учебный фильм https://www.youtube.com/watch?v=Q5YnJg_zlq4 https://www.youtube.com/watch?v=FiMGWYWYwgE Самые опасные щелочные металлы в мире https://www.youtube.com/watch?v=_JzTjsMKv_A Видео взаимодействия хлора с калием: https://www.youtube.com/watch?v=TIb4RzPs42A | |
| 9.2.1.8 прогнозировать свойства неизученных элементов 1, 2 группы | (Г) Учащиеся заполняют информацию о щелочных металлах на примере натрия в сравнительной таблице «Металлы 1, 2, 13 группы»: – положение в таблице – строение атома – тип химической связи, – тип кристаллической решётки – физические свойства – условия хранения – химические свойства элемента – свойства соединений (основные, кислотные или амфотерные) (К) Обсудите с учащимися, какие закономерности изменения свойств можно наблюдать в семействе щелочных металлов. Какова причина сходства физических и химических свойств элементов одной группы? (И) (О) Предложите учащимся дать характеристику рубидия по плану: 1. Положение элемента в периодической таблице. 2. Строение атома. 3. Свойства элемента 4. Свойства соединений. (К) (О) Подведите итог: каковы общие признаки семейства щелочных металлов. | На усмотрение учителя, постепенное заполнение сравнительной таблицы «Металлы 1, 2, 13 группы» можно давать учащимся как домашнее задание, проверка которого будет осуществляться на каждом уроке по мере изучения данного раздела. Покажите учащимся интерактивную периодическую таблицу, в которой они могут взять необходимую информацию при заполнении таблицы. | Примеры интерактивных периодических таблиц http://www.ptable.com/ или: http://www.rsc.org/periodic-table/ http://periodictable.com/ Видео периодической таблицы Университета Ноттингема: http://www.periodicvideos.com/ | |
| 9.2.1.6 знать химические свойства металлов 2 группы: горение магния, кальция на воздухе, взаимодействие их с неметаллами, водой, разбавленными кислотами; 9.2.1.7 знать химические свойства металлов 13-ой группы: взаимодействие алюминия с разбавленными кислотами и щелочами; 9.2.1.9 составлять уравнения химических реакций элементов 1, 2 и 13 групп и их соединений методом электронного баланса; | (У) Учитель вводит понятие «семейство щелочно-земельных металлов». (Д) Покажите видео взаимодействия кальция и алюминия с кислородом воздуха. (Д) Покажите видео о повышении реакционной способности алюминия после применения хлорида ртути (ІІ), взаимодействие амальгамированного алюминия с водой. (Д) Для демонстрации активности алюминия может быть показана термитная реакция. (Г) (О) Учащиеся продолжают вносить информацию на примере кальция/магния и алюминия в сравнительную таблицу «Металлы 1, 2, 13 группы»: – положение в таблице – строение атома – тип химической связи, – тип кристаллической решётки – физические свойства – условия хранения – химические свойства элемента – характер соединений (К) (О) По результатам заполнения сравнительной таблицы сделайте выводы: – каковы закономерности изменения свойств элементов 2 группы? – каковы закономерности изменения свойств элементов 13 группы? – каковы причины сходства и различия металлов 1, 2, 13 групп? (Г) (О) Подведите итог: каковы закономерности в изменении металлических, основных свойств в группе, в периоде. (Э) Учащиеся выполняют эксперимент: а) взаимодействие кальция с водой, с раствором кислоты; б) взаимодействие магния с холодной и горячей водой, с раствором кислоты; в) взаимодействие алюминиевой фольги с раствором кислоты и щелочи; Попросите учащихся сравнить результаты эксперимента с результатами подобных экспериментов со щелочными металлами, составить уравнения реакций, указать процессы окисления и восстановления, окислитель и восстановитель, расставить коэффициенты методом электронного баланса (И) (О) Предложите учащимся составить уравнения реакций взаимодействия различных щелочных металлов с хлором, указать окислитель и восстановитель, процессы окисления и восстановления. (О) Предложите учащимся задания типа: – С какими из перечисленных веществ будет реагировать литий/натрий/калий? – цепочки превращений – найти соответствие реагенты – продукты | (ТБ) При работе с растворами кислот необходимо соблюдать правила техники безопасности, использовать защитные очки. (ТБ) Предупредите учащихся, что при взаимодействии кальция с водой, магния с кислотой выделяется тепло, поэтому нельзя трогать пробирку руками некоторое время после реакции. Необходимо использовать термостойкую пробирку, надевать защитные очки. Можно предложить учащимся исследовать взаимодействие кальция с соляной и серной кислотами. Учащиеся должны прийти к выводу, что образование нерастворимого сульфата кальция препятствует протеканию реакции кальция с серной кислотой. Учащиеся могут решить, что алюминий инертный: обсудите способы удаления оксидной плёнки. (ТБ) Необходимо очень осторожно проводить термитную реакцию. На видео (ссылка справа) подробно описан процесс и меры предосторожности, которые необходимо соблюдать. | Свойства щелочноземельных металлов http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch2_8-3.html Видеоурок https://www.youtube.com/watch?v=eiunukURN5g Взаимодействие алюминия со щелочью https://www.youtube.com/watch?v=32g_fCpC5VE Окисление алюминия кислородом воздуха https://www.youtube.com/watch?v=g6dhtqPLzYA Взаимодействие алюминия с водой https://www.youtube.com/watch?v=YQF0R6UNE1A Взаимодействие брома с алюминием https://www.youtube.com/watch?v=80kIaSSvAZ8 Горение алюминия на воздухе https://www.youtube.com/watch?v=JTZ3KzGxmNE Демонстрация оксидной пленки https://www.youtube.com/watch?v=iv68OYmAiwQ |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
Контекст | |||
| Предшествующие принципы и знания направлены в помощь ученикам в понимании и осмыслении химии. Учащиеся расширяют знания об аллотропии и аллотропных модификациях, развивают навык расстановки коэффициентов методом электронного баланса на примере уравнений, отражающих химические свойства неметаллов 16 и 17 групп, а также их соединений. Закрепляется навык определения окислителя и восстановителя, процессов окисления и восстановления. | |||
|
Контекст | |||
| В данном разделе учащиеся обобщают знания о факторах, влияющих на скорость химических реакций, объясняют их с точки зрения теории частиц, а также расширяют знания о влиянии давления на скорость химических реакций с участием газов. Учащиеся изучают гомогенный и гетерогенный катализ, планируют эксперимент с участием катализатора. Изучение данного раздела важно для последующего изучения промышленных процессов. | |||
|
Краткий обзор | |||
| Учащиеся определяют разницу между реагентами и катализаторами, исследуют каталитические реакции, объясняя механизм катализа с точки зрения теории частиц. Обсуждают действие ингибиторов. С точки зрения теории частиц определяют влияние изменения давления на скорость химических реакций с участием газов. . |
| Ссылка на предметную программу | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения |
| 9.3.2.1 отличать катализатор от реагентов; 9.3.2. 3 объяснять процесс катализа с точки зрения теории частиц; | (Д) Покажите видео а) горения водорода без участия катализатора, а затем с участием катализатора (каолиновой ваты) б) окисления аммиака с использованием платиновой проволоки (Э) Учащиеся исследуют а) влияние оксида меди (II) на термический распад хлората (V) калия (при наличии достаточного времени могут быть использованы другие катализаторы). б) эффект добавления нескольких капель раствора сульфата меди (II) на скорость выделения водорода, образующегося в результате реакции между цинком и разбавленной серной кислотой. (К) (Г) Попросите учащихся обсудить результаты данных экспериментов. Какой эффект оказало добавленное соединение? Является ли соединение реагентом? Почему нет? (У, К) Объясните, что вещества , которые увеличивают скорость реакции, но не входят в состав продуктов реакции (регенерируются без изменений в конце реакции) называют катализаторами. Объясните учащимся, что катализаторы, которые находятся в одной фазе с реагентами, называют «гомогенными катализаторами», а в разных фазах – «гетерогенные катализаторы». (К) Спросите учащихся: как доказать регенерацию катализатора после завершения реакции? (Э) Предложите учащимся взвесить некоторое количество оксида марганца (IV) и использовать его в качестве катализатора разложения раствора пероксида водорода. После завершения эксперимента необходимо высушить и заново взвесить оксид марганца (IV). Учащиеся приходят к выводу, что масса катализатора не меняется. (Г) Попросите учащихся объяснить действие катализатора, на основании знаний о скорости химической реакции. Гетерогенные катализаторы «удерживают» частицы реагента на своей поверхности, делая столкновения более легкими и частыми, таким образом, увеличивая скорость химической реакции. | Водород горит без источника зажигания (ТБ) Сульфат меди (II) токсичен. Необходимо надевать защитные очки и после эксперимента тщательно вымыть руки. (ТБ) При работе с пероксидом водорода необходимо надевать защитные очки. Учащиеся узнают, что добавленное соединение не является реагентом, и что оно не исчезает и не изменяется в результате реакции. В процессе обсуждения необходимо принять во внимание достоверность эксперимента, анализ результатов, правила безопасности и т.д. | Видео другой реакции «химического светофора»: http://www.youtube.com/watch?v=_YO4UPTjMVI Видео Реакция Бриггса-Раушера автоколебательная химическая реакция: http://www.youtube.com/watch?v=-RFb8T2ED5E&feature=related Видео реакция Белоусова-Жаботинского (комментарии на китайском): http://www.youtube.com/watch?v=tg9SRstGos4&feature=related Реакция «синей бутылки» (прим. перевод Химическая реакция, при которой бесцветный раствор в закрытой бутылке, содержащей немного воздуха, становится синим при встряхивании, и затем через некоторое время снова становится бесцветным): http://www.youtube.com/watch?v=a_4LUaaL6FU Полезная учебная информация (упоминает энергию активации): http://www.bbc.co.uk/schools/gcsebitesize/science/add_aqa_pre_2011/chemreac/ratesrev3.shtml | |
| 9.3.2. 4 планировать эксперимент с участием катализатора; | (И) (О) Попросите учащихся составить план эксперимента по исследованию действия различных катализаторов на скорость разложения пероксида водорода. (Э) Учащиеся должны проверить на практике предложенный ими эксперимент и поделиться результатами. (К, Г) Обсудите результаты с учащимися и сделайте вывод о наиболее эффективных катализаторах. | Предоставьте учащимся ряд соединений: растворимые и нерастворимые соединения переходных металлов, , соединения элементов главных подгрупп, картофель и морковь (содержащие фермент – каталазу), (ТБ) Необходимо тщательно выбирать соединения, представляющиеминимальную опасность. Учащиеся должны надевать защитные очки. | https://www.youtube.com/watch?v=kNj4mPeHuC8 Примеры экзаменационных вопросов: http://chemactive.com/worksheets/gcse/chemistry/rates_questions.pdf | |
| 9.3.2. 2 понимать действие ингибиторов; | (Г) Спросите у учащихся, существуют ли «отрицательные катализаторы», которые замедляют реакцию. Обсудите понятие «ингибиторы». Предложите учащимся назвать химические реакции, скорость протекания которых необходимо понижать. Вспомните эксперимент по исследованию факторов, влияющих на скорость коррозии железа, проведенный учащимися в 8 классе. В качестве ингибитора коррозии в этом эксперименте использовали щелочь. (Д) (О) Позвольте учащимся поразмышлять об изученном материале по теме «Катализ» с помощью демонстрации видео реакции «Химический светофор». Попросите учащихся объяснить наблюдаемый эксперимент. | Способные ученики могут объяснить действие катализатора и ингибитора с помощью понятия «энергия активации». Сегнетова соль окисляется пероксидом водорода в присутствии ионов кобальта (II). Для этого необходимо смешать горячие реагенты и добавить катализатор. В процессе реакции происходит изменение цвета: первоначальный розовый цвет становится темно-зелёным, а затем снова розовым. | Действие ингибиторов на скорость химической реакции https://www.youtube.com/watch?v=_7aNB80NqoE Инструкция по проведению реакции «Химический светофор»: http://www.rsc.org/Education/EiC/issues/2005July/Exhibitionchemistry.asp | |
| 9.3.2.5 объяснять влияние давления на скорость химических реакций с участием газов; 9.3.2.6 обобщить влияние различных факторов на скорость химической реакции; | (К, Г, И) (О) Повторите с учащимися теорию частиц, используя активные методы обучения. (К) Спросите учащихся о влиянии давления на газы. Газ имеет высокую сжимаемость – при увеличении давления возрастает его плотность (при повышении давления расстояние между молекулами газа уменьшается). Спросите учащихся, как это повлияет на количество столкновений? Как влияет давление на скорость реакции с участием газов? Спросите учащихся, будет ли заметно влияние давления на твердые тела и жидкости. (Г) Предложите учащимся перечислить факторы, влияющие на скорость химической реакции, и объяснить их влияние с точки зрения теории частиц. Учащиеся должны подготовить «ментальные карты»/ постеры, после чего представить информацию классу. (Э) Предложите учащимся эксперимент по исследованию влияния различных факторов на скорость химических реакций. (Г) или (И) Предложите учащимся задания на вычисление средней скорости химических реакций и по правилу Вант-Гоффа. | Могут применяться кроссворды, головоломки типа «найди слово», карточки «светофор», мини-доски и т.д. Для улучшения понимания влияния давления на скорость химических реакций с участием газов желательно использовать анимации. Рекомендуем практические работы из пособия IGCSE Chemistry Laboratory Practical Book, либо на усмотрение учителя выбрать более простой эксперимент. | Видеоуроки: https://www.youtube.com/watch?v=Esu8_gU_wBo Влияние температуры на скорость https://www.youtube.com/watch?v=68YhTDdZ-U8 |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
Четверть | ||||||||||||
Контекст | ||||||||||||
| Данный раздел кратко описывает кремний – один из самых важных элементов в современном мире. Он изучается с точки зрения положения в периодической таблице и строения атома. | ||||||||||||
|
Контекст | ||||||||||||
| В данном разделе учащиеся продолжают рассматривать химию биологических процессов, химический состав организма человека и воздействие некоторых токсичных веществ. Прослеживается взаимосвязь с биологией, в частности с понятием концентрация вредных веществ в пищевой цепи. | ||||||||||||
|
Цель обучения по предмету |
Цели обучения по языку |
Краткое изложение | ||||||||||
| Учащиеся рассматривают основные химические элементы, которые содержатся в организме человека, и их функции. Также в разделе рассматривается содержание и роль макро- и микроэлементов, тяжелых металлов и их влияние на организм человека. Планируется проведение учащимися исследования рациона питания жителей Казахстана и составление ими сбалансированного рациона питания. | ||||||||||||
| Ссылка на предметную программу |
Цели обучения |
Заметки учителя | Ресурсы обучения | |||||||||
| 9.5.1.1 знать функции элементов, входящих в состав организма человека (О, С, Н, N, Ca, P, K, S. Cl, Mg, Fe);
9.5.1.2 знать функции белков, жиров, углеводов и витаминов;
| (Г) Предоставьте учащимся список элементов, входящих в состав организма человека и их приблизительное процентное содержание. Попросите их составить диаграмму (К) Обсудите с учащимися , как необходимые человеку элементы поступают в организм, в какой форме эти вещества присутствуют в организме и, какую функцию они выполняют.
(Г)(О) Учащиеся составляют постеры, в которых необходимо отобразить информацию об элементах, входящих в состав организма и их функциях.
(Э)(Г/П) Для развития навыков исследовательской деятельности предложите учащимся выполнить эксперимент на определение кальция в составе костей. (Г)Учащиеся, основываясь на знания, полученные на уроках биологии, заполняют таблицы о функциях белков, жиров и углеводов. На основе текстового материала предложите учащимся заполнить таблицу «Витамины», в которой необходимо указать источники поступления, а также последствия гипо- и авитаминоза. (Э)Предложите учащимся выполнить эксперимент на определение углерода в пищевых продуктах. |
В качестве домашнего задания можно предложить учащимся составить кроссворд «Химические элементы в организме человека», предварительно обсудив критерии выполнения задания. | Элементы в составе организма: Composition_of_the_human_body http://en.wikipedia.org/wiki/ Видео-урок: Роль химических элементов в организме человека https://www.youtube.com/watch?v=hJUFNqP6tyQ Видео: Витамины https://www.youtube.com/watch?v=7fL7n9OWWik https://www.youtube.com/watch?v=_R1mv1EHwkI http://ximik.biz/prakticheskaya-himiya/101-produkty-soderzhashie-zeleso | |||||||||
| 9.5.1.3 объяснять значение макро- и микроэлементов для организма;
| (Г) Предоставьте учащимся возможность поиска информации о микро и макроэлементах в интернете. По результатам поиска, учащимся необходимо: - дать определение макро и микроэлементам; - перечислить макро и микроэлементы, необходимые для жизнедеятельности человека - указать роль в организме и источники их поступления. Учащимся рекомендуется оформить результаты в виде таблицы.
|
Учащиеся должны знать, что существуют предельно допустимые нормы и что их превышение может быть опасным.
Можно предложить учащимся выполнить эту работу по группам. Каждая группа составляет характеристику 3-4 элементов. | Таблица витаминов: http://www.brianmac.co.uk/minerals.htm Значение макро и микроэлементов http://us-in.net/m_elements_10.php Применение микро и макроэлементов http://www.eliti.ru/macro-micro-elements/ | |||||||||
| 9.5.1.4 описать типичный рацион питания жителей Казахстана и составлять сбалансированный рацион питания;
| (Г) Предложите учащимся описать суточный рацион питания их семьи и обсудить: - является ли рацион питания их семьи сбалансированным и рациональным; - насколько он типичен для жителей Казахстана.
Попросите всех учащихся объединиться в две группы: тех, кто считает, что типичный рацион питания жителей Казахстана является сбалансированным и рациональным в первую группу, тех, кто не согласен с ними - во вторую группу. Предоставьте учащимся ресурсы и время для подготовки к дискуссии, в которой они должны отстоять свое мнение, приведя необходимые аргументы. (И) Учащиеся составляют сбалансированный рацион питания в соответствии с возрастными особенностями, полом и видом деятельности.
|
На усмотрение учителя: включить рассмотрение вопроса о сбалансированном питании с учетом национальных, региональных, религиозных и климатических особенностей. Необходимо предоставить справочные данные о нормах содержания жиров, белков и углеводов в суточном рационе питания человека с учетом вида деятельности, пола и возраста.
| Суточный рацион питания: http://www.rusnauka.com/16_NPM_2007/Biologia/22105.doc.htm Сбалансированное питание http://vesvnorme.net/zdorovoe-pitanie/sbalansirovannoe-pitanie.html | |||||||||
| 9.5.1.5 объяснять влияние токсичных металлов на организм человека;
9.5.1.6 знать источники загрязнения токсичными металлами
| (К) Предоставьте учащимся материалы различного рода: статьи, видеоролики, статистические данные о токсичных металлах и их влиянии на организм человека. (Г, О) Подготовьте карточки с названиями токсичных металлов по одной на каждую пару или группу учащихся. Учащиеся выбирают по одной карточке и готовят мини сценку, в которой «загадывают» металл. Это может быть сценка посещение к врачу, где пациент называет симптомы болезни, а учащимся необходимо назвать металл, который вызвал отравление.
(Г) Попросите учащихся обсудить при помощи «мозгового штурма» идею, каким образом токсичные металлы поступают в организм человека. (К) Обсудите увеличивающиеся объемы загрязнения, вызванные развитием промышленности. Обобщите информацию о наиболее важных источниках загрязнения окружающей среды металлами. (Г) (О) Учащиеся готовят презентацию/постер о мероприятиях, которые могут сократить объем загрязнения окружающей среды токсичными металлами и предотвратить их попадание в организм человека. (У) Объясните учащимся, что лечение любого отравления сводится к удалению яда и нейтрализации последствий его воздействия на органы и ткани. Процесс обезвреживания токсинов и ускорения выведения из организма называется детоксикацией. | Предоставьте учащимся справочные данные о предельно допустимых концентрациях некоторых токсичных металлов.
Здесь может быть включены данные по Казахстану.
Рекомендуется предложить обсудить извлечение свинца из бензина, токсичных металлов из красок, аккумуляторов и т.д. Учащиеся объяснят значение вторичной переработки материалов (в особенности электронного оборудования) для предотвращения попадания токсичных металлов в окружающую среду.
| Материалы по токсичности металлов: https://studopedia.ru/3_93793_toksichnie-metalli.html Токсичность металлов. Материалы http://peer.tamu.edu/curriculum_modules/Properties/module_4/lesson3.htm Тяжелые металлы — загрязнители природной среды http://yznaika.com/notes/197 Загрязнение вод тяжелыми металлами http://helpiks.org/1-126951.html | |||||||||
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
|
C Радиохимия | |||
| Рекомендуемые предварительные знания | |||
| 7.4А Строение атома 8.1А Расположение электронов в атомах 9.1В Периодическая система химических элементов | |||
|
Контекст | |||
| Расширяются знания учащихся относительно ядра атома, обсуждаются тяжелые ядра и их неустойчивость. Следствием неустойчивости ядер является радиоактивный распад. Прослеживается связь с физикой. | |||
|
Краткое изложение | |||
| Раздел начинается с повторения краткого описания строения атома при помощи символов химических элементов и продолжается изучением радиоактивности. Рассматривается зависимость радиоактивности от состава атомных ядер. Учащиеся знакомятся с приборами, позволяющими доказать наличие радиации, моделируют радиоактивный распад. Ядерные реакции рассматриваются как источник энергии. Учащиеся рассматривают состояние и перспективы развития атомной промышленности Казахстана и оценивают преимущества и недостатки ядерной энергетики. |
| Ссылка на предметную программу | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения |
| 9.1.2.1 понимать, что с увеличением числа протонов, ядро становится менее стабильным; 9.1.2.2 знать природу и свойства радиоактивного излучения; | (И) (О) Повторите с учащимися краткое описание строения атома при помощи символов химических элементов с использованием мини-досок. (И) (Г) Попросите учащихся начертить протонно-нейтронную кривую для некоторых изотопов. (информацию предоставляет учитель) (У, К) Попросите учащихся отметить свинец на данной кривой. Используя периодическую таблицу, спросите их какие элементы расположены над свинцом. Объясните, учащимся, что ядра с зарядом больше чем 83 и массовым числом больше чем 209 нестабильны и имеют тенденцию распадаться. (У) Объясните (рассказав, по желанию, немного истории) природу альфа-, бета- и гамма- излучений; покажите, как изображаются альфа- и бета-частицы. (Д) Ознакомьте учащихся со свойствами альфа-, бета- и гамма- излучения, предложив просмотреть видеоролик./анимацию. (К, Г) (О) Учащиеся должны уметь использовать информацию из демонстрации видео/анимации для определения заряда и проникающей способности каждого вида излучения и объяснять последствия ралиоактивного распада (О) На основе материала из просмотренного видео учащиеся заполняют таблицу, в которой необходимо указать заряд и проникающую способность каждого вида излучения. | В целях экономии времени, учащиеся могут обозначать на кривой каждый 5-ый (или даже 10-ый) элемент. Для первых 20 элементов, которые они знают, кривая практически прямолинейная. Учащиеся могут отметить нейтронно-избыточные и протонно-избыточные участки на кривой, которую они начертили. Упомяните о необычной устойчивости ядра Pb-208, и что процесс радиоактивного распада прекращается при достижении этой структуры. Учащиеся могут получить информацию об истории открытия интересующих их радиоактивных частиц. | график протон-нейтронной кривой: http://www.physicsinfo.co.uk/?page=view&id=1309 Таблица изотопов http://nuclphys.sinp.msu.ru/radioactivity/ract01.htm Радиоактивность. История открытия: https://www.youtube.com/watch?v=czRNJihtf7w Radioactive Decay https://opentextbc.ca/chemistry/chapter/21-3-radioactive-decay/ | |
| 9.1.2.3 знать и понимать последствия радиоактивного распада; 9.1.2.4 понимать, что разложение ядра является самопроизвольным процессом; | Д) Познакомить учащихся со счётчиком Гейгера – прибором, который фиксирует уровень радиации. У, К) Предложите учащимся послушать работу счетчика Гейгера. Объясните учащимся понятие «фоновая радиация», а также то, что её значение должно быть вычтено из общих показаний радиоактивности. (К) Обсудите с учащимися: - что является причиной радиоактивного распада; - достаточно ли одного распада для удаления неустойчивости; - когда процесс радиоактивного распада прекращается? (Г или И) Попросите учащихся с помощью символов написать полные уравнения радиоактивного распада (на примере альфа- или бета-распада), уделяя внимание балансу фундаментальных частиц. На основании рассмотренных примеров учащиеся могут сформулировать правила смещения. (У) Покажите учащимся, как происходит цепочка распада атома до Pb-208, на примере одного элемента с зарядом атома больше чем 83. (И или Г) (О) Предоставьте учащимся цепочки радиоактивных распадов без некоторых промежуточных составляющих. Учащимся необходимо определить пропущенные элементы в цепочке и написать уравнения радиоактивного распада. | Добавьте информацию о тех регионах Казахстана, где фоновые уровни радиации высокие Достаточно трех цепочек естественного распада. | Видео: Работа счетчика Гейгера https://www.youtube.com/watch?v=-Od7HPfs2Jo Фоновая радиация https://www.liveinternet.ru/users/3844066/post131540167/ Виды распада https://fireman.club/presentations/ponyatie-radioaktivnosti-vidy-raspada/ Radioactive Decay https://opentextbc.ca/chemistry/chapter/21-3-radioactive-decay/ цепочки распадов http://profbeckman.narod.ru/YadFiz.files/L11.pdf | |
| 9.1.2.5 моделировать процесс радиоактивного распада; 9.1.2.6 понимать смысл термина «период полураспада»; | ((Э) Используя сладости типа «Skittles», «M&M’s» или монеты, позвольте учащимся смоделировать процесс распада и начертить график. (К) Предложите учащимся на основе полученного графика ответить на вопросы: -по какому принципу осуществляется распад атомов; - можно ли определить сколько времени необходимо для распада всех атомов. Предоставьте данные о периоде полураспада ряда радиоактивных элементов. (Г) Попросите учащихся сформулировать определение для понятия «период полураспада». (О) Предложите учащимся начертить кривую распада Bi-212 или Pa-234 . | Они увидят неопределенность. Объясните, что невозможно выразить точно срок жизни радиоактивного изотопа Они заметят, что предел и продолжительность распада некоторых элементов может составлять многие миллиарды лет. | Видео: Моделирование радиоактивного распада https://yandex.kz/video/search?text=modeling%20of%20radioactive%20decay | |
| 9.1.2.7 понимать, что при ра ядра выделяется энергия; 9.1.2.8 оценивать перспективы развития атомной промышленности в Казахстане; 9.1.2.9 объяснять воздействие атомной промышленности на окружающую среду | (У, К) Покажите учащимся видео/анимацию, демонстрирующее выделение энергии при разложении ядра атома. (Г) Методом «мозгового штурма» обсудите вопросы об использовании атомной энергии и привести конкретные примеры ее применения в мирных целях. (И К) Предложите учащимся информацию о развитии атомной энергетики в Казахстане и попросите их определить направления перспективного развития атомной промышленности. (Г) Попросите учащихся составить ментальную карту, в которой отображены проблемы окружающей среды связанные с использованием атомной промышленности. (Г) Организуйте дебаты на тему: «Атомная электростанция в моем регионе». | Подготовьте информацию в контексте вашего региона Предоставьте учащимся достаточно материалов из средств массовой информации, и т.д., включая информацию о некоторых недавних стихийных бедствиях. | Ядерная энергия (англ.): https://www.youtube.com/watch?v=d7LO8lL4Ai4 Анимационное видео: Nuclear fission and fusion http://www.bbc.co.uk/schools/gcsebitesize/science/add_aqa_pre_2011/radiation/nuclearact.shtml Применение ядерной энергии http://snapshotscience.co.uk/is-nuclear-power-too-risky/ Видео: АО «Ульбинский металлургический завод» http://www.ulba.kz/ru/video.htm Аварии на атомных станциях и т.д.: http://chemister.ru/Database/words-description.php?dbid=1&id=101 |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
План урока
Перед планированием урока обратитесь к среднесрочному плану. Планы уроков могут быть разработаны на основании предложенного шаблона
| Раздел долгосрочного плана: | ||||||||
Школа:
Дата:
ФИО учителя:
Класс:
Количество присутствующих:
Тема урока
Цели урока
Определите цели на урок. Они могут быть идентичны целям обучения (ЦО) или могут быть адаптированы для данного урока в случае долгосрочного характера ЦО (если для достижения ЦО требуется несколько уроков).
Критерии успеха
Скопируйте критерии успеха из документа Методические рекомендации для учителя по формативному оцениванию (ФО) для отобранной ЦО.
Языковые цели
Привитие ценностей
Укажите ценности из Интегрированной образовательной программы и национальные, общечеловеческие ценности, на привитие которых направлен данный урок.
Привитие ценностей осуществляется посредством/через… (описание деятельности и/или содержания темы).
Межпредметные связи
Предварительные знания
Что учащиеся уже знают или что им нужно знать перед этим уроком? (основные понятия, факты, формулы, теории)
Ход урока
Запланированная деятельность на уроке
Ресурсы
В начале урока сделать акценты на:
- концентрацию внимания учащихся
- совместно с учащимися определить цели урока/ЦО
- определить «зону ближайшего развития» учащихся, ожидания к концу урока
Рефлексия по уроку
Были ли цели урока/цели обучения реалистичными?
Все ли учащиеся достигли ЦО?
Если нет, то почему?
Правильно ли проведена дифференциация на уроке?
Выдержаны ли были временные этапы урока?
Какие отступления были от плана урока и почему?
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки.
Общая оценка
1:
2:
Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
Класс
Астана 2018
Содержание
О языковых целях. 3
Долгосрочный план. 5
9.1А Основные классы неорганических соединений. 11
9.1В Периодическая система химических элементов. 19
9.1С Строение вещества. 26
9.2А Растворение и растворы.. 33
9.2В Неорганический анализ. 47
9.3A Металлы и сплавы.. 56
9.3B Химия элементов 1, 2-ой и 13-ой групп. 63
9.3C Неметаллы и их соединения (Группы 16 и 17) 70
9.3D Скорость химических реакций. 78
9.4A Химия кремния - Группа 14. 84
9.4B Химические вещества в организме человека. 90
9.4C Радиохимия. 96
План урока. 103
О языковых целях
Каждый предмет имеет свой собственный стиль речи, который можно назвать "академическим языком" конкретного предмета. Академический язык является ключевым инструментом для изучения предметного содержания и улучшения способности думать и работать с понятиями предмета. Большинство учащихся, обучающихся через второй или третий языки, нуждаются в поддержке на протяжении всего процесса обучения для того, чтобы освоить академический язык и предметное содержание. В контексте трехъязычного образования, развитие академического языка на первом языке также требует постоянного внимания, и то ограниченное время, отведенное на обучение через первый язык, должно использоваться эффективно и результативно.
Языковые цели являются важным инструментом для овладения академическим языком. От того, насколько ясно сформулированы языковые цели, будет зависеть понимание учащимися того, что от них ожидается. Кроме того, языковые цели помогут учителям и учащимся создавать, измерять и поддерживать мотивацию к учебе. Учителя-предметники, которые поддерживают постоянный двойной фокус, как на изучение предметного содержания, так и на развитие академического языка, показывают учащимся пример и помогают обучаться и тому, и другому.
Для поддержания обучения академическому языку, учителям рекомендуется включать следующие цели обучения в учебные планы:
• акцентирование внимания учащихся на академическом языке (например, лексика, включающая терминологию и фразы, необходимые для достижения целей обучения предмета);
• предоставление рабочего языка на уроке, необходимого для работы с понятиями предметного содержания (например, фразы, необходимые для: работы в группе, умения задавать вопросы, проведения анализа ситуации, дискуссии/дебатов);
• предварительное обучение и, прежде всего, предварительное использование в уместном контексте лексики, включая терминологию и фразы, необходимые для того, чтобы научиться правильно использовать их в предмете;
• использование учащимися всех четырех языковых навыков в различных комбинациях (например, чтение-аудирование, чтение-письмо, чтение-говорение, аудирование-письмо, и т.д.) для достижения различных целей;
• вовлечение учащихся в диалог-дискуссию (например, не принимать односложные ответы от учащихся и не задавать вопросы, ответы на которые просто демонстрируют знание; побуждать учащихся использовать знания для эффективного обсуждения, а также предоставлять богатый лексический запас, чтобы учащиеся могли поддержать диалог);
• развитие навыков обучения, характерных для языка (например, избирательное прослушивание, разъяснение, развитие металингвистического и метакогнитивного осознания, перефразирование и навыки пользования словарем);
• поощрение критического размышления о языке (например, сравнение языков, поощрение учащихся использовать язык более точно, оценивание прогресса в изучении языка);
• постановка языковой цели в начале урока и обсуждение прогресса в достижении этой цели в конце урока.
Пример языковой цели представлен в каждом разделе учебного плана. Пример языковой цели также включает в себя компоненты академического языка, на использование и запоминание которого важно обратить внимание учащихся. Они указаны под следующими заголовками:
(1) лексика и терминология, специфичная для предмета,
(2) набор полезных фраз для диалога/письма. Если язык понятен и ясен для учащихся, это поможет им достичь как предметные цели, так и цели в изучении языка.
Для создания языковых целей можно использовать следующие глаголы: анализировать, распределять по категориям, выбирать, классифицировать, сравнивать, связывать, сопоставлять, копировать, создавать, критиковать, определять, описывать, разрабатывать, оценивать, объяснять, приводить примеры, предполагать, выявлять, обосновывать, вести переговоры, прогнозировать, производить, предлагать альтернативные решения, указывать причины почему, пересматривать, реорганизовывать, перефразировать, пересказывать, пересматривать, переписать, играть в ролевые игры, обобщать, синтезировать и писать, использовать для различных целей, писать своими словами определение, иллюстрировать.
Несмотря на то, что некоторые языковые цели могут считаться целями предметного содержания, процесс разделения содержания и языка поможет учащимся поддерживать двойной фокус, как на содержании, так и языке. Это также поможет сбалансировать внимание, уделяемое как ответам/решениям, так и процессам, используемым для нахождения этих ответов/решений. В частности, фокусируясь на этих процессах, можно способствовать более точному использованию языка и улучшению мыслительной деятельности.
На уроках неязыковых дисциплин большинство целей обучения будут сосредоточены на содержании, но хотя бы одна должна быть сосредоточена на развитии языка.
Долгосрочный план
Класс: 9
| Раздел долгосрочного плана | Темы/Содержание раздела долгосрочного плана | Цели обучения | ||
Четверть
А Основные классы неорганических соединений
(9 ч)
9.4.1.1 знать состав, классификацию и номенклатуру оксидов, кислот, оснований, солей;
9.4.1.2 знать основные химические свойства кислотных, основных и амфотерных оксидов;
9.4.1.3 исследовать основные химические свойства кислот;
9. 4.1.4 исследовать химические свойства растворимых и нерастворимых оснований;
Соли
Лабораторная работа №4 «Изучение химических свойств солей»
9. 4.1.5 знать способы получения солей;
9. 4.1.6 исследовать основные химические свойства солей;
9. 4.1.7 объяснять генетическую связь между основными классами неорганических соединений;
9 . 2.3.1 вычислять количество, массу, объём вещества по известному количеству, массе или объёму реагента или продукта;
Дата: 2019-03-05, просмотров: 540.