Цель работы: ознакомиться с применением первого начала термодинамики к процессам в газах.
Задача работы: определить отношение удельных теплоемкостей воздуха при постоянном давлении и объеме методом Клемана-Дезорма.
Теоретическая часть
Теплоемкостью тела называется физическая величина, численно равная количеству теплоты, которое нужно подвести к телу или отнять от него для изменения его температуры на 1K. Теплоемкость, отнесенная к единице массы вещества, называется удельной теплоемкостью; теплоемкость, отнесенная к одному молю вещества, называется молярной. Обе эти величины являются характеристикой вещества, из которого состоит тело.
Из определения теплоемкости следует, что она выражается в Дж/К. Удельная теплоемкость измеряется в Дж/(кг*К), а молярная - в Дж/(моль*К). Между молярной теплоемкостью  и удельной
и удельной 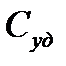 существует очевидное соотношение
существует очевидное соотношение  . где
. где 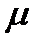 - молярная масса вещества. Если моль вещества нагревается не на 1К, а на
- молярная масса вещества. Если моль вещества нагревается не на 1К, а на 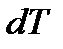 , то количество затраченной теплоты равно
, то количество затраченной теплоты равно 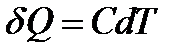 . Откуда
. Откуда
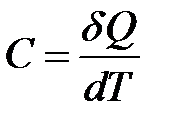 (2-6.1)
(2-6.1)
Согласно первому началу термодинамики, количество теплоты, сообщаемое термодинамической системе, идет на изменение ее внутренней энергии 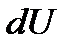 и на совершение работы
и на совершение работы  :
:
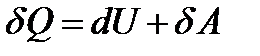 .
.
Если нагревание происходит в условиях, когда объем остается постоянным, то соответствующая теплоемкость называется теплоемкостью при постоянном объеме, или изохорической теплоемкостью, и обозначается 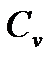 :
:
 .
.
Так как теплота при этом тратится лишь на изменение внутренней энергии 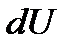 (свойство идеального газа), то
(свойство идеального газа), то
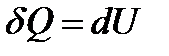 и
и  ,
,
откуда
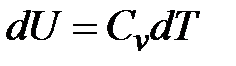 .
.
Если же при нагревании остается неизменным давление, то теплоемкость называется теплоемкостью при постояном давлении, или изобарической теплоемкостью, и обозначается 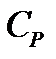 :
:
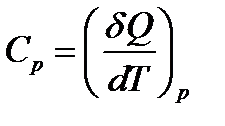 ,
,
откуда
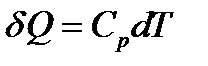 .
.
Первое начало термодинамики принимает вид:
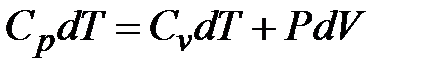 ,
,
откуда
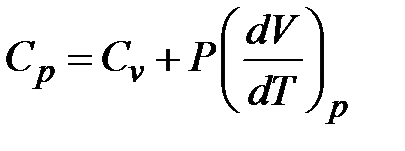 .
.
| М |

| Б |
| К |
| Н |
| Рис. 2-6.1. Схема экспериментальной установки |
| М |

| Б |
| К |
| Н |
| Рис. 2-6.1. Схема экспериментальной установки |
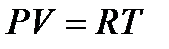 следует, что
следует, что 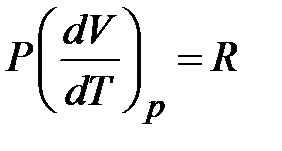 , т.е.
, т.е.  (уравнение Роберта Майера). Оно показывает, что
(уравнение Роберта Майера). Оно показывает, что 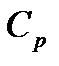 больше
больше 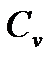 на величину универсальной газовой постоянной
на величину универсальной газовой постоянной  .
.
Величина отношения теплоемкостей газов  обозначается
обозначается 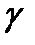 . Она зависит от сорта газа, т. е. числа степеней свободы ( i ) молекул газа. В классической теории теплоемкостей
. Она зависит от сорта газа, т. е. числа степеней свободы ( i ) молекул газа. В классической теории теплоемкостей 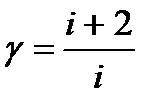 . Соответственно для одноатомных газов (
. Соответственно для одноатомных газов ( 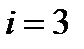 ),
), 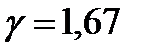 , для двухатомных (
, для двухатомных ( 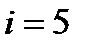 ),
), 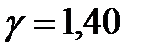 , и для трех- и многоатомных газов с нелинейными жесткими молекулами (
, и для трех- и многоатомных газов с нелинейными жесткими молекулами (  ),
), 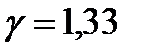 . Величина
. Величина 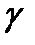 играет важную роль в теории теплоемкостей газов. Она входит в уравнение Пуассона (
играет важную роль в теории теплоемкостей газов. Она входит в уравнение Пуассона (  ). Зная
). Зная 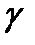 , можно не прибегая к непосредственному измерению
, можно не прибегая к непосредственному измерению 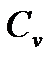 , которое порой затруднено, оценить эту величину.
, которое порой затруднено, оценить эту величину.
Существует несколько способов измерения 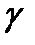 . В данной работе представлен способ оценки величины
. В данной работе представлен способ оценки величины 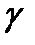 методом Клемана-Дезорма.
методом Клемана-Дезорма.
Дата: 2019-03-05, просмотров: 402.