Установка ФПТ 1-11 состоит из двух основных частей:
1. Приборный блок
2. Рабочий элемент
| Т1 |
| Т3 |
| Т, оС |
| Т2 |
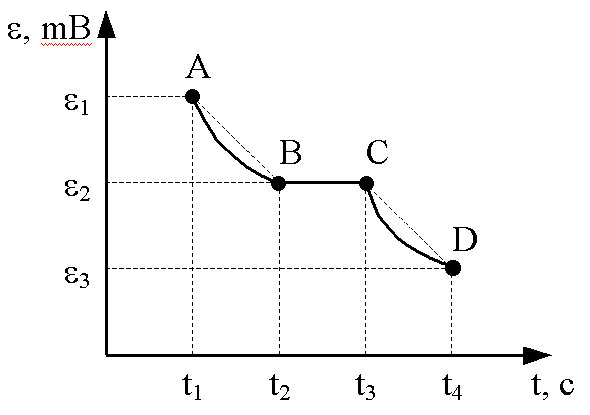
| Рис. 2-5.4 График зависимости температуры в тигле от времени |
На лицевой панели приборного блока расположены органы управления и регулирования установки, цифровой контроллер для измерения времени, амперметр и вольтметр. Рабочий элемент представляет собой коробчатый конструктив, укрепленный на стойке. Спереди он закрыт экраном из оргстекла. На передней панели закреплен кронштейн, на котором установлен стакан с исследуемым материалом – оловом. В стакане размещены нагреватель и датчик температуры. Нагреватель выполнен из нихромовой спирали, заключенной в кожух из кварцевого стекла.
Измерение температуры производится цифровым контроллером c пределом измерения около 3000С, с помощью которого производится запись температуры в зависимости от времени T = f ( t ).
Теплота плавления металла определяется методом наблюдений средних скоростей охлаждения металла до и после кристаллизации. Теплоту плавления металла вычисляют по графику зависимости температуры остывающего (или нагревающегося) металла от времени, получаемого экспериментально. Аналогичный график представлен на рис.4. Участок AB соответствует остыванию жидкого металла, участок CD – охлаждению твердого металла.
Энтропия – интересная и необычная функция состояния термодинамической системы, это понятие непосредственно связано со вторым началом термодинамики. Энтропией называется функция состояния “S”, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества теплоты dQ, сообщённого системе, к температуре, при которой этот переход произошёл: 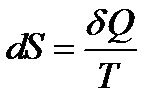 .
.
Однако все реальные процессы в природе необратимы. Для необратимых процессов изменение энтропии 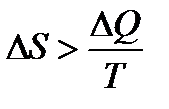 , т. е. при переходе системы из одного состояния в другое энтропия всегда возрастает. Каких-либо исключений из этого правила не обнаружено. Поэтому обобщённая формулировка второго начала термодинамики читается так: полная энтропия произвольной системы вместе с её окружением в любых естественных процессах увеличивается, т. е. DS>0.
, т. е. при переходе системы из одного состояния в другое энтропия всегда возрастает. Каких-либо исключений из этого правила не обнаружено. Поэтому обобщённая формулировка второго начала термодинамики читается так: полная энтропия произвольной системы вместе с её окружением в любых естественных процессах увеличивается, т. е. DS>0.
Рассмотрим процесс плавления металла. Процесс передачи тепла является необратимым, поэтому выражение второго начала термодинамики следует использовать в форме 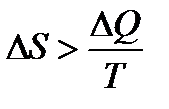 . Как же тогда вычислить величину приращения энтропии
. Как же тогда вычислить величину приращения энтропии 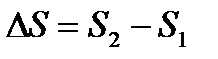 для реального необратимого процесса – плавления металла? Энтропия является функцией состояния, поэтому для оценки DS можно использовать выражение для какого-либо обратимого процесса, т. к. когда тела вошли в тепловой контакт, то начальное и конечное состояния каждого тела одинаковы.
для реального необратимого процесса – плавления металла? Энтропия является функцией состояния, поэтому для оценки DS можно использовать выражение для какого-либо обратимого процесса, т. к. когда тела вошли в тепловой контакт, то начальное и конечное состояния каждого тела одинаковы.
Пусть тигель с металлом приведён в контакт с нагревателем (тепло передаётся от более нагретого тела при температуре Т1 к менее нагретому телу – металлу с температурой Т2, причём Т1 > Т2). Тогда количество теплоты 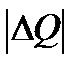 , взятое у более нагретого тела – тигля, приведёт к уменьшению его энтропии на
, взятое у более нагретого тела – тигля, приведёт к уменьшению его энтропии на 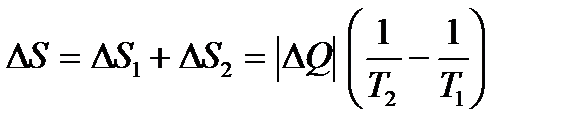 ; т. к. T1 > T2, то DS > 0. Таким образом, энтропия одного тела уменьшается, а другого увеличивается, но полное изменение энтропии является положительным.
; т. к. T1 > T2, то DS > 0. Таким образом, энтропия одного тела уменьшается, а другого увеличивается, но полное изменение энтропии является положительным.
Оценим это приращение количественно:
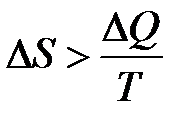 , (2-5.1)
, (2-5.1)
где 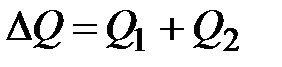
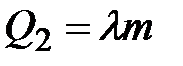
с, m – теплоёмкость и масса металла,
Тпл – температура плавления металла,
Т1 – комнатная температура,
l -удельная теплота плавления металла.
Тогда
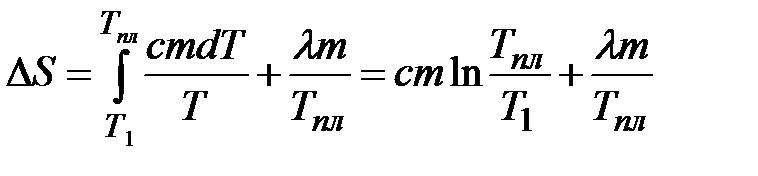 . .
| (2-5.2) |
Физический смысл понятия “энтропия” был раскрыт Больцманом в выражении S = klnW, где k – постоянная Больцмана, W – количество микросостояний, соответствующих данному макросостоянию системы (стат. вес). Согласно этой интерпретации понятие энтропии связывается с более привычными понятиями “порядок” и “беспорядок”. Энтропию системы можно рассматривать как количественную меру беспорядка в системе. При этом второе начало термодинамики звучит так: естественные процессы стремятся перевести систему в состояние с большим беспорядком. Когда металл при плавлении превращается в жидкость, энтропия жидкого металла увеличивается. В твёрдом состоянии его структура более упорядочена, чем в жидком, где он может растекаться, т. е. упорядоченное расположение металла в кристаллической решётке сменилось неупорядоченным, в известной мере, случайным движением молекул в жидком состоянии. Таким образом, процессы плавления металла сопровождаются приращением энтропии.
Порядок выполнения работы
1. Вывести на минимум ручки потенциометров и тумблеры в исходное положение
2. Подать на установку питание, включив тумблер «ВКЛ» в модуле «СЕТЬ».
3. Включить тумблер «ВКЛ» в модуле «НАГРЕВ».
4. Регулятором «НАГРЕВ» модуля установить заданную мощность нагрева. Нагреть образец немного выше температуры плавления (  ). Отключить нагрев.
). Отключить нагрев.
5. Снять зависимость температуры как функции времени Т= f ( t ) в процессе охлаждения и кристаллизации образца. Показания регистрировать через 15 секунд (до 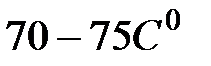 ).
).
6. Построить график зависимости Т = f ( t ). Для нахождения точек A и D на оси абсцисс влево и вправо откладывать отрезки Dt, равные времени кристаллизации металла, 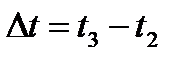 (участок ВС на кривой).
(участок ВС на кривой).
7. Оценить приращение энтропии по формуле (2), исходя из экспериментальных результатов, полученных для олова (масса образца m=0,15кг). Сделать выводы.
Контрольные вопросы и задания
1. Что называется переходом первого рода?
2. Что понимается под фазой вещества?
3. Являются ли различными фазами вещества твёрдое и жидкое стекло?
4. Чем отличаются кристаллические твёрдые тела от аморфных твёрдых тел?
5. Что происходит при плавлении твёрдых кристаллических тел и аморфных тел?
6. Что называется скрытой теплотой перехода? Почему при одних фазовых превращениях она поглощается, а при других выделяется?
7. В чём суть метода определения удельной теплоты плавления металлов?
8. Почему при кристаллизации температура остаётся постоянной, хотя мы продолжаем охлаждать металл?
9. Запишите математическое выражение второго начала термодинамики.
10. В чём заключается физический смысл понятия энтропии?
11. Как объяснить приращение энтропии при плавлении металла?
Список рекомендуемой литературы
1. Матвеев А. Н. Молекулярная физика. М.: Высш. шк., 1987.
2. Сивухин Л. В. Общая физика. Т. 2. М. – : Наука, 1993.
3. Иверонова В. И. Физический практикум. Ч. 1. М.: Высш. шк., 1968.
Лабораторная работа 2-6
Дата: 2019-03-05, просмотров: 469.