Изменение распределения вентиляции в легких при различных заболеваниях происходит при участии лишь нескольких патофизиологических механизмов
(РИСМ3но°гие распространенные заболевания, такие как бронхиальная астма и хрони^ ческий бронхит, характеризуются повышением сопротивления ВП (гл. 2,4,5 и 6). В
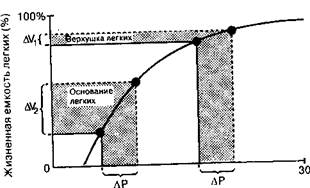
Рис. 3-8. График давление объем. Изменения объема двух областей легкого показаны во время приложения расправляющего давления (АР). Изменение объема легкого у его основания (AV2) больше, чем изменение на верхушке (AV,)-Даже, если принять во внимание тот факт, что у основания количество альвеол больше, чем на верхушке, большее изменение объема базальных зон легких сохраняется (рис 3-9). (По: Murray J. F. Ventilation. In: Murray J F., ed. The Normal Lung 2nd ed.
Глава 3. Распределение вентиляции
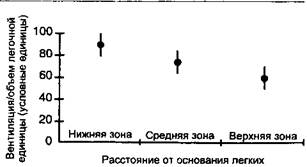
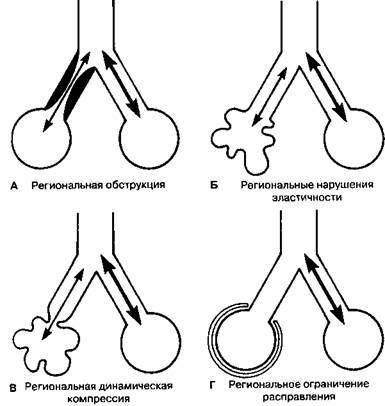
Рис. 3-10. Моде.in неравномерной иептиля-ции легких (А) Чаг-тичiк\я обе гру кцмя ВII в одной легочной единице- (Б) Нарушенная ,)лаети11мосгъ н одной легочной единице. (В) Локализованная дина-м и ч ее к ая ко м 11 po(: cf и я ВП » одной легочной один и не. (Г) Ограниченное растяжение одной единицы во время наполнения легкого. В каждой модели нормальная единица получает большую часть общего вдыхаемого объема. ( П о: F о г s -ter R. E. II, Dubois А. В., Briscoe W. A, Fisher А В. Pulmonary ventilation. In: The Lung: Physiologic Basis of Pulmonary Function Tests. 3rd ed. Chicago: Year Book Medical Pudlishers, 1986; 61.)
В ранней фазе выдоха выводится воздух из верхних дыхательных путей. Поскольку эта область содержит чистый кислород, заполнивший ее после предшествующего вдоха, то содержание там азота равно нулю (фаза I). Далее азотсодержащий газ анатомического мертвого пространства вымывается по мере опорожнения альвеол: концентрация азота резко возрастает (фаза II). Вслед за этим выдыхается альвеолярный газ. У здоровых людей с минимальной неоднородностью вентиляции эта фаза кривой (фаза III) плоская, и она известна как альвеолярное плато.
У пациентов с разнообразными болезнями паренхимы и BII фаза III не плоская. 11аклон фазы III (% концентрации N^/л выдыхаемого объема) фактически является мерой неоднородности вентиляции. Очевидно, что плохо вентилируемые зоны легких получают мало вдыхаемого кислорода. Соответственно эти регионы имеют высокую альвеолярную концентрацию азота по сравнению с нормально вентилируемыми областями, т. е. наблюдается меньшее разведение азота вдыхаемым кислородом. Плохо вентилируемые области опустошаются в последнюю очередь, что и обеспечивает повышение концентрации азота в течение фазы III.
На рис. 3-11 можно видеть еще один заметный подъем концентрации азота после альвеолярного плато (фаза IV). Предполагаемым механизмом, лежащим в основе фазы IV, является закрытие мелких ВП, расположенных у основания легких, при низких легочных объемах.
В период начальной фазы вдоха чистого кислорода мелкие ВП (дыхательные бронхиолы), расположенные в базальных зонах, могут быть сдавлены собственным весом легких вплоть до их закрытия. Как следствие, эти зоны получают малую долю кислорода, попадающего в легкие и начале вдоха. Тем временем вдох до уровня
Рис. 3-9. Измерении региональной легочной вентиляции с помощью ингаляции радиоактивного ксенона. Испытуемый вдыхает определенный объем воздуха, содержащего ксенон-133. Счетная камера сканирует верхние, средние и нижние легочные зоны для количественной оценки региональной вентиляции. Каждое региональное измерение делится па объем легкого ("нормализуется"). Поскольку легкие имеют больший объем у оснований
(где находится больше альвеол), предполагается, что туда поступит больше ксенона. Однако даже с учетом апикалыю-базалыюй разницы в объеме легких вентиляция базальных отделов больше. (Mo: West J. В. Ventilation. In: Respiratory Physiology: The Essentials. 4th eel. Baltimore: Williams & Wilkins, 1990: 19.)
легких это явление, как правило, выражено неравномерно. Рис. 3-10 А представляет две идеальные легочные единицы, одна из которых вентилируется через ВП с нормальным сопротивлением, а другая — с увеличенным.. При каждом вдохе большая часть вдыхаемого объема распределяется в единице без обструкции. Общая эффективность газообмена будет зависеть от степени перераспределения кровотока от единицы с обструкцией к нормально вентилируемой.
На рис. 3-1 ОБ видно, как локализованные изменения эластичности легких (обратная величина растяжимости, как описано в гл. 2) создают неравномерное распределение вентиляции. Такого рода нарушения характерны для эмфиземы (эластичность снижена) и легочного фиброза (эластичность повышена). В ходе повторяющихся дыхательных циклов легочные единицы с увеличенной эластичностью получают большую часть вдыхаемого объема. При некоторых болезнях, например эмфиземе, может преобладать сочетание регионально измененных растяжимости и сопротивления ВП (рис. 3-1 ОБ). Возникая на выдохе, такое увеличение сопротивления ВП является "динамическим" (гл. 2, рис. 2-20). В результате наблюдается заметная неравномерность вентиляции: преобладающая часть вдыхаемого газа идет к областям без обструкции с нормальной растяжимостью.
Наконец, при некоторых заболеваниях сопротивление ВП и эластичность легких могут быть нормальными, а нарушение распределения вентиляции происходит из-за региональных ограничений расправления легких (рис. 3-1ОГ). Клинические примеры включают компрессию легкого плевральным выпотом и ограничение расширения половины грудной клетки при одностороннем параличе диафрагмы.
Дата: 2019-03-05, просмотров: 341.